23-24高一下·全国·课后作业
名校
1 . 为研究不同状态 块状、粉末状
块状、粉末状 碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的
碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的
 块状、粉末状
块状、粉末状 碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的
碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的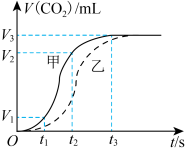
| A.曲线乙表示的是粉末状碳酸钙固体与盐酸反应 |
| B.随着反应进行,盐酸浓度降低,反应速率不断降低 |
C.若用单位时间内 的体积变化来表示该反应的速率,则甲线中 的体积变化来表示该反应的速率,则甲线中 时间内平均反应速率为 时间内平均反应速率为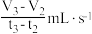 |
D.两次实验,粉末状固体最终生成的 的量更多 的量更多 |
您最近一年使用:0次
2024-02-24更新
|
455次组卷
|
3卷引用:6.2.1化学反应的速率课后作业提高篇
(已下线)6.2.1化学反应的速率课后作业提高篇新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题广东省广州市广东番禺中学2023-2024学年高一下学期期中考试化学试题
23-24高二上·全国·课时练习
解题方法
2 . 某实验小组利用压强传感器,数据采集器和计算机等数字化实验设备组成数据采集系统,探究外界条件对双氧水分解速率的影响。实验装置(如图)和所完成实验编号如下。请回答下列问题。
资料显示:通常情况下, 较稳定,不易分解。
较稳定,不易分解。
实验药品:2%H2O2、 、
、 、
、

(1)用化学方程式表示实验原理_______ 。
(2)编号①和②的实验目的是_______ 。
(3)编号③④⑤探究的是不同催化剂条件下双氧水的分解速率,实验结果如图所示。说明图中曲线的含义_______ 。结合实验条件,分析三条曲线的区别_______ 。

资料显示:通常情况下,
 较稳定,不易分解。
较稳定,不易分解。实验药品:2%H2O2、
 、
、 、
、

| 实验编号 | 实验药品 | 催化剂 |
| ① |  溶液 溶液 |  |
| ② |  溶液 溶液 |  |
| ③ |  溶液 溶液 | 无催化剂 |
| ④ |  溶液 溶液 |  |
| ⑤ |  溶液 溶液 |  |
(1)用化学方程式表示实验原理
(2)编号①和②的实验目的是
(3)编号③④⑤探究的是不同催化剂条件下双氧水的分解速率,实验结果如图所示。说明图中曲线的含义

您最近一年使用:0次
3 . 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的Cr2O 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。

(2)上述反应后草酸被氧化为___________ (填化学式)。
(3)实验①和②的结果表明___________ ;实验①中0~t1时间段反应速率v(Cr3+)=___________ mol·L-1·min-1(用代数式表示)。
 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为
(3)实验①和②的结果表明
您最近一年使用:0次
4 . 在一定条件下,合成氨的反应速率与各物质的浓度关系为v=kc(N2)·c1.5(H2)·c-1(NH3),下列条件不能加快反应速率的是
| A.加入催化剂 | B.增大H2的浓度 | C.升高温度 | D.增大NH3的浓度 |
您最近一年使用:0次
5 . 10mL浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是
| A.K2SO4 | B.NaCl | C.CuSO4 | D.Na2CO3 |
您最近一年使用:0次
6 . 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图所示(其他条件相同)。则下列有关说法正确的是


| A.若增大压强,该反应的反应速率一定增大 |
| B.pH=6.8时,随着反应的进行反应速率逐渐增大 |
| C.一定pH范围内,溶液中H+浓度越大,反应速率越快 |
| D.可采用调节pH的方法使反应停止 |
您最近一年使用:0次
名校
7 . 为探究锌与0.1 mol/L稀硫酸的反应速率[以υ(H2)表示],对反应物作出如下改变。下列判断正确的是
| A.加入NH4HSO4固体,υ(H2)不变 |
| B.加入少量水,υ(H2)减小 |
| C.把0.1 mol/L稀硫酸改为0.2 mol/L盐酸,υ(H2)增大 |
| D.把稀硫酸改为98%的浓硫酸,υ(H2)增大 |
您最近一年使用:0次
2023-08-27更新
|
771次组卷
|
4卷引用:作业(十四) 外界条件对化学反应速率的影响
8 . 下列实验原理和装置能达到实验目的的是
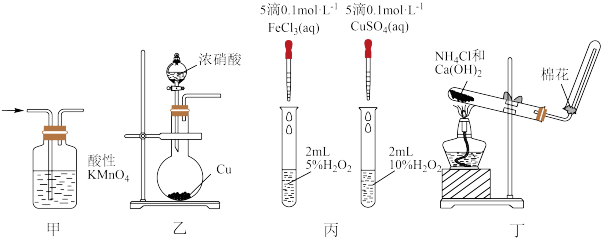
A.实验甲:除去乙烯中的 气体 气体 |
B.实验乙:制取 气体 气体 |
C.实验丙:探究 、 、 对 对 分解速率的影响 分解速率的影响 |
| D.实验丁:实验室制取氨气 |
您最近一年使用:0次
9 . Ⅰ.在一定温度下,4 L恒容密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示。回答下列问题:

(1)根据题中数据写出该反应的化学方程式:________________ , 时刻,N的平均速率为
时刻,N的平均速率为______ 。
(2) 、
、 、
、 三个时刻中,处于平衡状态的为
三个时刻中,处于平衡状态的为______ (填“ ”“
”“ ”或“
”或“ ”),
”), 后的某一时刻给体系升高温度,v(正)将
后的某一时刻给体系升高温度,v(正)将______ (填“增大”或“减小”)。
(3)平衡后容器中气体的压强和反应前气体的压强之比是______ ,平衡时N的转化率为______ 。
Ⅱ.某学习小组利用铁与稀硫酸的反应,探究影响化学反应速率的因素,结果如下表:
(4)实验1、2表明______ 对反应速率有影响。
(5)探究温度对反应速率的影响的实验是______ (填实验序号)。
(6)实验开始后,会出现速率加快,一段时间后速率减慢,分析其原因____________________ 。

(1)根据题中数据写出该反应的化学方程式:
 时刻,N的平均速率为
时刻,N的平均速率为(2)
 、
、 、
、 三个时刻中,处于平衡状态的为
三个时刻中,处于平衡状态的为 ”“
”“ ”或“
”或“ ”),
”), 后的某一时刻给体系升高温度,v(正)将
后的某一时刻给体系升高温度,v(正)将(3)平衡后容器中气体的压强和反应前气体的压强之比是
Ⅱ.某学习小组利用铁与稀硫酸的反应,探究影响化学反应速率的因素,结果如下表:
实验序号 | 铁的质量(g) | 铁的形态 | V(H2SO4)(mL) | c(H2SO4)( | 反应前溶液的温度(℃) | 金属完全消失的时间(s) |
1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
(5)探究温度对反应速率的影响的实验是
(6)实验开始后,会出现速率加快,一段时间后速率减慢,分析其原因
您最近一年使用:0次
10 . 某实验小组为了探究 、
、 对H2O2分解速率的影响(忽略氯离子的影响),用30%的H2O2,设计了如下实验(忽略固体对溶液体积的影响):
对H2O2分解速率的影响(忽略氯离子的影响),用30%的H2O2,设计了如下实验(忽略固体对溶液体积的影响):
每隔5 min,记录收集到的气体体积(标准状况下),经过30分钟反应后,得到如下数据。
请回答:
(1)表格中a的值约为___________ ,X为___________ 。
(2)第二组0−5 min内,H2O2的反应速率为___________  。
。
(3)通过数据分析,本次实验的结论为___________ 。
(4)小组成员为了进一步了解 催化H2O2的原理,查阅相关资料后,进行了如下实验:
催化H2O2的原理,查阅相关资料后,进行了如下实验:
取5 mL 30% H2O2放入烧杯内,加水稀释至30 mL,加入1.625 g FeCl3,每隔一段时间取2 mL溶液,滴加铁氰化钾溶液,试管中的颜色变化如图所示。(已知:铁氰化钾可与 生成蓝色沉淀)
生成蓝色沉淀)

请用离子方程式 表示试管②对应的时间内,烧杯中发生的主要化学反应___________ 。
(5)请在图中画出烧杯内溶液的pH变化趋势图___________ 。

 、
、 对H2O2分解速率的影响(忽略氯离子的影响),用30%的H2O2,设计了如下实验(忽略固体对溶液体积的影响):
对H2O2分解速率的影响(忽略氯离子的影响),用30%的H2O2,设计了如下实验(忽略固体对溶液体积的影响):| 分组 | 30% H2O2 | 温度/℃ | 添加离子 |
| ① | 6 mL | 60 | 无 |
| ② | 6 mL | 60 | 0.1625 g FeCl3 |
| ③ | 6 mL | 60 | a g X(盐) |
| 0 min | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
| ① | 0 mL | 0.8 mL | 3.3 mL | 7.8 mL | 9.1 mL | 11.2 mL | 11.2 mL |
| ② | 0 mL | 67.2 mL | 89.6 mL | 100 mL | 108 mL | 108 mL | 108 mL |
| ③ | 0 mL | 0.9 mL | 3.6 mL | 8.2 mL | 9.3 mL | 11.5 mL | 11.5 mL |
(1)表格中a的值约为
(2)第二组0−5 min内,H2O2的反应速率为
 。
。(3)通过数据分析,本次实验的结论为
(4)小组成员为了进一步了解
 催化H2O2的原理,查阅相关资料后,进行了如下实验:
催化H2O2的原理,查阅相关资料后,进行了如下实验:取5 mL 30% H2O2放入烧杯内,加水稀释至30 mL,加入1.625 g FeCl3,每隔一段时间取2 mL溶液,滴加铁氰化钾溶液,试管中的颜色变化如图所示。(已知:铁氰化钾可与
 生成蓝色沉淀)
生成蓝色沉淀)
请用
(5)请在图中画出烧杯内溶液的pH变化趋势图

您最近一年使用:0次

 )
)

