真题
解题方法
1 . 室温下,为探究纳米铁去除水样中 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。
下列说法正确的是
 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。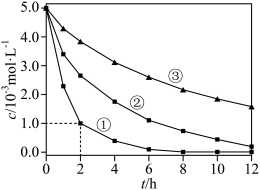
| 实验序号 | 水样体积/ | 纳米铁质量/ | 水样初始 |
| ① | 50 | 8 | 6 |
| ② | 50 | 2 | 6 |
| ③ | 50 | 2 | 8 |
A.实验①中,0~2小时内平均反应速率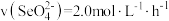 |
B.实验③中,反应的离子方程式为: |
| C.其他条件相同时,适当增加纳米铁质量可加快反应速率 |
D.其他条件相同时,水样初始 越小, 越小, 的去除效果越好 的去除效果越好 |
您最近一年使用:0次
2 . 通过电化学、热化学等方法,将 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:
(1)某研究小组采用电化学方法将 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是_______ 。
 :
: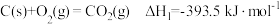
Ⅱ:
Ⅲ: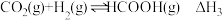
①
_______  。
。
②反应Ⅲ在恒温、恒容的密闭容器中进行, 和
和 的投料浓度均为
的投料浓度均为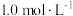 ,平衡常数
,平衡常数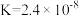 ,则
,则 的平衡转化率为
的平衡转化率为_______ 。
③用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
_______ 。[已知: 时,电离常数
时,电离常数 、
、 ]
]
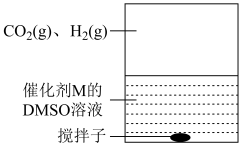
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的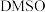 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应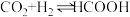 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能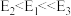 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。
Ⅳ:

V: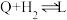

VI: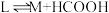

_______ 。
A.v与 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关
C.温度升高,v不一定增大 D.在溶液中加入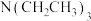 ,可提高
,可提高 转化率
转化率
②实验测得: ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。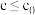 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因_______ 。
 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:(1)某研究小组采用电化学方法将
 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是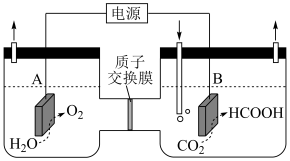
 :
: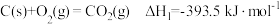
Ⅱ:

Ⅲ:
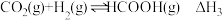
①

 。
。②反应Ⅲ在恒温、恒容的密闭容器中进行,
 和
和 的投料浓度均为
的投料浓度均为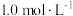 ,平衡常数
,平衡常数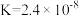 ,则
,则 的平衡转化率为
的平衡转化率为③用氨水吸收
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数 、
、 ]
](3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的
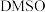 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应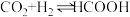 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能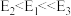 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。Ⅳ:


V:
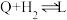

VI:
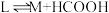

A.v与
 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关C.温度升高,v不一定增大 D.在溶液中加入
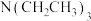 ,可提高
,可提高 转化率
转化率②实验测得:
 ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。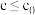 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因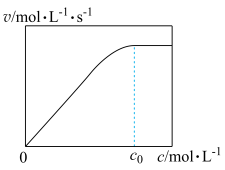
您最近一年使用:0次
2024-02-02更新
|
2195次组卷
|
3卷引用:2024年浙江高考真题化学(1月)
3 . 氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。
(1)“ 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
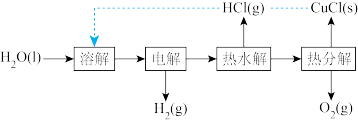
①电解在质子交换膜电解池中进行。阳极区为酸性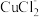 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为_______ (用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有_______ (填元素符号)。
(2)“ 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。
①实验中发现,在 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
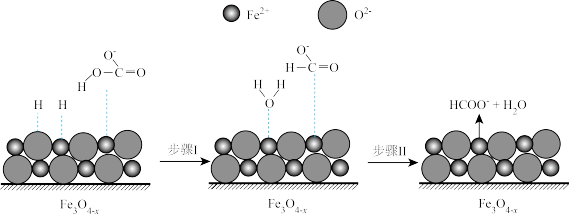
②随着反应进行, 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为_______ 。
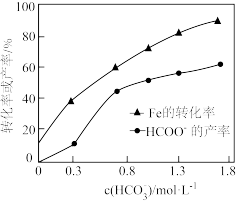
③在其他条件相同时,测得Fe的转化率、 的产率随
的产率随 变化如题图所示。
变化如题图所示。 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是_______ 。
(3)从物质转化与资源综合利用角度分析,“ 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是_______ 。
(1)“
 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
①电解在质子交换膜电解池中进行。阳极区为酸性
 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有
(2)“
 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。①实验中发现,在
 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为②随着反应进行,
 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
③在其他条件相同时,测得Fe的转化率、
 的产率随
的产率随 变化如题图所示。
变化如题图所示。 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是
(3)从物质转化与资源综合利用角度分析,“
 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是
您最近一年使用:0次
2022-07-21更新
|
9605次组卷
|
11卷引用:江苏省2022年普通高中学业水平选择性考试
江苏省2022年普通高中学业水平选择性考试(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)2022年江苏卷高考真题变式题14-17(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题江苏省徐州市第七中学2022-2023学年高三上学期10月学情调研化学试题(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)专题十一 化学能与电能-实战高考·二轮复习核心突破(已下线)江苏省2022年普通高中学业水平选择性考试变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
真题
解题方法
4 . 为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变 | B.加入少量水,v(H2)减小 |
| C.加入CH3COONa固体,v(H2)减小 | D.滴加少量CuSO4溶液,v(H2)减小 |
您最近一年使用:0次
5 . 为研究某溶液中溶质 R的分解速率的影响因素,分别用三份不同初始浓度 R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是
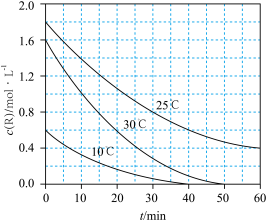

| A.25℃时,10~30min 内,R 的分解平均速率为 0.030 mol·L-1·min-1 |
| B.对比 30℃和 10℃曲线,在同一时刻,能说明 R的分解速率随温度升高而增大 |
| C.对比 30℃和 25℃曲线,在 0~50min 内,能说明R 的分解平均速率随温度升高而增大 |
| D.对比 30℃和 10℃曲线,在 50min 时,R 的分解率相等 |
您最近一年使用:0次
2020-03-17更新
|
4669次组卷
|
33卷引用:2016年10月浙江省普通高校招生选考科目考试化学试题
2016年10月浙江省普通高校招生选考科目考试化学试题浙江省2018版考前特训(2017年10月)学考70快练:化学反应速率及反应限度(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题浙江省宁波市北仑中学2019-2020学年高一上学期期中考试化学(1班)试题浙江省宁波诺丁汉大学附属中学2019-2020学年高二上学期期中考试化学(实验班)试题(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》湖北省襄阳三中2020届高三3月线上月考理综化学试题(已下线)考点08 化学反应速率及其影响因素-2020年高考化学命题预测与模拟试题分类精编湖北省荆州中学2020-2021学年高二上学期9月月考化学试题(已下线)小题必刷27 化学反应速率、图像及其影响因素——2021年高考化学一轮复习小题必刷(通用版本)福建省福州第一中学2021届高三下学期开学考试化学试题浙江省临海市西湖双语实验学校2020-2021学年高二下学期4月第一次月考化学试题辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题选择性必修1(SJ)专题2第一单元易错疑难集训(一)(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)江西省宜春市第九中学2021-2022学年高二上学期第一次月考化学试题(已下线)第七单元 化学反应速率与化学平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题河南省商丘市第一高级中学2021-2022学年高一下学期5月月考化学试题陕西师范大学附属中学2021-2022学年高一下学期期中考试化学试题湖南省衡阳市第一中学2022届高三下学期期中考试化学试题湖南省长沙市麓山国际实验学校2022-2023学年高三上学期入学考试化学试题(已下线)题型114 影响化学反应速率的因素辽宁省本溪市高级中学2022-2023学年高三上学期期中测试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期中考试化学(选考)试题江西省景德镇一中2022-2023学年高一下学期期中考试(18班)化学试题.广东省广州市广外、铁一、广附三校2022-2023学年高一下学期期末联考化学试题浙江省舟山中学2022-2023学年高一下学期5月月考化学试题山东省鄄城县第一中学2022-2023学年高一下学期5月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题河南省周口市周口恒大中学2023-2024学年高二上学期1月期末化学试题
真题
名校
6 . 在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
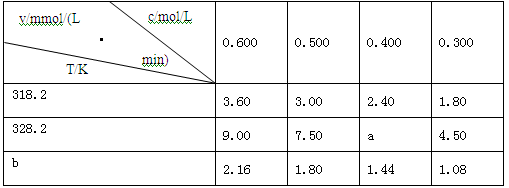

| A.a=6.00 |
| B.同时改变反应温度和蔗糖的浓度,v可能不变 |
| C.b<318.2 |
| D.不同温度时,蔗糖浓度减少一半所需的时间相同 |
您最近一年使用:0次
2019-01-30更新
|
1237次组卷
|
12卷引用:2015年全国普通高等学校招生统一考试化学(福建卷)
2015年全国普通高等学校招生统一考试化学(福建卷)2016届河南省顶级名校高三上学期期中测试化学试卷2015-2016学年江西省南昌八一中学高二上学期10月月考化学试卷2016-2017学年四川省成都市树德中学高二10月阶段性考试化学试卷黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题(已下线)2018年9月9日 《每日一题》人教必修4-每周一测【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题重庆市第三十中学2018-2019学年高二下学期期中考试化学试题四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题十一 化学反应速率和化学平衡(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
真题
名校
7 . I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是___________ 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10、10C+P4O10=P4+10CO,每生成 1molP4时,就有___________ mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素完全氧化,剩余的I2用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为: C6H8O6+I2=C6H6O6+2H++2I- 2S2O +I2=S4O
+I2=S4O +2I-
+2I-
在一定体积的某维生素C溶液中加入amol·L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗bmol·L-1 Na2S2O3溶液V2mL。该溶液中维生素C的物质量是___________ mol。
(4)在酸性溶液中,碘酸钠(KIO)和亚硫酸钠可发生如下反映: 2IO +5SO
+5SO +2H+=I2+5SO
+2H+=I2+5SO +H2O,生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O,生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是___________ ;表中
___________ mL。
II.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3,可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是___________ 。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:__________ ____Ce3++____H2O2+____H2O= ____Ce(OH)4↓+____
(1)磷元素的原子结构示意图是
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10、10C+P4O10=P4+10CO,每生成 1molP4时,就有
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素完全氧化,剩余的I2用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为: C6H8O6+I2=C6H6O6+2H++2I- 2S2O
 +I2=S4O
+I2=S4O +2I-
+2I-在一定体积的某维生素C溶液中加入amol·L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗bmol·L-1 Na2S2O3溶液V2mL。该溶液中维生素C的物质量是
(4)在酸性溶液中,碘酸钠(KIO)和亚硫酸钠可发生如下反映: 2IO
 +5SO
+5SO +2H+=I2+5SO
+2H+=I2+5SO +H2O,生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O,生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:| 0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积VmL | H2O的体积/mL | 实验温度 /C | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |

II.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3,可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
您最近一年使用:0次
2019-01-30更新
|
827次组卷
|
2卷引用:2011年普通高等学校招生全国统一考试化学卷(福建)
真题
名校
8 . 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是


| 组 别 | c(HCl) (mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A.4-3-2-1 | B.1-2-3-4 | C.3-4-2-1 | D.1-2-4-3 |
您最近一年使用:0次
2019-01-30更新
|
467次组卷
|
3卷引用:2008年普通高等学校招生统一考试化学试题(上海卷)
真题
解题方法
9 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________ ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________ ;
(3)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是____________ ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________ (答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=______ ,V6=______ ,V9=______ ;
②反应一段时间后,实验A中的金属呈_____ 色,实验E中的金属呈_____ 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________________________ 。
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(4)要加快上述实验中气体产生的速率,还可采取的措施有
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次
2019-01-30更新
|
1574次组卷
|
13卷引用:2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)
2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题八 化学反应速率和化学平衡2010年高考化学试题分项专题九 电化学2010年高考化学试题分项专题十五 化学实验(已下线)2010年黑龙江省牡丹江一中高一下学期期末测试化学(已下线)2011届辽宁省锦州市高三检测二(理综)化学部分(已下线)2010—2011学年河南师大附中高一下期期末考试化学试卷(已下线)2011-2012学年浙江省嵊泗中学高二上学期第一次月考化学试试卷二2016-2017学年天津市静海一中高二上9月调研化学试卷四川省成都市七中实验学校2017-2018学年高二10月月考化学试题(已下线)第10练 用控制变量的思想突破影响化学反应速率的因素-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
真题
10 . 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的
_______ 0(填写“>”、“<”、“=”。
(2)前2s内的平均反应速率v(N2)=_____________ 。
(3)在该温度下,反应的平衡常数K=______________ 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是_____ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①请在上表格中填入剩余的实验条件数据________________ 。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________________ 。
2NO+2CO
 2CO2+N2
2CO2+N2为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 | 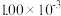 | 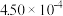 | 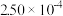 | 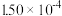 | 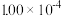 | 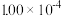 |
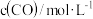 | 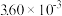 | 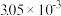 | 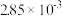 | 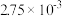 | 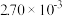 | 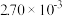 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的

(2)前2s内的平均反应速率v(N2)=
(3)在该温度下,反应的平衡常数K=
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/℃ | NO初始浓度 mol•L-1 | CO初始浓度 mol•L-1 | 催化剂的比表面积 ㎡  g-1 g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号

您最近一年使用:0次



