2024高三下·全国·专题练习
解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。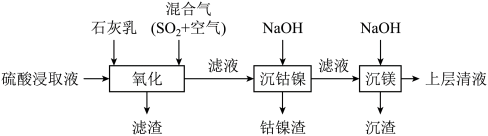
| 物质 |  |  |  |  |
 |  |  |  | 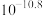 |
(1)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是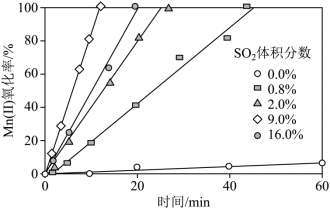
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 金属铼(Re)是重要的新兴金属,应用于国防、石油化工以及电子制造等领域,通过还原高铼酸铵(NH4ReO4)可制取金属铼。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流程如下图所示。回答下列问题:
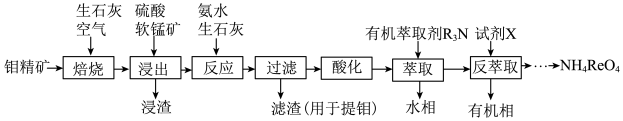
(1)“焙烧”过程加入生石灰的目的___________ 。
(2)“焙烧”常采用高压空气、逆流操作(空气从培烧炉下部通入,矿粉从中上部加入),这样操作的目的是___________ ,请再举出一项提高“焙烧”效率的合理措施:___________ 。
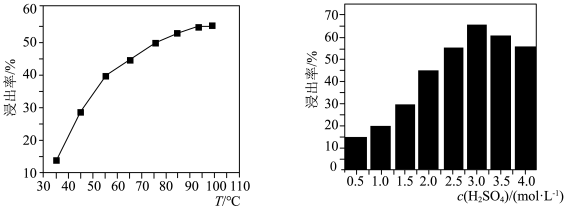
(3)“浸出”中,浸出率与温度的关系如下图所示,浸出率与硫酸浓度的关系如下图所示。工业生产应选择的适宜条件是___________ 。

(1)“焙烧”过程加入生石灰的目的
(2)“焙烧”常采用高压空气、逆流操作(空气从培烧炉下部通入,矿粉从中上部加入),这样操作的目的是
(3)“浸出”中,浸出率与温度的关系如下图所示,浸出率与硫酸浓度的关系如下图所示。工业生产应选择的适宜条件是

您最近一年使用:0次
2024高三下·全国·专题练习
3 . 用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ (答出一条即可)。
您最近一年使用:0次
名校
解题方法
4 . 某探究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法正确的是
溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法正确的是
 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法正确的是
溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法正确的是| 实验序号 | 试验温度/ |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间/s | ||
 | 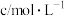 |  | 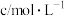 |  | |||
| 甲 | 25 | 2 | 0.02 | 3 | 0.1 | 5 | 8 |
| 乙 |  | 2 | 0.02 | 4 | 0.1 |  |  |
| 丙 | 30 | 2 | 0.02 |  | 0.1 | 4 |  |
A.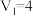 , ,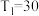 , ,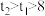 |
B.甲组用 的浓度变化表示的平均反应速率为 的浓度变化表示的平均反应速率为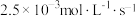 |
| C.通过实验乙、丙探究温度对化学反应速率的影响 |
D.反应的离子方程式为 |
您最近一年使用:0次
2024-02-02更新
|
308次组卷
|
3卷引用:通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河北省2023-2024学年高三上学期质量监测期末联考化学试题河北省石家庄市河北师范大学附属中学2023-2024高三上学期12月月考化学试题
5 . 通过电化学、热化学等方法,将 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:
(1)某研究小组采用电化学方法将 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是_______ 。
 :
: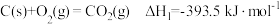
Ⅱ:
Ⅲ: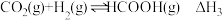
①
_______  。
。
②反应Ⅲ在恒温、恒容的密闭容器中进行, 和
和 的投料浓度均为
的投料浓度均为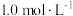 ,平衡常数
,平衡常数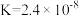 ,则
,则 的平衡转化率为
的平衡转化率为_______ 。
③用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
_______ 。[已知: 时,电离常数
时,电离常数 、
、 ]
]
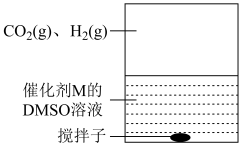
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应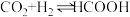 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能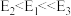 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。
Ⅳ:

V: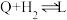

VI: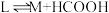

_______ 。
A.v与 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关
C.温度升高,v不一定增大 D.在溶液中加入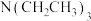 ,可提高
,可提高 转化率
转化率
②实验测得: ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。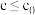 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因_______ 。
 转化为
转化为 等化学品,是实现“双碳”目标的途径之一。请回答:
等化学品,是实现“双碳”目标的途径之一。请回答:(1)某研究小组采用电化学方法将
 转化为
转化为 ,装置如图。电极B上的电极反应式是
,装置如图。电极B上的电极反应式是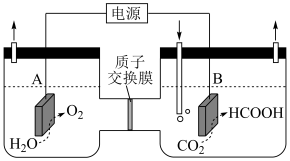
 :
: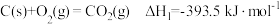
Ⅱ:

Ⅲ:
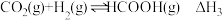
①

 。
。②反应Ⅲ在恒温、恒容的密闭容器中进行,
 和
和 的投料浓度均为
的投料浓度均为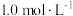 ,平衡常数
,平衡常数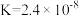 ,则
,则 的平衡转化率为
的平衡转化率为③用氨水吸收
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数 、
、 ]
](3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的
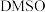 (有机溶剂)溶液,
(有机溶剂)溶液, 和
和 在溶液中反应制备
在溶液中反应制备 ,反应过程中保持
,反应过程中保持 和
和 的压强不变,总反应
的压强不变,总反应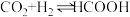 的反应速率为v,反应机理如下列三个基元反应,各反应的活化能
的反应速率为v,反应机理如下列三个基元反应,各反应的活化能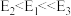 (不考虑催化剂活性降低或丧失)。
(不考虑催化剂活性降低或丧失)。Ⅳ:


V:
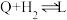

VI:
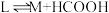

A.v与
 的压强无关 B.v与溶液中溶解
的压强无关 B.v与溶液中溶解 的浓度无关
的浓度无关C.温度升高,v不一定增大 D.在溶液中加入
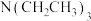 ,可提高
,可提高 转化率
转化率②实验测得:
 ,
, 下,v随催化剂M浓度c变化如图。
下,v随催化剂M浓度c变化如图。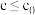 时,v随c增大而增大:
时,v随c增大而增大: 时,v不再显著增大。请解释原因
时,v不再显著增大。请解释原因
您最近一年使用:0次
2024-02-02更新
|
2180次组卷
|
3卷引用:T19-原理综合题
2024高三·全国·专题练习
解题方法
6 . 某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
(1)设计实验1和2的目的是___________ 。
(2)实验5中的a___________ 0.935(填“大于”、“小于”或“等于”)。
(3)根据实验3-5,可得出的结论是___________ 。
(4)下列物质中最适宜做为NaClO溶液稳定剂的是___________。
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH值 | 12h后COAC | 12h后COAC/初始COAC |
| 1 | 0 | 0 | 1794 | 8.53 | 1218 | 0.679 |
| 2 | 0 | 0 | 1794 | 8.63 | 1288 | 0.718 |
| 3 | 0.9% | 0.6% | 1794 | 13.44 | 1676 | 0.935 |
| 4 | 1.5% | 0 | 1834 | 13.76 | 1597 | 0.871 |
| 5 | 0 | 1.5% | 1834 | 13.66 | - | a |
(2)实验5中的a
(3)根据实验3-5,可得出的结论是
(4)下列物质中最适宜做为NaClO溶液稳定剂的是___________。
A. | B.NaCl | C. | D. |
您最近一年使用:0次
名校
解题方法
7 . 为达到相应实验目的,下列实验设计可行的是
| 编号 | 实验目的 | 实验过程 |
| A | 分离 、 、 | 将混合物置于足量NaOH溶液中,然后依次进行过滤、洗涤、蒸发、灼烧四项操作 |
| B | 判断反应后 是否沉淀完全 是否沉淀完全 | 将 溶液与 溶液与 溶液混合,反应后静置,向上层清液中再加1滴 溶液混合,反应后静置,向上层清液中再加1滴 溶液 溶液 |
| C | 观察 颜色 颜色 | 向盛有 溶液的试管中滴入氨水,立即振荡 溶液的试管中滴入氨水,立即振荡 |
| D | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液的试管中同时加入2mL5% 溶液,观察实验现象 溶液,观察实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-31更新
|
803次组卷
|
4卷引用:热点08 表格型实验方案的设计与评价
(已下线)热点08 表格型实验方案的设计与评价四川省绵阳市2024届高三上学期一诊模拟考试理科综合化学试题河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
2023高三·全国·专题练习
解题方法
8 . 乙酸乙酯是重要的化工原料,沸点约77 ℃,其水解反应方程式为CH3COOC2H5+H2O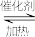 CH3COOH+C2H5OH ,酸和碱均可用作该反应的催化剂,某兴趣小组对 NaOH 溶液催化乙酸乙酯水解进行了探究。
CH3COOH+C2H5OH ,酸和碱均可用作该反应的催化剂,某兴趣小组对 NaOH 溶液催化乙酸乙酯水解进行了探究。
实验步骤:向试管中加入8 mL NaOH 溶液,再加入 2 mL 乙酸乙酯,用直尺量出乙酸乙酯的高度,再把试管放入70 ℃的水浴中,每隔1 min 将其取出,振荡、静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行,改变NaOH溶液的浓度,重复实验。
数据记录:乙酸乙酯水解后剩余酯层的高度
回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有___________ 、___________ 、___________ 。
(2)分析上述数据,得到乙酸乙酯水解速率的结论是①___________ ;②乙酸乙酯水解速率先快后慢,一段时间后达到平衡状态。
(3)结论②的理论解释是___________ 。
(4)欲使乙酸乙酯完全水解,可采取的措施是___________ 。
(5)有同学认为有必要用蒸馏水代替 NaOH溶液重复实验,对数据进行修正,主要原因是___________ 。
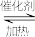 CH3COOH+C2H5OH ,酸和碱均可用作该反应的催化剂,某兴趣小组对 NaOH 溶液催化乙酸乙酯水解进行了探究。
CH3COOH+C2H5OH ,酸和碱均可用作该反应的催化剂,某兴趣小组对 NaOH 溶液催化乙酸乙酯水解进行了探究。实验步骤:向试管中加入8 mL NaOH 溶液,再加入 2 mL 乙酸乙酯,用直尺量出乙酸乙酯的高度,再把试管放入70 ℃的水浴中,每隔1 min 将其取出,振荡、静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行,改变NaOH溶液的浓度,重复实验。
数据记录:乙酸乙酯水解后剩余酯层的高度
| 组别 | 1 | 2 | 3 | |
| c(NaOH)/ (mol·L-1) | 0.5 | 1.0 | 2.0 | |
| 时间/ min | 0 | 10.0 | 10.0 | 10.0 |
| 1 | 9.0 | 8.5 | 8.0 | |
| 2 | 8.0 | 7.0 | 6.0 | |
| 3 | 7.5 | 6.0 | 4.5 | |
| 4 | 7.0 | 5.0 | 3.0 | |
| 5 | 6.5 | 4.5 | 2.0 | |
| 6 | 6.5 | 4.5 | 1.5 | |
| 7 | 6.5 | 4.5 | 1.5 | |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是①
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替 NaOH溶液重复实验,对数据进行修正,主要原因是
您最近一年使用:0次
9 . 某研究性学习小组探究影响反应速率的因素及反应速率的大小,测得的实验数据如表所示(忽略溶液体积变化),下列说法错误的是
| 组号 | 反应温度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 10 | 2 | 0.1 | 1 | 0.4 | 3 |
| ② | 30 | 2 | 0.1 | 2 | 0.2 | 2 |
| ③ | 30 | 1 | 0.2 | 2 | 0.1 | 3 |
| ④ | 30 | 1 | 0.1 | 2 | 0.1 | 3 |
| A.实验①②探究温度对反应速率的影响 |
| B.实验②④探究Na2S2O3浓度对反应速率的影响 |
| C.四组实验中实验②的反应速率最大 |
D.实验③完全反应需要tmin,平均反应速率v(Na2S2O3)= mol/(L•min) mol/(L•min) |
您最近一年使用:0次
2023-11-03更新
|
509次组卷
|
5卷引用:题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省普高联考2023-2024学年高三上学期测评(三)化学试题【精品卷】2.1.2 影响化学反应速率的因素课堂例题-人教版2023-2024学年选择性必修1【定心卷】2.1.2 影响化学反应速率的因素随堂练习-人教版2023-2024学年选择性必修1
2023高三·全国·专题练习
解题方法
10 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
(1)请完成此实验设计,其中:V1=________ ,V2=________ 。
(2)实验①、②探究的是_______ 对化学反应速率的影响,根据表中的实验数据,可以得到的结论是_______ 。
(3)探究温度对化学反应速率的影响,应选择实验_______ (填实验编号)。
(4)利用实验①中的数据,计算用KMnO4表示的化学反应速率为________ 。
[实验原理]2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀H2SO4溶液 | 0.05mol/LKMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(2)实验①、②探究的是
(3)探究温度对化学反应速率的影响,应选择实验
(4)利用实验①中的数据,计算用KMnO4表示的化学反应速率为
您最近一年使用:0次



