名校
解题方法
1 . 对于反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列措施能加快反应速率的是
①恒容条件下,再通入一定量的NH3②增大体系容积③恒容条件下,再通入一定量的N2④适当升高温度
①恒容条件下,再通入一定量的NH3②增大体系容积③恒容条件下,再通入一定量的N2④适当升高温度
| A.①②④ | B.①③④ | C.①④ | D.②④ |
您最近一年使用:0次
名校
解题方法
2 . 某小组拟用含稀硫酸的KMnO4溶液与H2C2O4(弱酸)溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,设计了如表的实验方案并记录了实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol/L H2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)表格中“乙”需要测的物理量为________ 。
(2)实验①②探究的是________ 对化学反应速率的影响,反应速率更快的是________ (填序号)。
(3)若②③探究浓度对反应速率的影响,表格中a=________ ,③中加入amL蒸馏水的目的是________ 。
(4)实验中发现酸性高锰酸钾溶液和草酸反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快,某同学认为是放热导致溶液温度升高所致,重做②号实验,测定过程中溶液不同时间的温度,结果如表:
①温度________ (填“是”、“不是”“不确定”)导致反应速率明显加快的原因。
②从影响化学反应速率的因素看,你猜想:________ (填“温度”、“浓度”、“压强”和“催化剂”)对反应速率的影响,若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是________ (填字母)。
A.硫酸钾固体 B.蒸馏水 C.二氧化锰固体 D.硫酸锰固体
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 物理量 编号 | V(0.20mol/LH2C2O4溶液)/mL | V(蒸馏水)\mL | V(0.010mol/LKMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(2)实验①②探究的是
(3)若②③探究浓度对反应速率的影响,表格中a=
(4)实验中发现酸性高锰酸钾溶液和草酸反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快,某同学认为是放热导致溶液温度升高所致,重做②号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
②从影响化学反应速率的因素看,你猜想:
A.硫酸钾固体 B.蒸馏水 C.二氧化锰固体 D.硫酸锰固体
您最近一年使用:0次
名校
解题方法
3 . 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生氢气体积(V)的数据,根据数据绘制如图所示曲线,则曲线a、b、c、d所对应的实验组别分别是
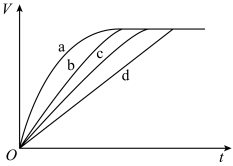
组别 |
| 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 30 | 粉末状 |
4 | 2.5 | 50 | 粉末状 |

| A.4、3、2、1 | B.1、2、3、4 | C.3、4、2、1 | D.1、2、4、3 |
您最近一年使用:0次
2023-10-26更新
|
123次组卷
|
2卷引用:重庆市长寿区八校联考2023-2024学年高二上学期1月期末化学试题
名校
4 . 某同学设计Fe与1mol/L的 溶液反应的下列实验,探究反应速率的影响因素。
溶液反应的下列实验,探究反应速率的影响因素。
下列说法正确的是
 溶液反应的下列实验,探究反应速率的影响因素。
溶液反应的下列实验,探究反应速率的影响因素。| 序号 | 铁的质量/g | 铁的形状 | 温度/℃ | 铁完全溶解于酸的时间/s |
| Ⅰ | 2 | 粉末 | 20 | 108 |
| Ⅱ | 2 | 薄片 | 20 |  |
| Ⅲ | 2 | 薄片 | 15 |  |
A.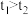 | B. |
| C.单位时间内消耗的铁的质量:Ⅱ<Ⅲ | D.初始反应速率:Ⅰ>Ⅱ>Ⅲ |
您最近一年使用:0次
2023-01-15更新
|
135次组卷
|
3卷引用:重庆市名校联盟联合考试2023-2024学年高二上学期10月期中考试化学试题
名校
解题方法
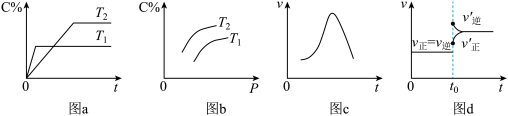
5 . 某研究小组探究外界条件对化学反应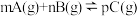 的速率和平衡的影响,如下图所示。下列判断正确的是
的速率和平衡的影响,如下图所示。下列判断正确的是
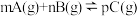 的速率和平衡的影响,如下图所示。下列判断正确的是
的速率和平衡的影响,如下图所示。下列判断正确的是
A.由图a可知, ,该反应的正反应为吸热反应 ,该反应的正反应为吸热反应 |
B.由图b可知,该反应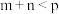 |
| C.若图c是绝热条件下速率和时间的图像,则该反应是放热反应 |
D.由图d可知,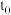 时刻充入了一定量的C 时刻充入了一定量的C |
您最近一年使用:0次
2022-12-23更新
|
375次组卷
|
2卷引用:重庆市巴蜀中学2022-2023学年高二上学期期中考试化学试题
解题方法
6 . 在恒容密闭容器中充入一定量的 以及加入足量的
以及加入足量的 。发生反应
。发生反应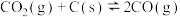
 ,气体混合物中
,气体混合物中 和
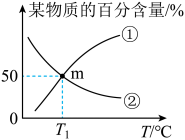
和 的百分含量与温度的变化关系如图所示,下列说法正确的是
的百分含量与温度的变化关系如图所示,下列说法正确的是
 以及加入足量的
以及加入足量的 。发生反应
。发生反应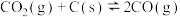
 ,气体混合物中
,气体混合物中 和
和 的百分含量与温度的变化关系如图所示,下列说法正确的是
的百分含量与温度的变化关系如图所示,下列说法正确的是
A.曲线②表示 的百分含量 的百分含量 |
B. 的键能总和大于 的键能总和大于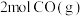 的键能总和 的键能总和 |
C.若m点为反应平衡点,则此时平衡常数 |
| D.反应达到平衡后,保持其他条件不变,往该容器中充入少量稀有气体,反应速率不改变 |
您最近一年使用:0次
名校
7 . 设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:
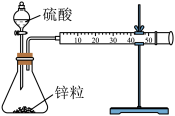
①按图示安装置,加入锌粒,然后快速加入40mL1mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、 注射器、铁架台、
注射器、铁架台、_______ 。
(2)观察到的现象是_______ ;收集10mL气体②所用时间比①所用时间_______ 。
(3)所能得出的实验结论是_______ 。
(4)利用硫代硫酸钠或重铬酸钾与上述稀硫酸反应也可判断反应速率的快慢,请书写这两个反应的离子方程式_______ 。
(5)某温度下按如图装置进行实验,锥形瓶内盛有6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5mol∙L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为 (若折合成
(若折合成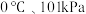 条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
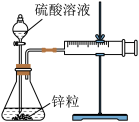

①按图示安装置,加入锌粒,然后快速加入40mL1mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、
 注射器、铁架台、
注射器、铁架台、(2)观察到的现象是
(3)所能得出的实验结论是
(4)利用硫代硫酸钠或重铬酸钾与上述稀硫酸反应也可判断反应速率的快慢,请书写这两个反应的离子方程式
(5)某温度下按如图装置进行实验,锥形瓶内盛有6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5mol∙L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为
 (若折合成
(若折合成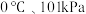 条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
A.用锌粒表示的10s内该反应的速率为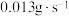 |
B.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
C.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
D.用 表示的 表示的 内该反应的速率为 内该反应的速率为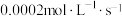 |
您最近一年使用:0次
2022-10-07更新
|
158次组卷
|
2卷引用:重庆市九龙坡区2022-2023学年高二上学期第一次月考化学试题
名校
8 . 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体;② ;③
;③ 固体;④NaNO3固体;⑤KCl溶液;⑥
固体;④NaNO3固体;⑤KCl溶液;⑥ 溶液
溶液
①NaOH固体;②
 ;③
;③ 固体;④NaNO3固体;⑤KCl溶液;⑥
固体;④NaNO3固体;⑤KCl溶液;⑥ 溶液
溶液| A.①②⑥ | B.②③⑤ | C.②④⑥ | D.②③④ |
您最近一年使用:0次
2022-09-21更新
|
1328次组卷
|
8卷引用:重庆市璧山来凤中学校2022-2023学年高二上学期9月月考化学试题
名校
9 . 回答下列问题:
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应,探究浓度和温度对化学反应速率的影响,进行了如下实验:
①写出该反应的离子方程式:_______ 。
②实验A、B可探究_____ 对反应速率的影响,因此V1=_____ ,T1=_____ ,V2=_____ 。
(2)取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中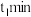 前,B试管中产生气体的速率较慢且量少的原因可能为
前,B试管中产生气体的速率较慢且量少的原因可能为_______ ,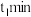 后,B试管中产生气体的速率较快且量多的原因可能为
后,B试管中产生气体的速率较快且量多的原因可能为_______ 。

(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应,探究浓度和温度对化学反应速率的影响,进行了如下实验:
| 实验序号 | 反应温度/K | 稀H2SO4 | Na2S2O3溶液 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| A | 298 | 5 | 0.10 | 10 | 0.10 | 0 |
| B | T1 | 5 | 0.10 | 4 | 0.10 | V1 |
| C | 313 | 5 | 0.10 | V2 | 0.10 | 6 |
②实验A、B可探究
(2)取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中
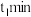 前,B试管中产生气体的速率较慢且量少的原因可能为
前,B试管中产生气体的速率较慢且量少的原因可能为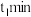 后,B试管中产生气体的速率较快且量多的原因可能为
后,B试管中产生气体的速率较快且量多的原因可能为
您最近一年使用:0次
2022-08-18更新
|
244次组卷
|
2卷引用:重庆市石柱中学校2021-2022学年高二上学期第一次月考化学试题
名校
10 . 利用如图装置进行实验,下列描述不能达到实验目的的是
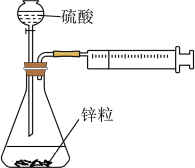

| A.针筒活塞向右移动,可证明锌粒与硫酸反应是放热反应 |
| B.以改变硫酸浓度来测定浓度对反应速率的影响 |
| C.相同条件下,可以改变锌粒大小来测定接触面积对反应速率的影响 |
| D.在不同条件下,收集相同体积的氢气,所用时间越短,反应速率越快 |
您最近一年使用:0次
2022-04-12更新
|
149次组卷
|
2卷引用:重庆市南开中学校2021-2022学年高一下学期5月月考化学试题