名校
解题方法
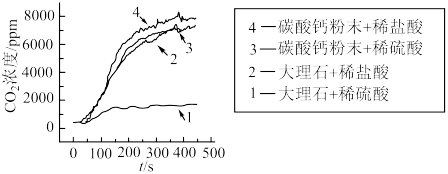
1 . 某小组采用等质量的大理石和碳酸钻粉末、足量的 稀盐酸和
稀盐酸和 稀硫酸研究实验室制备
稀硫酸研究实验室制备 的化学反应速率。实验中
的化学反应速率。实验中 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
已知:碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙会包裹在碳酸钙表面。
下列说法正确的是
 稀盐酸和
稀盐酸和 稀硫酸研究实验室制备
稀硫酸研究实验室制备 的化学反应速率。实验中
的化学反应速率。实验中 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。已知:碳酸钙和稀硫酸反应生成微溶的硫酸钙,硫酸钙会包裹在碳酸钙表面。

下列说法正确的是
A.比较实验1和实验2,可以说明酸的 对生成 对生成 的速率有影响 的速率有影响 |
B.比较实验1和实验4,可以说明生成 的速率和酸中阴离子的种类有关 的速率和酸中阴离子的种类有关 |
C.实验结论:生成的 对碳酸钙粉末比对大理石的包裹作用更强 对碳酸钙粉末比对大理石的包裹作用更强 |
D.综合以上四个实验推断大理石粉末和稀硫酸反应能用于制备 |
您最近一年使用:0次
名校
解题方法
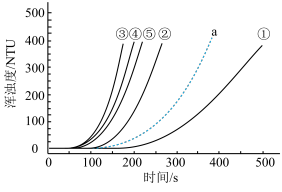
2 . 室温下,用0.1 mol·L-1Na2S2O3溶液、0.1 mol·L-1H2SO4溶液和蒸馏水进行如下表所示的5个实验,分别测量浑浊度随时间的变化。
下列说法不正确 的是
| 编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 浑浊度随时间变化的曲线 |
| V/mL | V/mL | V/mL | ||
| ① | 1.5 | 3.5 | 10 |
|
| ② | 2.5 | 3.5 | 9 | |
| ③ | 3.5 | 3.5 | x | |
| ④ | 3.5 | 2.5 | 9 | |
| ⑤ | 3.5 | 1.5 | 10 |
| A.实验③中x=8 |
| B.实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率 |
| C.将装有实验②的试剂的试管浸泡在热水中一段时间后再混合,其浑浊度曲线应为a |
| D.降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大 |
您最近一年使用:0次
2024-01-23更新
|
144次组卷
|
15卷引用:北京市朝阳区2022-2023学年高二上学期期末考试化学试题
北京市朝阳区2022-2023学年高二上学期期末考试化学试题北京市第二中学2022-2023学年高一下学期期末考试化学试题 北京市第一七一中学2023-2024学年高二上学期10月月考化学试题北京市丰台区2023-2024学年高二上学期期中联考(B卷)化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题北京市第二中学2023-2024学年高二上学期第二学段 段考化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题北京市第三十五中学2023-2024学年高一下学期(选考)期中测试化学试题河南省实验中学2023-2024学年高二上学期期中考试化学试题湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题云南省曲靖市2023-2024学年高二上学期1月期末化学试题四川省成都市教育科学研究院附属中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
3 . 某化学小组利用手持技术探究铁钉在4种溶液中的吸氧腐蚀,下表为得到的相关实验数据。
下列说法不正确 的是
| 实验装置 | 编号 | 浸泡液 |  | 氧气体积分数随时间的变化 |
 | ① |  | 5 |  |
| ② |  | 5 | ||
| ③ |  | 7 | ||
| ④ |  | 7 |
A.铁钉吸氧腐蚀的负极反应为 |
B.由实验可知, 、 、 能加快铁的吸氧腐蚀速率 能加快铁的吸氧腐蚀速率 |
| C.曲线先陡后平可能是由于生成的氢氧化物增加,阻碍了反应继续进行 |
D.由实验可知, 水解产生的 水解产生的 能减少难溶氢氧化物的生成,酸性越强吸氧腐蚀的速率越大 能减少难溶氢氧化物的生成,酸性越强吸氧腐蚀的速率越大 |
您最近一年使用:0次
2024-01-22更新
|
142次组卷
|
2卷引用:北京房山区2023-2024学年高三上学期期末化学试题
名校
解题方法
4 . 对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是_______ 。
(2)尿素溶液吸收烟气中的 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是_______ 。
(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是_______ 。
Ⅱ. 气相脱硫脱硝
气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO和 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。

已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:
基元反应1:

基元反应2:
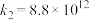
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:
基元反应3:
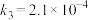
基元反应4:
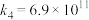
(4) 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是_______ 。
(5)将 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是_______ 。
(6)当体系中有水蒸气时, 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是_______ 。
Ⅰ.尿素液相脱硫脱硝
(1)尿素
 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是(2)尿素溶液吸收烟气中的
 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若
 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是Ⅱ.
 气相脱硫脱硝
气相脱硫脱硝一定温度下,将模拟烟气通入气相氧化反应器中。NO和
 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。
已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:基元反应1:


基元反应2:

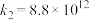
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:基元反应3:

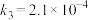
基元反应4:

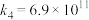
(4)
 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是(5)将
 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是(6)当体系中有水蒸气时,
 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
您最近一年使用:0次
2024-01-20更新
|
158次组卷
|
2卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
名校
解题方法
5 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气器材的消毒,可由乙酸与 在硫酸催化下反应制得,热化学方程式为:
在硫酸催化下反应制得,热化学方程式为: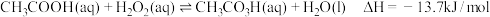
(1)市售过氧乙酸的浓度一般不超过21%,原因是___________ 。
(2)以下措施中能提高乙酸平衡转化率的措施有___________。
(3)取质量相等的冰醋酸和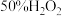 溶液混合均匀,在一定量硫酸催化下进行如下实验。
溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在 下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
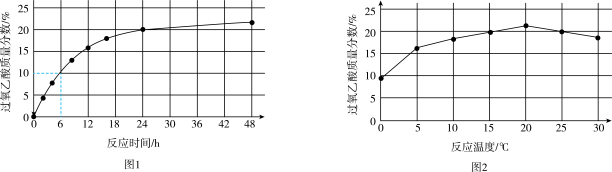
①实验1中,若反应混合液的总质量为 ,依据图1数据计算,在
,依据图1数据计算,在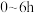 间,
间,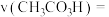
___________ 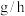 。(用含m的代数式表示)
。(用含m的代数式表示)
②综合图1、图2分析,与 相比,
相比, 时过氧乙酸产率降低的可能原因是
时过氧乙酸产率降低的可能原因是___________ (写出2条)。
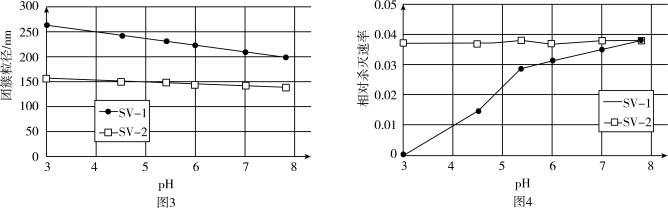
(4)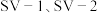 是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同
是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同 下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
依据图3、图4分析,过氧乙酸对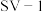 的杀灭速率随
的杀灭速率随 增大而增大的原因可能是
增大而增大的原因可能是___________ 。
 在硫酸催化下反应制得,热化学方程式为:
在硫酸催化下反应制得,热化学方程式为: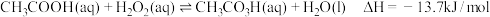
(1)市售过氧乙酸的浓度一般不超过21%,原因是
(2)以下措施中能提高乙酸平衡转化率的措施有___________。
| A.降低温度 | B.增加 用量(溶液体积不变) 用量(溶液体积不变) |
| C.加水稀释溶液 | D.增加乙酸的用量(溶液体积不变) |
(3)取质量相等的冰醋酸和
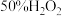 溶液混合均匀,在一定量硫酸催化下进行如下实验。
溶液混合均匀,在一定量硫酸催化下进行如下实验。实验1:在
 下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。

①实验1中,若反应混合液的总质量为
 ,依据图1数据计算,在
,依据图1数据计算,在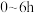 间,
间,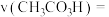
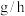 。(用含m的代数式表示)
。(用含m的代数式表示)②综合图1、图2分析,与
 相比,
相比, 时过氧乙酸产率降低的可能原因是
时过氧乙酸产率降低的可能原因是(4)
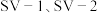 是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同
是两种常用于实验研究的病毒,病毒在水中可能会聚集成团簇。不同 下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
依据图3、图4分析,过氧乙酸对
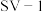 的杀灭速率随
的杀灭速率随 增大而增大的原因可能是
增大而增大的原因可能是
您最近一年使用:0次
名校
解题方法
6 . 100mL 2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是
| A.加入数滴CuCl2溶液 | B.加入适量的6mol·L-1的盐酸 |
| C.加入适量蒸馏水 | D.加入适量的NaCl溶液 |
您最近一年使用:0次
2024-01-03更新
|
194次组卷
|
2卷引用:北京市八一学校2023-2024学年高二上学期期中测试化学试题
名校
解题方法
7 .  新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
(1) 的制备。
的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是___________ 。
Ⅱ.上述反应适宜的温度范围是___________ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 、
、___________ 和 。
。
③碳热还原法。
以 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。
已知:ⅰ.
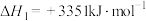
ⅱ.1g石墨与氧气生成一氧化碳,放出9.2 热量
热量
ⅲ.
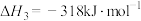
写出反应ⅱ的热化学方程式___________ 。运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:___________ 。
(2) 的性质。
的性质。
 粉末可发生水解。相同条件下,不同粒径的
粉末可发生水解。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。

① 粉末水解的化学方程式是
粉末水解的化学方程式是___________ 。
②解释 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:___________ 。
(3) 含量检测。
含量检测。
向a g 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的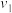



 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用



 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是___________ 。
 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
 | 660 | 2467 | 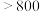 |  : : ( (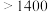 升华) 升华) :( :(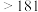 升华) 升华) |
 | 649 | 1090 |  |  : :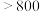 |
 的制备。
的制备。①化学气相沉积法。
Ⅰ.一定温度下,以
 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 、
、 。
。③碳热还原法。
以
 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。已知:ⅰ.

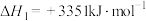
ⅱ.1g石墨与氧气生成一氧化碳,放出9.2
 热量
热量ⅲ.

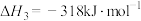
写出反应ⅱ的热化学方程式
(2)
 的性质。
的性质。 粉末可发生水解。相同条件下,不同粒径的
粉末可发生水解。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
①
 粉末水解的化学方程式是
粉末水解的化学方程式是②解释
 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:(3)
 含量检测。
含量检测。向a g
 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的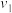



 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用



 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是
您最近一年使用:0次
名校
8 . 不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示,
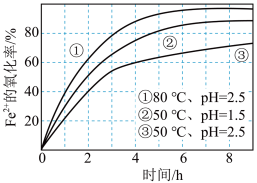
| A.Fe2+的氧化率随时间延长而逐渐增大 |
| B.由②和③可知,pH越大,Fe2+氧化速率不一定越快 |
| C.由①和③可知,温度越高,Fe2+氧化速率越快 |
| D.氧化过程的离子方程式为:4Fe2++O2+2H2O=4Fe3++4OH- |
您最近一年使用:0次
名校
解题方法
9 . 在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与2mL 的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法
的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法不正确 的是
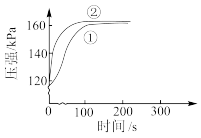
 的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法
的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法
| A.曲线②代表盐酸与镁条反应 |
| B.反应开始时,盐酸与Mg反应的更快 |
| C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等 |
D.用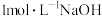 溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更大 溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更大 |
您最近一年使用:0次
名校
10 . 乙二酸( )俗称草酸,在实验研究和化学工业中应用广泛。
)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol⋅L
 溶液的
溶液的 ,写出草酸的电离方程式:
,写出草酸的电离方程式:_______ 。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
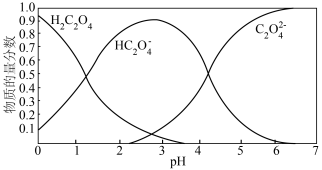
向草酸溶液中滴加KOH溶液至 时发生的主要反应的离子方程式是
时发生的主要反应的离子方程式是_______ 。
(3)某探究小组通过 溶液与酸性
溶液与酸性 溶液反应,观察溶液紫色消失快慢,研究影响反应速率的因素。
溶液反应,观察溶液紫色消失快慢,研究影响反应速率的因素。
实验条件作如下限定:所用酸性 溶液的浓度可选择0.010 mol⋅L
溶液的浓度可选择0.010 mol⋅L 、0.0010 mol⋅L
、0.0010 mol⋅L ,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验酸性
,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验酸性 溶液的用量均为4 mL、
溶液的用量均为4 mL、 溶液(0.10 mol⋅L
溶液(0.10 mol⋅L )的用量均为4 mL。
)的用量均为4 mL。
①写出反应的离子方程式:_______ ;
②请完成以下实验设计表:完成Ⅳ的实验条件,并将实验目的补充完整。
③该反应的催化剂选择_______ (填字母代号)
A. B.
B.
④小组同学对实验Ⅰ和Ⅱ分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
某同学分析上述数据后得出“当其他条件相同时,酸性 溶液浓度越小,所需时间越短,即其反应速率越快”的结论,你认为是否正确
溶液浓度越小,所需时间越短,即其反应速率越快”的结论,你认为是否正确_______ (填“是”或“否”)。小组同学经过讨论分析,某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验_______ 。
(4)工业上利用草酸与硫酸亚铁反应制备草酸亚铁晶体,其离子方程式为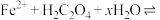
 。测定草酸亚铁晶体(
。测定草酸亚铁晶体(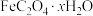 )的x值,步骤如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性
)的x值,步骤如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性 溶液滴定,达到滴定终点时,消耗0.1000 mol⋅L
溶液滴定,达到滴定终点时,消耗0.1000 mol⋅L 的酸性
的酸性 溶液18.00 mL。已知:滴定过程中铁、碳元素分别被氧化为
溶液18.00 mL。已知:滴定过程中铁、碳元素分别被氧化为 、
、 ,锰元素被还原为
,锰元素被还原为 ,则
,则
_______ ( 的摩尔质量是144 g⋅mol
的摩尔质量是144 g⋅mol )。
)。
 )俗称草酸,在实验研究和化学工业中应用广泛。
)俗称草酸,在实验研究和化学工业中应用广泛。(1)室温下,测得0.1 mol⋅L

 溶液的
溶液的 ,写出草酸的电离方程式:
,写出草酸的电离方程式:(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:

向草酸溶液中滴加KOH溶液至
 时发生的主要反应的离子方程式是
时发生的主要反应的离子方程式是(3)某探究小组通过
 溶液与酸性
溶液与酸性 溶液反应,观察溶液紫色消失快慢,研究影响反应速率的因素。
溶液反应,观察溶液紫色消失快慢,研究影响反应速率的因素。实验条件作如下限定:所用酸性
 溶液的浓度可选择0.010 mol⋅L
溶液的浓度可选择0.010 mol⋅L 、0.0010 mol⋅L
、0.0010 mol⋅L ,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验酸性
,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验酸性 溶液的用量均为4 mL、
溶液的用量均为4 mL、 溶液(0.10 mol⋅L
溶液(0.10 mol⋅L )的用量均为4 mL。
)的用量均为4 mL。①写出反应的离子方程式:
②请完成以下实验设计表:完成Ⅳ的实验条件,并将实验目的补充完整。
| 实验编号 | T/K | 催化剂的用量/g | 酸性 溶液的浓度/(mol·L 溶液的浓度/(mol·L ) ) | 实验目的 |
| Ⅰ | 298 | 0.5 | 0.010 | a.实验Ⅰ和Ⅱ探究酸性 溶液的浓度对该反应速率的影响; 溶液的浓度对该反应速率的影响;b. c.实验Ⅰ和Ⅳ探究催化剂对反应速率的影响。 |
| Ⅱ | 298 | 0.5 | 0.001 | |
| Ⅲ | 323 | 0.5 | 0.010 | |
| Ⅳ |
A.
 B.
B.
④小组同学对实验Ⅰ和Ⅱ分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 次 | |
| Ⅰ | 12.8 | 13.0 | 11.0 |
| Ⅱ | 4.9 | 5.1 | 5.0 |
 溶液浓度越小,所需时间越短,即其反应速率越快”的结论,你认为是否正确
溶液浓度越小,所需时间越短,即其反应速率越快”的结论,你认为是否正确(4)工业上利用草酸与硫酸亚铁反应制备草酸亚铁晶体,其离子方程式为
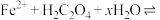
 。测定草酸亚铁晶体(
。测定草酸亚铁晶体(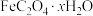 )的x值,步骤如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性
)的x值,步骤如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性 溶液滴定,达到滴定终点时,消耗0.1000 mol⋅L
溶液滴定,达到滴定终点时,消耗0.1000 mol⋅L 的酸性
的酸性 溶液18.00 mL。已知:滴定过程中铁、碳元素分别被氧化为
溶液18.00 mL。已知:滴定过程中铁、碳元素分别被氧化为 、
、 ,锰元素被还原为
,锰元素被还原为 ,则
,则
 的摩尔质量是144 g⋅mol
的摩尔质量是144 g⋅mol )。
)。
您最近一年使用:0次