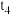真题
解题方法
1 . 室温下,为探究纳米铁去除水样中 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。
下列说法正确的是
 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。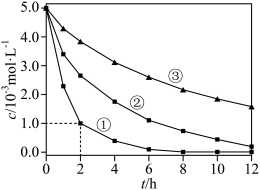
| 实验序号 | 水样体积/ | 纳米铁质量/ | 水样初始 |
| ① | 50 | 8 | 6 |
| ② | 50 | 2 | 6 |
| ③ | 50 | 2 | 8 |
A.实验①中,0~2小时内平均反应速率 |
B.实验③中,反应的离子方程式为: |
| C.其他条件相同时,适当增加纳米铁质量可加快反应速率 |
D.其他条件相同时,水样初始 越小, 越小, 的去除效果越好 的去除效果越好 |
您最近一年使用:0次
名校
2 . 回答下列问题
(1) 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 随时间的变化如下表:
随时间的变化如下表:
①如图中 点处,
点处, (正)
(正)________  (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。
②图中表示 的变化的曲线是
的变化的曲线是________ 。
③下列不能使该反应的反应速率增大的是________ 。
A.及时分离出 气体 B.适当升高温度
气体 B.适当升高温度
C.增大 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
①通过实验 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验________ (实验序号)可探究出温度变化对化学反应速率的影响。
② 组实验中溶液褪色时间t
组实验中溶液褪色时间t________ (填“<”、“=”或“>”)8s,C组实验的反应速率
________ 。(用含有 的式子表示)
的式子表示)
③同学们在实验中发现反应速率总是如图所示,其中 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②________________ 。
(1)
 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 随时间的变化如下表:
随时间的变化如下表:时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 点处,
点处, (正)
(正) (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。②图中表示
 的变化的曲线是
的变化的曲线是③下列不能使该反应的反应速率增大的是
A.及时分离出
 气体 B.适当升高温度
气体 B.适当升高温度C.增大
 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂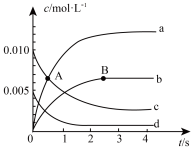
 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
|
|
|
|
| |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 |
| 8 |
C | 313 | 2 | 0.02 |
| 0.1 | 1 | t |
 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验②
 组实验中溶液褪色时间t
组实验中溶液褪色时间t
 的式子表示)
的式子表示)③同学们在实验中发现反应速率总是如图所示,其中
 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②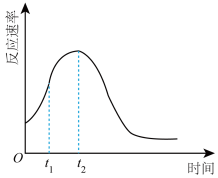
您最近一年使用:0次
3 . 为研究“影响金属与盐酸反应剧烈程度的因素”,某兴趣小组进行如下探究。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出假设】I、可能与金属本身的性质有关:
Ⅱ、可能与盐酸的浓度有关:
Ⅲ、___________ (请你填写一个合理的猜想)。
(2)【实验探究】实验所用金属均已用砂纸打磨。
实验①:为探究猜想I,小李同学分别在两支试管中放入相同质量的锌粒和铁片,然后分别加入同体积同浓度的稀盐酸,观察到放锌粒的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,由此得出结论,金属活动性:Zn>Fe.你认为上述方案是否合理___________ (填“合理”或“不合理”),理由是___________ 。

实验②:为探究猜想Ⅱ,小刘同学利用上列图甲装置进行对照实验,将等质量且过量的锌粒分别与等体积、浓度分别为5%、15%的稀盐酸反应。其中注射器的作用是___________ ,该装置气密性的检查方法是___________ 。(填A或B)
A.打开分液漏斗活塞,拉动注射器活塞一段距离,锥形瓶的水中有气泡产生,说明气密性完好。
B.关闭分液漏斗活塞,推动(或拉动)注射器活塞一段距离,松手后又回到原来位置,说明气密性完好。
实验③:小刘同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的变化关系曲线如图乙所示。请你根据该图中信息写出1条合理结论:___________ 。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出假设】I、可能与金属本身的性质有关:
Ⅱ、可能与盐酸的浓度有关:
Ⅲ、
(2)【实验探究】实验所用金属均已用砂纸打磨。
实验①:为探究猜想I,小李同学分别在两支试管中放入相同质量的锌粒和铁片,然后分别加入同体积同浓度的稀盐酸,观察到放锌粒的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,由此得出结论,金属活动性:Zn>Fe.你认为上述方案是否合理

实验②:为探究猜想Ⅱ,小刘同学利用上列图甲装置进行对照实验,将等质量且过量的锌粒分别与等体积、浓度分别为5%、15%的稀盐酸反应。其中注射器的作用是
A.打开分液漏斗活塞,拉动注射器活塞一段距离,锥形瓶的水中有气泡产生,说明气密性完好。
B.关闭分液漏斗活塞,推动(或拉动)注射器活塞一段距离,松手后又回到原来位置,说明气密性完好。
实验③:小刘同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的变化关系曲线如图乙所示。请你根据该图中信息写出1条合理结论:
您最近一年使用:0次
名校
解题方法
4 . 我国最新型055型万吨驱逐舰上使用了最新一代国产有源相控阵雷达,采用了最先进的氮化镓( )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是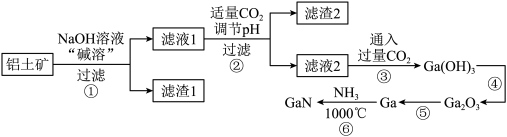
| A.可以通过粉碎铝土矿、搅拌等方法提高“碱溶”效率 |
B.由过程②、③可知,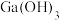 的酸性比 的酸性比 强 强 |
C.已知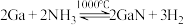 , , 与足量 与足量 反应,转移电子数为 反应,转移电子数为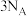 |
D.滤渣1是 ,生成滤渣2的离子方程式可能为 ,生成滤渣2的离子方程式可能为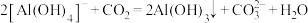 |
您最近一年使用:0次
2024-05-12更新
|
249次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
名校
解题方法
5 . I.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小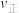
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3) 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(5)①本实验待测数据可以是___________ ,实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响﹔实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响。
②实验发现 比实验
比实验 反应速率快,原因是
反应速率快,原因是___________ 。

 时刻,正逆反应速率大小
时刻,正逆反应速率大小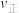
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g |  硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
 | 2.0 | 50.0 | 25 | 0 | 0 |
 | 2.0 | 40.0 | 25 | 0 | 10.0 |
 | 2.0 | 50.0 | 25 | 0.2 | 0 |
 | 2.0 | 50.0 | 35 | 0 | 0 |
(5)①本实验待测数据可以是
 和实验
和实验 可以探究
可以探究 和实验
和实验 可以探究
可以探究②实验发现
 比实验
比实验 反应速率快,原因是
反应速率快,原因是
您最近一年使用:0次
2024-04-28更新
|
332次组卷
|
2卷引用:安徽省合肥市六校联盟2023-2024学年高一下学期4月期中考试化学试题
名校
6 . 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述不正确的是

| A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图甲所示实验中反应速率:①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D.为检查图乙所示装置的气密性,可关闭A处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近一年使用:0次
2024-03-12更新
|
1053次组卷
|
5卷引用:安徽省蚌埠市怀远禹泽、固镇县汉兴学校2023-2024学年高二上学期12月期末联考化学试题
名校
解题方法
7 . 某实验小组取块状石灰石与过量稀盐酸反应,测得生成 的物质的量与反应时间的关系如图所示。下列说法错误的是
的物质的量与反应时间的关系如图所示。下列说法错误的是
 的物质的量与反应时间的关系如图所示。下列说法错误的是
的物质的量与反应时间的关系如图所示。下列说法错误的是
A.反应的离子方程式为 |
B.0~2min生成 的平均反应速率为 的平均反应速率为 |
| C.2~4min反应速率较快的原因是反应放热使体系温度升高 |
| D.将块状石灰石研磨成粉末可加快反应速率 |
您最近一年使用:0次
2024-03-06更新
|
91次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年上学期高二11月期中考试化学试题
名校
8 . 草酸( )为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究
)为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究 ,的制备及有关性质实验。
,的制备及有关性质实验。
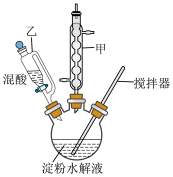
回答下列问题:
I.制备
查阅资料,利用淀粉的水解液,在浓硫酸催化作用下用硝酸氧化可得 (装置如图,加热及夹持仪器已省略)。
(装置如图,加热及夹持仪器已省略)。
(1)实验时___________ (填“必需”或“无需”)打开仪器乙的玻璃塞,仪器甲冷凝水必须从下口通入,原因是_________________________________ 。
(2)反应温度控制不超过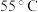 ,可采用的方法是
,可采用的方法是_________________________________ 。
(3)下列可以证明 是弱电解质的是___________(填字母)。
是弱电解质的是___________(填字母)。
Ⅱ.有关性质实验
小组同学拟用溶液与 溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:
溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:
(4) 溶液与
溶液与 反应,溶液立即呈紫红色,写出该反应的离子方程式:
反应,溶液立即呈紫红色,写出该反应的离子方程式:____________________ 。
(5)表格中a、b的数值分别为___________ 、___________ , 、
、 、
、 数值最大的是
数值最大的是___________ 。
(6)实验编号①④的目的是探究___________ 对化学反应速率的影响。
 )为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究
)为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究 ,的制备及有关性质实验。
,的制备及有关性质实验。
回答下列问题:
I.制备

查阅资料,利用淀粉的水解液,在浓硫酸催化作用下用硝酸氧化可得
 (装置如图,加热及夹持仪器已省略)。
(装置如图,加热及夹持仪器已省略)。(1)实验时
(2)反应温度控制不超过
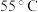 ,可采用的方法是
,可采用的方法是(3)下列可以证明
 是弱电解质的是___________(填字母)。
是弱电解质的是___________(填字母)。| A.向草酸溶液中滴加石蕊,溶液呈红色 |
B.室温下,测得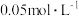 的 的 溶液的 溶液的 约为3 约为3 |
C.室温下,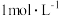 的 的 溶液的 溶液的 |
D.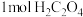 完全反应消耗 完全反应消耗 |
Ⅱ.有关性质实验
小组同学拟用溶液与
 溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:
溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:编号 |
| V( | V( | V(蒸馏水)/ | 变色时间/s |
① | 25 | 2.0 | 8.0 | 0 |
|
② | 25 | 2.0 | 5.0 | a |
|
③ | 25 | 2.0 | b | 2 |
|
④ | 30 | 2.0 | 8.0 | 0 |
|
(4)
 溶液与
溶液与 反应,溶液立即呈紫红色,写出该反应的离子方程式:
反应,溶液立即呈紫红色,写出该反应的离子方程式:(5)表格中a、b的数值分别为
 、
、 、
、 数值最大的是
数值最大的是(6)实验编号①④的目的是探究
您最近一年使用:0次
名校
9 . 用酸性高锰酸钾溶液与草酸( )溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是
)溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是

 )溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是
)溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 实验温度/℃ | 溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 溶液 溶液 |  | 3mol·L-1 溶液 溶液 | 0.05mol·L-1 溶液 溶液 | |||
| Ⅰ | 2.0 |  | 2.0 | 3.0 | 20 | 2.6 |
| Ⅱ |  | 2.0 | 2.0 | 3.0 | T | 1.4 |
| Ⅲ | 2.0 | 3.0 | 2.0 | 3.0 | 45 | 1.0 |

A.某同学认为也可以通过改变 溶液的浓度探究浓度变化对速率的影响 溶液的浓度探究浓度变化对速率的影响 |
B. 后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 |
C.实验Ⅲ中,从反应开始至 溶液褪至无色时间段内, 溶液褪至无色时间段内, mol⋅L-1⋅min-1 mol⋅L-1⋅min-1 |
D. |
您最近一年使用:0次
名校
解题方法
10 . 关于煤的处理是工业重要的生产工艺,从煤的气化到液化是重要环节。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:
Ⅰ.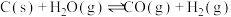

Ⅱ.
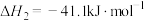
①下列说法正确的是_______ 。
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ MPa(以分压表示,分压=总压×物质的量分数)。
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为
 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
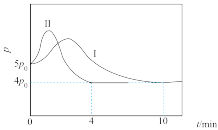
①曲线Ⅱ所对应的改变的条件可能为_______ 。
②体系总压强先增大的原因为_______ ,后减小的原因为_______ 。
③该条件下 的平衡转化率为
的平衡转化率为_______ %(结果保留三位有效数字)。
(1)煤的气化是重要的制氢途径,在一定温度下,向体积固定的密闭容器中加入足量的C(s)和
 ,起始压强为0.2MPa时,下列反应生成水煤气:
,起始压强为0.2MPa时,下列反应生成水煤气:Ⅰ.
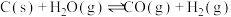

Ⅱ.

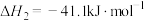
①下列说法正确的是
A.平衡时升高温度,反应Ⅰ的平衡逆向移动 B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于 D.将炭块粉碎,可加快反应速率
D.将炭块粉碎,可加快反应速率②反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)掺杂硒的纳米氧化亚铜催化剂可用于工业上水煤气合成甲醇,实现煤的间接液化,其反应为

 。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和
。向起始温度为:125℃的5L恒容密闭容器中充入2mol CO和 发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。
①曲线Ⅱ所对应的改变的条件可能为
②体系总压强先增大的原因为
③该条件下
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次


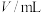
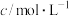


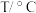
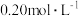 的
的 的
的