名校
解题方法
1 . 采取下列措施对增大化学反应速率有明显效果的是
| A.铁与稀硫酸反应,滴入几滴硫酸铜溶液 |
B. 与无水乙醇反应时增大无水乙醇的用量 与无水乙醇反应时增大无水乙醇的用量 |
C. 与 与 两溶液反应时,增大压强 两溶液反应时,增大压强 |
D. 与稀盐酸反应,加入少量醋酸钠粉末 与稀盐酸反应,加入少量醋酸钠粉末 |
您最近一年使用:0次
2024-01-02更新
|
327次组卷
|
4卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
名校
2 . 某小组学生设计了如下定性探究影响化学反应速率因素的实验。依据可选试剂: 溶液、
溶液、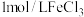 溶液、蒸馏水、
溶液、蒸馏水、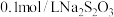 溶液、
溶液、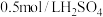 溶液、
溶液、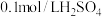 溶液。请按要求回答下列问题。
溶液。请按要求回答下列问题。
(1)小组确定实验探究的反应原理及其对应的预期现象(填充空白)
(2)学生甲选择原理i,探究催化剂对该反应速率的因素,必选试剂除 溶液外,还应选
溶液外,还应选___________ 。
(3)学生乙设计下图所示对比实验,探究硫酸浓度对反应ii速率的影响,试剂X及其用量:___________ 。
①对比实验Ⅰ、Ⅱ,为探究___________ 对该反应速率的影响。
②a=___________ ℃。
③V=___________ mL,加入VmL水的目的是___________ 。
④对比上述实验数据,推测反应速率最快的是___________ (填实验编号)。
 溶液、
溶液、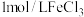 溶液、蒸馏水、
溶液、蒸馏水、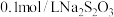 溶液、
溶液、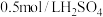 溶液、
溶液、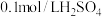 溶液。请按要求回答下列问题。
溶液。请按要求回答下列问题。(1)小组确定实验探究的反应原理及其对应的预期现象(填充空白)
| 实验 | 化学方程式 | 预期观察的现象 |
| 原理i | 产生气泡快慢 | |
| 原理ii |
(2)学生甲选择原理i,探究催化剂对该反应速率的因素,必选试剂除
 溶液外,还应选
溶液外,还应选(3)学生乙设计下图所示对比实验,探究硫酸浓度对反应ii速率的影响,试剂X及其用量:

| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | |||
| 浓度/(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | 体积/mL | 温度/℃ | |
| Ⅰ | 0.1 | 1 | 0.5 | 1 | V | 30 |
| Ⅱ | 0.1 | 2 | 0.5 | 1 | 7 | a |
| Ⅲ | 0.1 | 2 | 0.5 | 1 | 7 | 40 |
②a=
③V=
④对比上述实验数据,推测反应速率最快的是
您最近一年使用:0次
2023-10-28更新
|
83次组卷
|
2卷引用:贵州省毕节市金沙县第五中学2023-2024学年高一下学期期中考试化学试题
名校
3 . 氢能是一种极具发展潜力的清洁能源,下列反应是目前大规模制取氢气的方法之一。CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ/mol,恒温恒容时,下列措施可以同时提高反应速率和H2O的转化率的是
| A.加压 | B.增大一氧化碳的浓度 | C.升温 | D.分离出二氧化碳 |
您最近一年使用:0次
2023-08-25更新
|
167次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州兴义第一中学2022-2023学年高一下学期第三次月考化学试题
4 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明: 为二元弱酸,其水溶液无色)
为二元弱酸,其水溶液无色)
(1)已知酸性 溶液与
溶液与 溶液反应的离子方程式为:
溶液反应的离子方程式为: ,该反应中每转移
,该反应中每转移 电子,产生的
电子,产生的 在标况下的体积为
在标况下的体积为___________ 。
(2)其表格中
___________ 、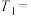
___________ ;通过实验___________ (只填a、b、c实验序号中的2个)可探究出温度变化对化学反应速率的影响,其表格中
___________ 。
(3)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是___________ ;忽略溶液体积的变化,利用实验b中数据计算, 内,用
内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
___________ 。
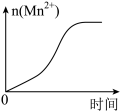
(4)该小组的一位同学通过查阅资料发现,上述实验过程中 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是___________ 。
 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明: 为二元弱酸,其水溶液无色)
为二元弱酸,其水溶液无色)| 实验 序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无 色所需时间/s | ||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||||
 |  |  |  | 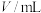 | |||
| a | 293 | 2 | 0.02 | 4 | 0.1 | 0 |  |
| b |  | 2 | 0.02 | 3 | 0.1 |  | 8 |
| c | 313 | 2 | 0.02 |  | 0.1 | 1 |  |
 溶液与
溶液与 溶液反应的离子方程式为:
溶液反应的离子方程式为: ,该反应中每转移
,该反应中每转移 电子,产生的
电子,产生的 在标况下的体积为
在标况下的体积为(2)其表格中

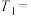

(3)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 内,用
内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(4)该小组的一位同学通过查阅资料发现,上述实验过程中
 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是
您最近一年使用:0次
2023-05-31更新
|
239次组卷
|
2卷引用:贵州省贵阳市三新改革联盟校2022-2023学年高一下学期5月联考化学试题
5 . 某实验小组用 KI溶液、
KI溶液、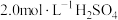 溶液、淀粉溶液等来探究外界条件对反应速率的影响,部分实验数据如表所示,查阅资料知:超过一定温度时,淀粉分子的热运动会使淀粉分子螺旋卷曲舒展开,此时淀粉与碘分子作用的显色现象消失,冷却后淀粉分子恢复螺旋卷曲的形状,淀粉与碘的显色现象会再次出现。
溶液、淀粉溶液等来探究外界条件对反应速率的影响,部分实验数据如表所示,查阅资料知:超过一定温度时,淀粉分子的热运动会使淀粉分子螺旋卷曲舒展开,此时淀粉与碘分子作用的显色现象消失,冷却后淀粉分子恢复螺旋卷曲的形状,淀粉与碘的显色现象会再次出现。
请回答下列问题:
(1)a=_______ ,b=_______ 。
(2)写出该反应的离子方程式:_______ 。
(3)Ⅰ、Ⅱ、Ⅲ、Ⅴ四组实验中,反应速率最快的是_______ (填标号)组、下列关于Ⅳ组实验没有出现蓝色可能的原因是_______ 。
(4)通过比较分析实验数据,总结外界条件对该反应的反应速率的影响。
①对比的实验:Ⅰ和Ⅱ,得出的结论是_______ 。
②对比的实验:_______ ,得出的结论是_______ 。
③对比的实验:_______ ,得出的结论是_______ 。(可不填满,也可增加)
 KI溶液、
KI溶液、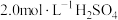 溶液、淀粉溶液等来探究外界条件对反应速率的影响,部分实验数据如表所示,查阅资料知:超过一定温度时,淀粉分子的热运动会使淀粉分子螺旋卷曲舒展开,此时淀粉与碘分子作用的显色现象消失,冷却后淀粉分子恢复螺旋卷曲的形状,淀粉与碘的显色现象会再次出现。
溶液、淀粉溶液等来探究外界条件对反应速率的影响,部分实验数据如表所示,查阅资料知:超过一定温度时,淀粉分子的热运动会使淀粉分子螺旋卷曲舒展开,此时淀粉与碘分子作用的显色现象消失,冷却后淀粉分子恢复螺旋卷曲的形状,淀粉与碘的显色现象会再次出现。| 编号 | 温度/℃ |  溶液体积/mL 溶液体积/mL | KI溶液体积/mL |  体积溶液/mL 体积溶液/mL | 淀粉溶液体积/mL | 出现蓝色所需时间/s |
| Ⅰ | 40 | 10 | 10 | 9 | 1 | 20 |
| Ⅱ | 20 | 10 | 10 | 9 | 1 | 80 |
| Ⅲ | 20 | 8 | 10 | a | 1 | 98 |
| Ⅳ | 80 | 10 | 10 | 9 | 1 | 没有出现蓝色 |
| Ⅴ | 20 | 8 | 8 | b | 1 | 120 |
(1)a=
(2)写出该反应的离子方程式:
(3)Ⅰ、Ⅱ、Ⅲ、Ⅴ四组实验中,反应速率最快的是
(4)通过比较分析实验数据,总结外界条件对该反应的反应速率的影响。
①对比的实验:Ⅰ和Ⅱ,得出的结论是
②对比的实验:
③对比的实验:
您最近一年使用:0次
2023-04-27更新
|
156次组卷
|
3卷引用:贵州省遵义市红花岗区2022-2023学年高一下学期4月期中联考化学试题
6 . 用酸性 和
和 (草酸)反应研究影响反应速率的因素,其离子方程式为
(草酸)反应研究影响反应速率的因素,其离子方程式为
 。某小组同学设计了如下表的实验方案。
。某小组同学设计了如下表的实验方案。
回答下列问题:
回答下列问题:
(1)上述实验①②是探究__________ 对化学反应速率的影响;上述实验②④是探究__________ 对化学反应速率的影响。上述实验②③可探究__________ 对化学反应速率的影响,且a为__________ 。
(2)实验③中加入amL蒸馏水的目的是________________________________________ 。
(3)除通过测定一定时间内 的体积来比较反应速率外,本实验还可通过测定
的体积来比较反应速率外,本实验还可通过测定____________________ 来比较化学反应速率。
(4)小组同学发现实验②③的反应速率变化趋势如图,其中 时间内速率变快的主要原因可能是①该反应放热、②
时间内速率变快的主要原因可能是①该反应放热、②________________________________________ 。

 和
和 (草酸)反应研究影响反应速率的因素,其离子方程式为
(草酸)反应研究影响反应速率的因素,其离子方程式为 。某小组同学设计了如下表的实验方案。
。某小组同学设计了如下表的实验方案。回答下列问题:
物理量编号 | V(0.20mol/L | V(蒸馏水)/mL | V(0.010mol/L | M( | T/℃ |
① | 2.0 | 0 | 4.0 | 0 | 50 |
② | 2.0 | 0 | 4.0 | 0 | 25 |
③ | 1.0 |
| 4.0 | 0 | 25 |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(1)上述实验①②是探究
(2)实验③中加入amL蒸馏水的目的是
(3)除通过测定一定时间内
 的体积来比较反应速率外,本实验还可通过测定
的体积来比较反应速率外,本实验还可通过测定(4)小组同学发现实验②③的反应速率变化趋势如图,其中
 时间内速率变快的主要原因可能是①该反应放热、②
时间内速率变快的主要原因可能是①该反应放热、②
您最近一年使用:0次
2022-11-27更新
|
131次组卷
|
2卷引用:贵州省部分学校2022-2023学年高二上学期10月联考化学试题
7 . 某化学小组欲测定 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol·L
溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol·L
 溶液和10 mL 0.3 mol·L
溶液和10 mL 0.3 mol·L
 溶液,所得溶液中
溶液,所得溶液中 随时间变化的曲线如图1所示,用
随时间变化的曲线如图1所示,用 表示的反应速率随时间的变化情况如图2所示。
表示的反应速率随时间的变化情况如图2所示。


(1)配平该反应的化学方程式:_________ 。
_________ _________
_________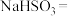 _________KCl+_________
_________KCl+_________ _________
_________
(2)根据实验数据可知,该反应在0~7 min内的平均反应速率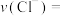
_________ mol·L ·min
·min 。
。
(3)图2中阴影部分面积表示的是_________ 。
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知 对该反应的反应速率无影响。
对该反应的反应速率无影响。
实验1:向2个烧杯中分别加入10 mL 0.1 mol·L
 溶液和10 mL 0.3 mol·L
溶液和10 mL 0.3 mol·L
 溶液,将其中一个烧杯在50℃下进行反应。
溶液,将其中一个烧杯在50℃下进行反应。
实验2;分别向2个烧杯中加入10 mL 0.1 mol·L
 溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol·L
溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol·L
 溶液;再分别向2个烧杯中加入10 mL 0.3 mol·L
溶液;再分别向2个烧杯中加入10 mL 0.3 mol·L
 溶液。
溶液。
实验3:取10 mL 0.1 mol·L
 溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol·L
溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol·L
 溶液。
溶液。
①实验1探究的是_________ ,可以用_________ 的方法控制温度为50℃。
②实验2中,向烧杯ⅰ中加入1 mL蒸馏水的作用是_________ 。
③实验3探究的可能是_________ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol·L
溶液反应的化学反应速率,所用试剂为10 mL 0.1 mol·L
 溶液和10 mL 0.3 mol·L
溶液和10 mL 0.3 mol·L
 溶液,所得溶液中
溶液,所得溶液中 随时间变化的曲线如图1所示,用
随时间变化的曲线如图1所示,用 表示的反应速率随时间的变化情况如图2所示。
表示的反应速率随时间的变化情况如图2所示。

(1)配平该反应的化学方程式:
_________
 _________
_________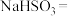 _________KCl+_________
_________KCl+_________ _________
_________
(2)根据实验数据可知,该反应在0~7 min内的平均反应速率
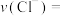
 ·min
·min 。
。(3)图2中阴影部分面积表示的是
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知
 对该反应的反应速率无影响。
对该反应的反应速率无影响。实验1:向2个烧杯中分别加入10 mL 0.1 mol·L

 溶液和10 mL 0.3 mol·L
溶液和10 mL 0.3 mol·L
 溶液,将其中一个烧杯在50℃下进行反应。
溶液,将其中一个烧杯在50℃下进行反应。实验2;分别向2个烧杯中加入10 mL 0.1 mol·L

 溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol·L
溶液;向烧杯ⅰ中加入1 mL蒸馏水,向烧杯ⅱ中加入1 mL 0.1 mol·L
 溶液;再分别向2个烧杯中加入10 mL 0.3 mol·L
溶液;再分别向2个烧杯中加入10 mL 0.3 mol·L
 溶液。
溶液。实验3:取10 mL 0.1 mol·L

 溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol·L
溶液于烧杯中,先加入少量NaCl固体,再加入10 mL 0.3 mol·L
 溶液。
溶液。①实验1探究的是
②实验2中,向烧杯ⅰ中加入1 mL蒸馏水的作用是
③实验3探究的可能是
您最近一年使用:0次
解题方法
8 . I.一定条件下,在 的密闭容器中
的密闭容器中 和
和 合成
合成 ,X、Y、Z代表三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
,X、Y、Z代表三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:

(1)从开始至2min,用N2表示的反应速率为_______ ,H2的平衡转化率为_______ 。
(2)控制变量法是化学实验的一种常用方法,下表是稀硫酸与某金属反应的实验数据。
分析上述数据,回答下列问题:
①
_______ mL,
_______ 125(填“>”、“<”或=”)。
②实验1和2的目的是_______ 。
③根据表中实验2和4的实验数据,可以得到的结论是_______ 。
II.电池的发展是化学对人类的一项重大贡献。依据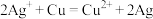 设计的原电池如图所示。
设计的原电池如图所示。

请回答下列问题:
(3)电解质溶液Y是_______ 。
(4)X电极发生_______ 反应(填“氧化”或“还原”):银电极上发生的电极反应式为_______ 。
 的密闭容器中
的密闭容器中 和
和 合成
合成 ,X、Y、Z代表三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
,X、Y、Z代表三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
(1)从开始至2min,用N2表示的反应速率为
(2)控制变量法是化学实验的一种常用方法,下表是稀硫酸与某金属反应的实验数据。
| 实验序号 | 金属质量g | 金属形状 |  |  | 溶液温度/℃ | 金属消失的时间s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 块状 | 0.8 |  | 20 | 35 |  |
| 2 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 3 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
①


②实验1和2的目的是
③根据表中实验2和4的实验数据,可以得到的结论是
II.电池的发展是化学对人类的一项重大贡献。依据
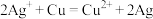 设计的原电池如图所示。
设计的原电池如图所示。
请回答下列问题:
(3)电解质溶液Y是
(4)X电极发生
您最近一年使用:0次
名校
解题方法
9 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/L NaHSO3溶液,所得数据如图所示。
已知:ClO +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
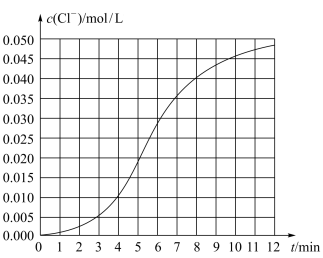
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=____ mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
①补全方案I中的实验操作:____ 。
②方案II中的假设为____ 。
③除I、II、III中的假设外,还可以提出的假设是____ 。
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____ 。
ii.12min后,化学反应速率变慢的原因是_____ 。
已知:ClO
 +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
| 方案 | 假设 | 实验操作 |
| I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,_____ |
| II | ____ | 取10mL0.1mol/L KClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液 |
| III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1mL水,向烧杯②中加入1mL0.2mol/L盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液 |
②方案II中的假设为
③除I、II、III中的假设外,还可以提出的假设是
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:
ii.12min后,化学反应速率变慢的原因是
您最近一年使用:0次
2022-06-18更新
|
457次组卷
|
12卷引用:贵州省“三新”改革联盟2021-2022学年高一下学期校联考等级考(四)化学试题
贵州省“三新”改革联盟2021-2022学年高一下学期校联考等级考(四)化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)必修第二册RJ第6章第二节 化学反应的速率与限度 课时1人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素河南省洛阳市2020-2021学年高一下学期期中考试化学试题选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题北京海淀区八一学校2021-2022学年高一下学期6月月考化学试题2019版鲁科化学必修第二册第2章本章自我评价课后习题2.1.2影响化学反应速率的因素 课后
名校
解题方法
10 . 某小组利用硫代硫酸钠溶液与稀硫酸反应: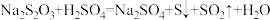 ,探究反应条件对速率的影响,下列有关说法正确的是
,探究反应条件对速率的影响,下列有关说法正确的是
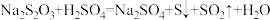 ,探究反应条件对速率的影响,下列有关说法正确的是
,探究反应条件对速率的影响,下列有关说法正确的是| 选项 | 反应温度/℃ |  溶液 溶液 | 稀 |  | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | x |
| ③ | 50 | 10 | 0.1 | 5 | 0.2 | 5 |
| ④ | 50 | 10 | 0.1 | 10 | 0.1 | 0 |
| A.可通过产生浑浊的时间或单位时间内产生气体的体积判断反应的快慢 |
| B.①④探究温度对速率的影响,实验时将溶液混合后置于相应温度的水浴中 |
| C.①③两组实验可探究硫酸浓度对反应速率的影响 |
D.x=5,①②两组实验可探究 浓度对反应速率的影响 浓度对反应速率的影响 |
您最近一年使用:0次
2022-01-16更新
|
2192次组卷
|
6卷引用:贵州省黔西南州金成实验学校2022-2023学年高一下学期期末质量检测化学试卷

 溶液)/mL
溶液)/mL 溶液)/mL
溶液)/mL 固体)/g
固体)/g


