名校
解题方法
1 . 对于反应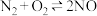 在密闭容器中进行,其他条件不变时,下列哪些条件能加快反应的速率
在密闭容器中进行,其他条件不变时,下列哪些条件能加快反应的速率
①缩小体积使压强增大
②体积不变充入 使压强增大
使压强增大
③体积不变充入He使压强增大
④升高温度使压强增大
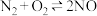 在密闭容器中进行,其他条件不变时,下列哪些条件能加快反应的速率
在密闭容器中进行,其他条件不变时,下列哪些条件能加快反应的速率①缩小体积使压强增大
②体积不变充入
 使压强增大
使压强增大③体积不变充入He使压强增大
④升高温度使压强增大
| A.全部 | B.①③④ | C.①②③ | D.①②④ |
您最近一年使用:0次
2 . 宏观辨识与微观探析是化学学科核心素养之一。下列对应离子方程式书写错误的是
A.硫代硫酸钠溶液中滴入稀硫酸: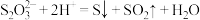 |
B.将碘盐(含 )加入滴加淀粉碘化钾的醋酸溶液中: )加入滴加淀粉碘化钾的醋酸溶液中: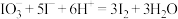 |
C.向烧碱溶液中加入一小段铝片: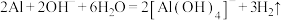 |
D.等浓度 和 和 溶液等体积混合: 溶液等体积混合: |
您最近一年使用:0次
2024-02-24更新
|
67次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高二下学期2月收心考试化学试题
名校
解题方法
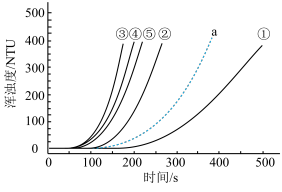
3 . 室温下,用0.1 mol·L-1Na2S2O3溶液、0.1 mol·L-1H2SO4溶液和蒸馏水进行如下表所示的5个实验,分别测量浑浊度随时间的变化。
下列说法不正确 的是
| 编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 浑浊度随时间变化的曲线 |
| V/mL | V/mL | V/mL | ||
| ① | 1.5 | 3.5 | 10 |
|
| ② | 2.5 | 3.5 | 9 | |
| ③ | 3.5 | 3.5 | x | |
| ④ | 3.5 | 2.5 | 9 | |
| ⑤ | 3.5 | 1.5 | 10 |
| A.实验③中x=8 |
| B.实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率 |
| C.将装有实验②的试剂的试管浸泡在热水中一段时间后再混合,其浑浊度曲线应为a |
| D.降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大 |
您最近一年使用:0次
2024-01-23更新
|
144次组卷
|
15卷引用:湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题
湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题北京市朝阳区2022-2023学年高二上学期期末考试化学试题北京市第二中学2022-2023学年高一下学期期末考试化学试题 北京市第一七一中学2023-2024学年高二上学期10月月考化学试题北京市丰台区2023-2024学年高二上学期期中联考(B卷)化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题河南省实验中学2023-2024学年高二上学期期中考试化学试题北京市第二中学2023-2024学年高二上学期第二学段 段考化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题云南省曲靖市2023-2024学年高二上学期1月期末化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题四川省成都市教育科学研究院附属中学2023-2024学年高二上学期10月月考化学试题北京市第三十五中学2023-2024学年高一下学期(选考)期中测试化学试题
名校
解题方法
4 . 某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO +5SO
+5SO +2H+=I2+5SO
+2H+=I2+5SO +H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
下列判断正确的是
 +5SO
+5SO +2H+=I2+5SO
+2H+=I2+5SO +H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。| 实验序号 | 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1 Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 5 | t1 |
| ② | 5 | 5 | 40 | 25 | t2 |
| ③ | 5 | V2 | 35 | 25 | t3 |
| A.实验①③中V1=10,V2=40 |
| B.最先出现蓝色的一组是实验③ |
| C.开始出现蓝色的时间:t1<t2 |
| D.探究温度对化学反应速率的影响应该选择实验①③ |
您最近一年使用:0次
名校
解题方法
5 . 采取下列措施对增大化学反应速率有明显效果的是
| A.铁与稀硫酸反应,滴入几滴硫酸铜溶液 |
B. 与无水乙醇反应时增大无水乙醇的用量 与无水乙醇反应时增大无水乙醇的用量 |
C. 与 与 两溶液反应时,增大压强 两溶液反应时,增大压强 |
D. 与稀盐酸反应,加入少量醋酸钠粉末 与稀盐酸反应,加入少量醋酸钠粉末 |
您最近一年使用:0次
2024-01-02更新
|
327次组卷
|
4卷引用:湖北省九师联盟2024届高三11月质检化学试题
名校
6 . 某反应的反应机理可以分成如下两步,下列说法错误的是
| 反应机理 | 第一步反应 | 第二步反应 |
 (慢反应) (慢反应) | 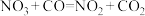 (快反应) (快反应) |
| A.在条件相同时,该反应的速率由第一步反应速率决定 |
| B.该反应的总反应方程式为NO2+CO=NO+CO2 |
| C.升高温度只会影响第一步反应速率,对第二步反应速率无影响 |
| D.加入合适的催化剂可降低反应的活化能,加快反应速率 |
您最近一年使用:0次
2024-01-01更新
|
144次组卷
|
12卷引用:湖北省武汉市部分学校2021-2022学年高二上学期12月联考化学试题
湖北省武汉市部分学校2021-2022学年高二上学期12月联考化学试题湖北省武汉市新洲区第一中学2024届高二上学期11月阶段测试化学试题安徽省A10联盟2022届高三上学期摸底考试化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期中考试化学(理)试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)2021年广东省高考化学试卷变式题11-21吉林省长春市第二十中学2021-2022学年高二上学期第一次质量检测化学试题四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题陕西省渭南市杜桥中学2023-2024学年高二上学期期中考试化学试卷 (已下线)专题02 化学反应速率-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河北省保定市高碑店市崇德实验中学2023-2024学年高二上学期1月考试化学试题
解题方法
7 . 下列有关化学反应速率的叙述正确的是
| A.Na与水反应时,增加水的用量,可以使化学反应速率明显增大 |
| B.升高温度,反应物分子中活化分子百分数增加,化学反应速率增大 |
C.NaCl溶液与 溶液反应时,增大压强,可以使化学反应速率明显增大 溶液反应时,增大压强,可以使化学反应速率明显增大 |
| D.反应体系中加入相同浓度的反应物,活化分子百分数增大,化学反应速率增大 |
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)等质量的碳酸钙与过量的一定浓度稀盐酸在不同的实验条件下进行反应,测定反应过程中产生二氧化碳体积 与时间(
与时间( )的数据,根据数据绘制得图。
)的数据,根据数据绘制得图。

(1)①曲线 、
、 对应的实验组别分别为
对应的实验组别分别为_____________ 、_____________
②对比实验_____________ 和_____________ 说明温度对化学反应速率的影响。
③用浓度相同的稀硫酸代替盐酸进行实验I,下列说法错误的是_____________
A.因为都是强酸所以反应速率不变
B.稀硫酸为二元强酸,氢离子浓度增大,故反应速率变大
C.无论稀硫酸或稀盐酸,均可以通过测定和记录相同时间内收集到的二氧化碳气体体积,可比较反应速率。
(2)反应物( )转化为产物(
)转化为产物( 或
或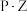 的能量与反应进程的关系如下图所示:
的能量与反应进程的关系如下图所示:
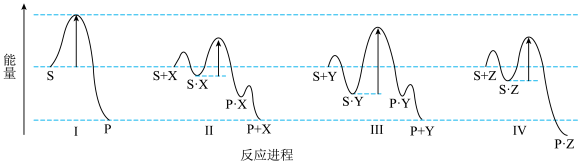
①进程Ⅱ、Ⅲ、Ⅳ使用 、
、 、
、 三种物质,其中表现出催化作用的是
三种物质,其中表现出催化作用的是_____________ (填写 、
、 、
、 字母)
字母)
②比较进程Ⅰ、Ⅱ中生成 的产率大小:Ⅰ
的产率大小:Ⅰ_____________ Ⅱ(填“大于”“等于”“小于”)比较进程Ⅱ、Ⅲ中生成 的速率大小:Ⅱ
的速率大小:Ⅱ_____________ Ⅲ(填“大于”“等于”“小于”)
(3)某反应在催化剂时有效降低汽车尾气污染物的排放,其反应热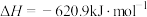 。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(
。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态)。
表示过渡态)。

①第一个基元反应的反应热 =
=_____________ .
②该过程总反应的化学方程式为:__________________________________________
(1)等质量的碳酸钙与过量的一定浓度稀盐酸在不同的实验条件下进行反应,测定反应过程中产生二氧化碳体积
 与时间(
与时间( )的数据,根据数据绘制得图。
)的数据,根据数据绘制得图。| 实验组别 |  | 温度/℃ | 形状(碳酸钙) |
| Ⅰ | 2.0 | 30 | 块状 |
| Ⅱ | 2.5 | 30 | 块状 |
| Ⅲ | 2.5 | 50 | 粉末状 |
| Ⅳ | 2.5 | 50 | 块状 |

(1)①曲线
 、
、 对应的实验组别分别为
对应的实验组别分别为②对比实验
③用浓度相同的稀硫酸代替盐酸进行实验I,下列说法错误的是
A.因为都是强酸所以反应速率不变
B.稀硫酸为二元强酸,氢离子浓度增大,故反应速率变大
C.无论稀硫酸或稀盐酸,均可以通过测定和记录相同时间内收集到的二氧化碳气体体积,可比较反应速率。
(2)反应物(
 )转化为产物(
)转化为产物( 或
或 的能量与反应进程的关系如下图所示:
的能量与反应进程的关系如下图所示:
①进程Ⅱ、Ⅲ、Ⅳ使用
 、
、 、
、 三种物质,其中表现出催化作用的是
三种物质,其中表现出催化作用的是 、
、 、
、 字母)
字母)②比较进程Ⅰ、Ⅱ中生成
 的产率大小:Ⅰ
的产率大小:Ⅰ 的速率大小:Ⅱ
的速率大小:Ⅱ(3)某反应在催化剂时有效降低汽车尾气污染物的排放,其反应热
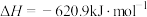 。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(
。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态)。
表示过渡态)。
①第一个基元反应的反应热
 =
=②该过程总反应的化学方程式为:
您最近一年使用:0次
名校
解题方法
9 . Ⅰ、某实验小组用0.50mol·L−1NaOH溶液和0.50mol·L−1硫酸进行中和热的测定。回答下列问题:
(1)配制0.50mol·L−1NaOH溶液:若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_____ g。
(2)从下表中选择,称量NaOH固体所需要的仪器是_____ (填字母)。
(3)测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。若生成1molH2O时反应放出的热量为57.3kJ,写出该反应的热化学方程式:_____ 。
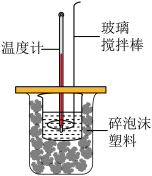
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
②用上述实验数值计算的结果_____ 57.3kJ·mol−1(填“>”“=”或“<”),产生偏差的原因可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅱ、实验室利用下列方案探究影响化学反应速率的因素。回答下列问题:
(5)实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定_____ 来判断反应的快慢。
(6)实验①、②、③所加H2C2O4溶液均要过量,理由是_____ 。
(7)实验①和实验②是探究_____ 对化学反应速率的影响,实验②和③是探究_____ 对化学反应速率的影响。
(8)实验①和②起初反应均很慢,过了一会儿速率突然显著增大,可能原因是_____ 。
(1)配制0.50mol·L−1NaOH溶液:若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体
(2)从下表中选择,称量NaOH固体所需要的仪器是
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2−t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅱ、实验室利用下列方案探究影响化学反应速率的因素。回答下列问题:
| 编号 | 温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | ||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | ||
| ① | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| ② | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| ③ | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
(6)实验①、②、③所加H2C2O4溶液均要过量,理由是
(7)实验①和实验②是探究
(8)实验①和②起初反应均很慢,过了一会儿速率突然显著增大,可能原因是
您最近一年使用:0次
名校
10 . 已知碘的四氯化碳溶液能与 溶液发生反应:
溶液发生反应: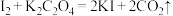 ,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成 气体的体积来比较化学反应速率的大小,实验装置如图1所示。
气体的体积来比较化学反应速率的大小,实验装置如图1所示。
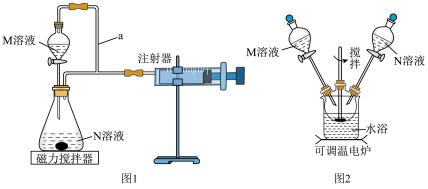
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为___________ 。
②盛装M溶液的仪器名称为___________ ,a的作用是___________ 。
③该实验探究的是___________ 对化学反应速率的影响。
④在反应停止前,相同时间内注射器中所得 的体积较多的是
的体积较多的是___________ (填“实验Ⅰ”或“实验Ⅱ”)。
(2)乙组:通过测定溶液褪色所用时间来比较化学反应速率的大小,实验装置如图2所示。
实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
①该实验探究的是___________ 对化学反应速率的影响。
②该组同学始终没有观察到实验A的溶液褪色,其原因是___________ 。
 溶液发生反应:
溶液发生反应: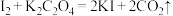 ,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:(1)甲组:通过测定单位时间内生成
 气体的体积来比较化学反应速率的大小,实验装置如图1所示。
气体的体积来比较化学反应速率的大小,实验装置如图1所示。
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为
②盛装M溶液的仪器名称为
③该实验探究的是
④在反应停止前,相同时间内注射器中所得
 的体积较多的是
的体积较多的是(2)乙组:通过测定溶液褪色所用时间来比较化学反应速率的大小,实验装置如图2所示。
实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
| 序号 | M溶液 | N溶液 | 水浴温度 |
| A | 含0.01mol碘的四氯化碳溶液20mL | 20mL 的 的 溶液 溶液 | 40℃ |
| B | 含0.01mol碘的四氯化碳溶液20mL | 20mL 的 的 溶液 溶液 | 40℃ |
| C | 含0.01mol碘的四氯化碳溶液20mL | 20mL 的 的 溶液 溶液 | 50℃ |
②该组同学始终没有观察到实验A的溶液褪色,其原因是
您最近一年使用:0次
2023-09-07更新
|
170次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2023-2024学年高二上学期10月月考化学试题