9-10高二下·海南·期中
名校
解题方法
1 . 在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是
①升高温度 ②使用催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强
①升高温度 ②使用催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强
| A.①②③⑤ | B.①②④⑤ | C.①③④ | D.①②③④ |
您最近一年使用:0次
2021-12-02更新
|
460次组卷
|
19卷引用:西藏林芝市第二高级中学2022-2023学年高一下学期期末考试化学试题
西藏林芝市第二高级中学2022-2023学年高一下学期期末考试化学试题(已下线)2010年海南省海南中学高二第二学期期中考试化学(文)试卷(已下线)2010-2011学年广东省龙山中学高一下学期期中考试化学试卷(已下线)2011-2012学年吉林省四校高一下学期期中联考化学试卷(已下线)2013-2014学年贵州省重点高中高二上学期期中考试理科化学试卷2014-2015学年黑龙江省伊春市伊春二中高二上学期期中化学试卷2014-2015河南省周口中英文学校高一下学期期中考试化学试卷辽宁省大石桥市第二高级中学2016-2017学年高二学业水平模拟测试化学试题黑龙江省牡丹江市第一高级中学2016-2017学年高一下学期期末考试化学试题山东省德州市第二中学2018-2019学年高一下学期第一次模块检测(A卷)化学试题广西桂林市第十八中学2019-2020学年高二上学期期中考试化学(文)试题重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题湖北省襄阳市第一中学2021-2022学年高一下学期4月月考化学试题重庆市巫山大昌中学校2021-2022学年高一下学期期末考试化学试题黑龙江省鸡西市密山市第四中学2021-2022学年高二上学期期末考试化学试题安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题四川省绵阳市南山中学实验学校2022-2023学年高一下学期5月月考化学试题湖北省武汉三牛中学2023-2024学年高一下学期3月月考 化学试
名校
2 . 某同学研究影响双氧水分解反应速率的因素,反应方程式为2H2O2 = 2H2O+O2↑,下列措施不能加快该反应速率的是
| A.升高溶液温度 |
| B.加入少许 MnO2 |
| C.向反应液中加水 |
| D.增大 H2O2的浓度 |
您最近一年使用:0次
2020-07-22更新
|
134次组卷
|
4卷引用:西藏林芝市第二高级中学2020-2021学年高二上学期期中考试理综化学试题
3 . 工业上可利用 和
和 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ: ∆H1平衡常数为K1
∆H1平衡常数为K1
反应Ⅱ: ∆H2平衡常数为K2
∆H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
现有反应Ⅲ: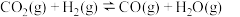 ∆H3平衡常数为K3,结合上表数据分析,K3=
∆H3平衡常数为K3,结合上表数据分析,K3=________ (用K1、K2表示)。反应Ⅲ是________ (填“放热”或“吸热”)反应,为提高 的转化率可采取的措施有
的转化率可采取的措施有________ (写出任意两条)。
(2)一定条件下,在密闭容器中充入 和
和 进行如下反应:
进行如下反应: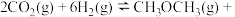
 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
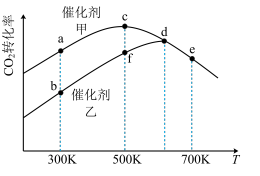
①该可逆反应的反应热∆H________ 0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________ (填“大”或“小”)。
③ 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________ (填“高”、“相等”或“低”)
④图中达到平衡的点是________ 。
(3)工业上常用高浓度的 溶液吸收
溶液吸收 ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
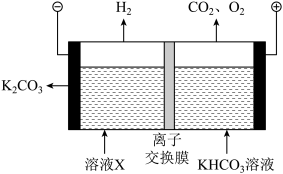
①在阳极区发生的反应有:________ 和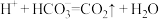 。
。
②简述 在阴极区再生的原理:
在阴极区再生的原理:________ 。
 和
和 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:(1)反应Ⅰ:
 ∆H1平衡常数为K1
∆H1平衡常数为K1反应Ⅱ:
 ∆H2平衡常数为K2
∆H2平衡常数为K2不同温度下,K1、K2的值如表所示:
 | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
现有反应Ⅲ:
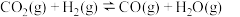 ∆H3平衡常数为K3,结合上表数据分析,K3=
∆H3平衡常数为K3,结合上表数据分析,K3= 的转化率可采取的措施有
的转化率可采取的措施有(2)一定条件下,在密闭容器中充入
 和
和 进行如下反应:
进行如下反应: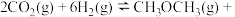
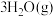 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
①该可逆反应的反应热∆H
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能
③
 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率④图中达到平衡的点是
(3)工业上常用高浓度的
 溶液吸收
溶液吸收 ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
①在阳极区发生的反应有:
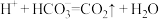 。
。②简述
 在阴极区再生的原理:
在阴极区再生的原理:
您最近一年使用:0次
名校
解题方法
4 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸(H2C2O4)的反应,记录如表所示的实验数据:
(1)请写出该反应的离子方程式______ ,当该反应以表中数据反应完全时转移电子数为NA。
(2)V1=_______ mL。
(3)根据表中的实验①、②数据,可以得到的结论是_______ 。
(4)探究温度对化学反应速率的影响,应选择_______ (填实验编号)
(5)该小组根据经验绘制了 n (Mn 2+)随时间变化的趋势如图 1 所示,但有同学查阅已有实验资料发现,该实验过程中 n (Mn 2+)随时间变化的实际趋势如图 2 所示。
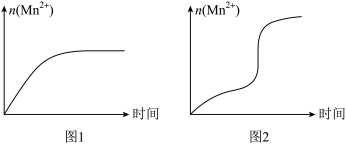
该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
②小组同学提出的假设是________ 。
②若该小组同学提出的假设成立,应观察到________ 现象。
| 实验 | 实验 | 试管中所加试剂及其用量/mL | 溶液褪至无 | |||
| 编号 | 温度 | 0.6mol/L H2C2O4溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | 色所需时间 /min |
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式
(2)V1=
(3)根据表中的实验①、②数据,可以得到的结论是
(4)探究温度对化学反应速率的影响,应选择
| 实验编号 | 实验温度 /℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间/min | |||
| ④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
| 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||

该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
②小组同学提出的假设是
②若该小组同学提出的假设成立,应观察到
您最近一年使用:0次
名校
5 . (I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
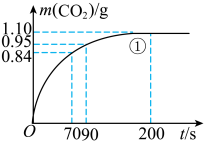
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________ (忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________ 。
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(3)表中V1=_______ mL,V2=_______ mL。
(4)探究温度对化学反应速率影响的实验编号是________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________ 。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________ mol·L-1·min-1。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e |
| ② | 25 | 粗颗粒 | a | |
| ③ | b | 粗颗粒 | 2.00 | |
| ④ | c | 细颗粒 | d |

(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
| 实验编号 | 0.1 mol·L-1酸性KMnO4溶液的体积/mL | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| ① | 10 | V1 | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 | V2 | 50 |
(4)探究温度对化学反应速率影响的实验编号是
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
您最近一年使用:0次
2019-10-16更新
|
1247次组卷
|
8卷引用:西藏拉萨那曲高级中学2021-2022学年高二上学期期中考试化学试题
西藏拉萨那曲高级中学2021-2022学年高二上学期期中考试化学试题福建省龙岩市连城县第一中学2019-2020学年高二上学期第一次月考化学试题2人教版(2019)高中化学必修第二册第六章《化学反应与能量》检测题(已下线)专题06 化学反应的速率和限度(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 第一节综合训练选择性必修1 专题2 第一单元综合训练河南省通许县一中2022—2023年高二上学期第一次月考化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题
名校
6 . SO2的催化氧化反应(2SO2+O2  2SO3)是一个放热的反应。如果反应在密闭容器中进行,下列有关说法中正确的是
2SO3)是一个放热的反应。如果反应在密闭容器中进行,下列有关说法中正确的是
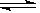 2SO3)是一个放热的反应。如果反应在密闭容器中进行,下列有关说法中正确的是
2SO3)是一个放热的反应。如果反应在密闭容器中进行,下列有关说法中正确的是| A.因为反应放热,所以升高温度会使反应速率减慢 |
| B.通过调控反应条件,SO2可以100%地转化为SO3 |
| C.当SO2与SO3的浓度相等时,反应达到平衡 |
| D.使用催化剂的目的是加快反应速率,提高生产效率 |
您最近一年使用:0次
2017-06-25更新
|
529次组卷
|
10卷引用:西藏林芝市第一中学2020-2021学年高一下学期期末考试化学试题
西藏林芝市第一中学2020-2021学年高一下学期期末考试化学试题2014-2015山东省淄博市第一中学高一下学期期中考试化学试卷四川省乐山市高中2016-2017学年高一下期期末考试化学试题湖北省宜昌市协作体2016-2017学年高一下学期期末考试化学试题云南省南涧县民族中学2017-2018学年高二12月月考化学试题【全国市级联考】湖南省湘西自治州2017-2018学年高一下学期期末质量检测化学试题内蒙古包钢第一中学中2019-2020学年高二上学期期中考试理综化学试题广东省梅州市五华县2018-2019学年高一上学期第六次质量监测化学试题四川省蓬安中学校2019-2020学年高二上学期开学考试化学试题江苏省淮安市高中校协作体2021-2022学年高一下学期期中考试化学试题



