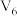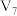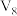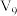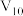名校
1 . I.用一定质量的Zn跟足量的稀硫酸反应制氢气,请回答:
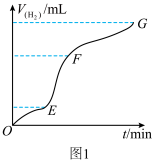
(1)实验过程如图1所示,EF段化学反应速率加快与该反应是___________ (填“放热”或“吸热”)反应有关。
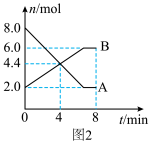
Ⅱ.某温度时,气体A、B在5 L密闭容器中反应的物质的量随时间变化的曲线如图2所示。由图中数据分析求:___________ 。
(4)反应开始至4 min时,A的平均反应速率为___________ 。
(5)4min时,正、逆反应速率的大小关系为:v(正)___________ v(逆) (填“>”、“<”或“=”)。
(6)平衡时气体A的体积分数为___________ 。
(1)实验过程如图1所示,EF段化学反应速率加快与该反应是
| A.蒸馏水 | B.NaCl溶液 | C.NaNO3固体 | D.CuSO4固体 |
Ⅱ.某温度时,气体A、B在5 L密闭容器中反应的物质的量随时间变化的曲线如图2所示。由图中数据分析求:
(4)反应开始至4 min时,A的平均反应速率为
(5)4min时,正、逆反应速率的大小关系为:v(正)
(6)平衡时气体A的体积分数为
您最近一年使用:0次
2 . 下列有关合成氨工业的说法,正确的是
A.根据勒夏特列原理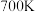 左右比室温更有利于合成氨的反应 左右比室温更有利于合成氨的反应 |
B.由于氨易液化, 在实际生产中可循环使用,所以总体来说合成氨的产率很高 在实际生产中可循环使用,所以总体来说合成氨的产率很高 |
| C.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
D.合成氨采用的压强是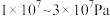 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
您最近一年使用:0次
解题方法
3 . 将浓度均为 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为 。反应分A、B两步进行。
。反应分A、B两步进行。
反应A: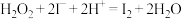 ;
;
反应B:……
(1)反应B的离子方程式是___________ 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的 溶液中加入
溶液中加入 溶液和试剂X,溶液变为蓝色。
溶液和试剂X,溶液变为蓝色。
b.再向得到的蓝色溶液中加入 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。
试剂X是___________ 。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ(溶液浓度均为 )
)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是 ,实验Ⅲ是
,实验Ⅲ是 。
。
①实验Ⅲ中x、y、z,所对应的数值分别是___________ 、___________ 、___________ 。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是___________ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(溶液浓度均为 )
)
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:___________ 。
 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为
 。反应分A、B两步进行。
。反应分A、B两步进行。反应A:
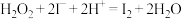 ;
;反应B:……
(1)反应B的离子方程式是
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的
 溶液中加入
溶液中加入 溶液和试剂X,溶液变为蓝色。
溶液和试剂X,溶液变为蓝色。b.再向得到的蓝色溶液中加入
 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。试剂X是
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ(溶液浓度均为
 )
)| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液 (含淀粉) |  |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 |  |  |  |
 ,实验Ⅲ是
,实验Ⅲ是 。
。①实验Ⅲ中x、y、z,所对应的数值分别是
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(溶液浓度均为
 )
)| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液(含淀粉) |  |
| 实脸IV | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:
您最近一年使用:0次
名校
4 . 将浓度均为0.02mol•L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学再室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
(1)反应A的离子方程式是_____ ;对于总反应,I-的作用相当于_____ 。
(2)为证明反应A、B的存在,进行实验I.
实验I:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是_____
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验Ⅱ、实验Ⅲ.
(各溶液浓度均为0.02mol•L-1)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是15min,实验Ⅲ是20min。
①实验Ⅲ中,x、y、z所对应的数值分别是_____ 。
②对比试验Ⅱ、实验Ⅲ,可得出的实验结论是_____ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(各溶液浓度均为0.02mol•L-1)
实验过程中,溶液始终未出现变蓝的现象。试结合该“碘钟实验”总反应方程式,推测反应A与反应B速率的相对快慢关系:_____ 。
资料:该“碘钟实验”的总反应为H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。(1)反应A的离子方程式是
(2)为证明反应A、B的存在,进行实验I.
实验I:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验Ⅱ、实验Ⅲ.
(各溶液浓度均为0.02mol•L-1)
| 用量/mL | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 试剂X溶液 | H2O |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
①实验Ⅲ中,x、y、z所对应的数值分别是
②对比试验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(各溶液浓度均为0.02mol•L-1)
| 用量/mL | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 试剂X溶液 | H2O |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
您最近一年使用:0次
名校
解题方法
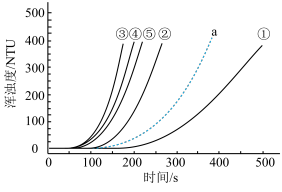
5 . 室温下,用0.1 mol·L-1Na2S2O3溶液、0.1 mol·L-1H2SO4溶液和蒸馏水进行如下表所示的5个实验,分别测量浑浊度随时间的变化。
下列说法不正确 的是
| 编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 浑浊度随时间变化的曲线 |
| V/mL | V/mL | V/mL | ||
| ① | 1.5 | 3.5 | 10 |
|
| ② | 2.5 | 3.5 | 9 | |
| ③ | 3.5 | 3.5 | x | |
| ④ | 3.5 | 2.5 | 9 | |
| ⑤ | 3.5 | 1.5 | 10 |
| A.实验③中x=8 |
| B.实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率 |
| C.将装有实验②的试剂的试管浸泡在热水中一段时间后再混合,其浑浊度曲线应为a |
| D.降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大 |
您最近一年使用:0次
2024-01-23更新
|
144次组卷
|
15卷引用:北京市朝阳区2022-2023学年高二上学期期末考试化学试题
北京市朝阳区2022-2023学年高二上学期期末考试化学试题北京市第二中学2022-2023学年高一下学期期末考试化学试题 北京市第一七一中学2023-2024学年高二上学期10月月考化学试题北京市丰台区2023-2024学年高二上学期期中联考(B卷)化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题河南省实验中学2023-2024学年高二上学期期中考试化学试题北京市第二中学2023-2024学年高二上学期第二学段 段考化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题云南省曲靖市2023-2024学年高二上学期1月期末化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题四川省成都市教育科学研究院附属中学2023-2024学年高二上学期10月月考化学试题北京市第三十五中学2023-2024学年高一下学期(选考)期中测试化学试题
解题方法
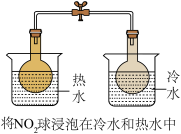
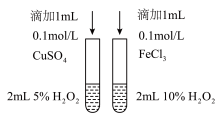
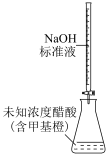
6 . 用下列实验装置可以达到对应实验目的是
|
|
| A.研究温度对化学平衡的影响 | B.比较Cu2+、Fe3+对反应速率的影响 |
|
|
| C.测量盐酸和氢氧化钠反应的反应热 | D.测定醋酸浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 回答下列问题
(1)纯水在 时,
时, ,在此温度下,将
,在此温度下,将 的氢氧化钠溶液
的氢氧化钠溶液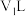 与
与 的硫酸溶液
的硫酸溶液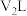 混合(设混合后溶液体积为原两溶液体积之和)所得溶液的
混合(设混合后溶液体积为原两溶液体积之和)所得溶液的 ,则
,则
___________ .
(2)若某溶液中只存在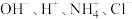 四种离子,且
四种离子,且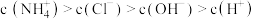 ,该溶液的溶质是
,该溶液的溶质是___________ .
(3)某同学在稀硫酸与锌反应制取氢气的实验中发现加入少量硫酸铜溶液可加快该反应中氢气的生成速率.为了进一步研究所加硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量 粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.
粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.
请完成此实验设计,其中
___________ ,
___________ .
(4)常温下,用 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 .若某次捕捉后得到
.若某次捕捉后得到 的溶液,则溶液中
的溶液,则溶液中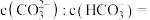
___________ [常温下,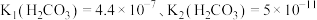 ].
].
(5)常温下,将 的醋酸与
的醋酸与 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在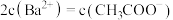 ,则该混合溶液中醋酸的电离常数
,则该混合溶液中醋酸的电离常数
___________ (用含a和b的代数式表示)
(1)纯水在
 时,
时, ,在此温度下,将
,在此温度下,将 的氢氧化钠溶液
的氢氧化钠溶液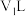 与
与 的硫酸溶液
的硫酸溶液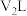 混合(设混合后溶液体积为原两溶液体积之和)所得溶液的
混合(设混合后溶液体积为原两溶液体积之和)所得溶液的 ,则
,则
(2)若某溶液中只存在
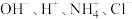 四种离子,且
四种离子,且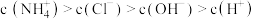 ,该溶液的溶质是
,该溶液的溶质是(3)某同学在稀硫酸与锌反应制取氢气的实验中发现加入少量硫酸铜溶液可加快该反应中氢气的生成速率.为了进一步研究所加硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量
 粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.
粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.混合溶液组成 | A | B | C | D | E | F |
| 30 |
|
|
|
|
|
饱和 | 0 | 0.5 | 2.5 | 5 |
| 20 |
|
|
|
|
| 10 | 0 |

(4)常温下,用
 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 .若某次捕捉后得到
.若某次捕捉后得到 的溶液,则溶液中
的溶液,则溶液中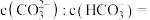
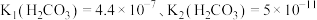 ].
].(5)常温下,将
 的醋酸与
的醋酸与 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在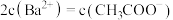 ,则该混合溶液中醋酸的电离常数
,则该混合溶液中醋酸的电离常数
您最近一年使用:0次
名校
8 . 不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示,
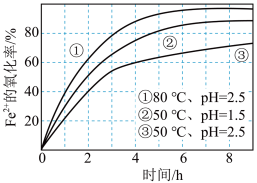
| A.Fe2+的氧化率随时间延长而逐渐增大 |
| B.由②和③可知,pH越大,Fe2+氧化速率不一定越快 |
| C.由①和③可知,温度越高,Fe2+氧化速率越快 |
| D.氧化过程的离子方程式为:4Fe2++O2+2H2O=4Fe3++4OH- |
您最近一年使用:0次
名校
解题方法
9 . 少量铁粉与100mL0.01mol·L-1 的稀盐酸反应,为加快反应速率的同时不改变H2的产量,可能的方法有:①加水②加入NaOH固体③滴入几滴浓盐酸④加入KNO3⑤加入NaCl溶液⑥滴入几滴CuSO4溶液⑦升高温度(忽略浓盐酸挥发)⑧改用10mL 0.1mol·L-1 的稀盐酸,其中可达到目的的是
| A.①④⑥ | B.③⑦⑧ | C.③⑤⑧ | D.②⑦⑧ |
您最近一年使用:0次
名校
10 . 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。下列说法不合理的是
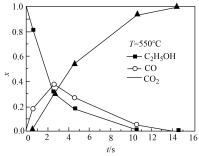



| A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物 |
| B.在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全 |
| C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可用来表示反应的速率,而且两者数值相等 |
D.随温度升高,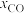 峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大 峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大 |
您最近一年使用:0次


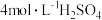 溶液/
溶液/




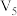
 溶液/
溶液/