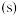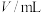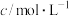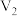名校
1 . 回答下列问题
(1) 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应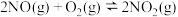 ,
, 随时间的变化如下表:
随时间的变化如下表:
①如图中 点处,
点处, (正)
(正)________  (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。
②图中表示 的变化的曲线是
的变化的曲线是________ 。
③下列不能使该反应的反应速率增大的是________ 。
A.及时分离出 气体 B.适当升高温度
气体 B.适当升高温度
C.增大 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
①通过实验 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验________ (实验序号)可探究出温度变化对化学反应速率的影响。
② 组实验中溶液褪色时间t
组实验中溶液褪色时间t________ (填“<”、“=”或“>”)8s,C组实验的反应速率
________ 。(用含有 的式子表示)
的式子表示)
③同学们在实验中发现反应速率总是如图所示,其中 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②________________ 。
(1)
 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应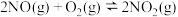 ,
, 随时间的变化如下表:
随时间的变化如下表:时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 点处,
点处, (正)
(正) (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。②图中表示
 的变化的曲线是
的变化的曲线是③下列不能使该反应的反应速率增大的是
A.及时分离出
 气体 B.适当升高温度
气体 B.适当升高温度C.增大
 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂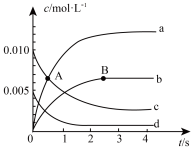
 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
|
|
|
|
| |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 |
| 8 |
C | 313 | 2 | 0.02 |
| 0.1 | 1 | t |
 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验②
 组实验中溶液褪色时间t
组实验中溶液褪色时间t
 的式子表示)
的式子表示)③同学们在实验中发现反应速率总是如图所示,其中
 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②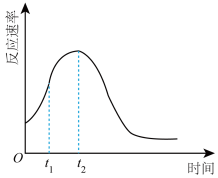
您最近一年使用:0次
名校
解题方法
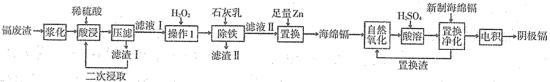
2 . 镉(Cd)是炼锌业的副产品,主要用在电池、染料稳定剂,同时也是重要的污染源,回收再利用以减少排放是重要课题。某冶炼厂的镉废渣中主要含有Cd、CdO,还含有Cu、Zn、Pb、Fe、CuO和SiO2等杂质,从镉废渣中回收镉的一种工艺流程如图所示。
②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)将废渣先“浆化”再“酸浸”的目的是___________ 。
(2)“压滤”所得滤渣I的主要成分是___________ (填化学式);“酸浸”后滤液中还含有微量的Pb2+,其微量存在的主要原因是___________ 。
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是___________ ,若石灰乳加过量,缺陷是___________ 。
(4)将“置换”出来的海绵镉在空气中堆放反复搅拌进行“自然氧化”,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,写出“置换净化”除Pb2+的离子反应方程式___________ 。
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25℃下,部分电对的电极电位如表所示。
根据表中信息和已有知识可知,采用低电流条件“电积”时,阴极主要得到的是镉不是锌的原因___________ 。

②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 离子 |  |  |  |  |  |  |
开始沉淀时( ) ) | 8.2 | 7.8 | 7.5 | 6.7 | 5.2 | 2.2 |
完全沉淀时( ) ) | 9.7 | 9.3 | 9.0 | 8.5 | 6.7 | 3.2 |
(1)将废渣先“浆化”再“酸浸”的目的是
(2)“压滤”所得滤渣I的主要成分是
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是
(4)将“置换”出来的海绵镉在空气中堆放反复搅拌进行“自然氧化”,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,写出“置换净化”除Pb2+的离子反应方程式
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25℃下,部分电对的电极电位如表所示。
| 电对 |  | 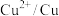 | 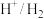 | 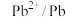 |
| 电极电位/V |  | 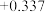 | 0 | 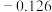 |
| 电对 | 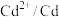 | 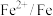 | 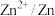 | 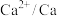 |
| 电极电位/V | 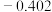 |  | 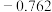 | 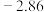 |
您最近一年使用:0次
2024-05-30更新
|
330次组卷
|
4卷引用:2024届辽宁省部分学校高三下学期联考三模化学试题
3 . 室温下,将 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: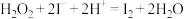 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。
回答下列问题:
(1)反应B的离子方程式是______ 。 的作用为
的作用为______ 。
(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
①实验Ⅰ中,若2s时 的浓度变为
的浓度变为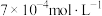 ,则0~2s时
,则0~2s时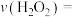
______ 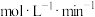
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则
______ ;实验Ⅲ和实验Ⅳ对照实验的目的为______ ;若探究温度对溶液颜色第一次变蓝快慢的影响因素,可选择实验______ 和实验______ (填写“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: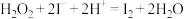 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。回答下列问题:
(1)反应B的离子方程式是
 的作用为
的作用为(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
试剂用量(mL) 序号 | 温度 | 0.01 | 0.01 | 0.01 | 0.01 |
|
Ⅰ | 25℃ | 5 | 4 | 8 | 3 | 0 |
Ⅱ | 25℃ | 5 | 2 | x | y | z |
Ⅲ | 35℃ | 5 | 4 | 8 | 3 | 0 |
Ⅳ | 35℃ | 3 | 4 | 8 | 3 | 2 |
 的浓度变为
的浓度变为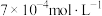 ,则0~2s时
,则0~2s时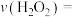
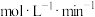
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则

您最近一年使用:0次
2024-05-28更新
|
72次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
名校
4 . 在锌与某浓度的稀盐酸(足量)反应的实验中,得到如下结果:
下列说法中正确的是
① ②
②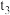 和
和 均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量
均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量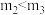 ④若锌均未完全反应,则在相同时间内,产生
④若锌均未完全反应,则在相同时间内,产生 的体积
的体积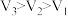
| 序号 | 锌的质量/g | 锌的形式 | 温度/℃ | 锌完全反应所需时间/s | 产生 的体积 的体积 |
| 1 | 2 | 薄片 | 15 | 200 |  |
| 2 | 2 | 粉末 | 15 |  |  |
| 3 | 2 | 粉末 | 35 | 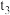 | 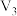 |
①
 ②
②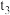 和
和 均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量
均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量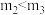 ④若锌均未完全反应,则在相同时间内,产生
④若锌均未完全反应,则在相同时间内,产生 的体积
的体积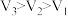
| A.①② | B.①②③ | C.②③④ | D.①②③④ |
您最近一年使用:0次
解题方法
5 . 某课外兴趣小组利用硫代硫酸钠(Na2S2O3)与稀硫酸反应探究影响化学反应速率的因素[反应方程式为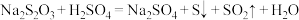 ],设计了如表系列实验。下列说法不正确的是
],设计了如表系列实验。下列说法不正确的是
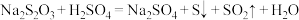 ],设计了如表系列实验。下列说法不正确的是
],设计了如表系列实验。下列说法不正确的是| 实验序号 | 反应温度(℃) | Na2S2O3 | 稀硫酸 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| 1 | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| 2 | 40 | V1 | 0.10 | 10.0 | 0.50 | V2 |
| 3 | 20 | V3 | 0.10 | 4.0 | 0.50 | V4 |
| A.设计该实验的基本原理为控制变量法 |
| B.实验1和2可探究温度对反应速率的影响 |
C.若用实验1和3探究稀硫酸浓度对该反应速率的影响,则需 , , |
| D.本实验可通过比较浑浊现象出现所需时间的长短来判断反应进行的快慢 |
您最近一年使用:0次
6 . 用含铁废铜制备胆矾的流程如图所示,下列说法错误 的是

| A.“溶解”时延长浸泡时间,可以提高铜的浸出速率 |
B.流程中 可用 可用 代替 代替 |
C. 时, 时, |
| D.“系列操作”是指蒸发浓缩,冷却结晶,过滤,洗涤,干燥 |
您最近一年使用:0次
7 . 丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下:
主反应Ⅰ.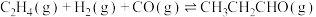

副反应Ⅱ.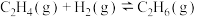

(1)
_____ 0 (填:“>”或“<)。
(2)保持温度不变,在恒容反应器中,按照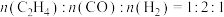 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为______ %,
_____ kPa/min,反应Ⅰ的
_____  。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。
(3)在装有相同催化剂的。相同恒压容器中,按照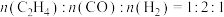 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)_____ v(D)(填“>”、“=”、“<”),产生这一结果的原因可能是______ 。
(4)T℃时,向恒温恒容的甲容器中,通入1mol 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
____  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_____ 。
主反应Ⅰ.
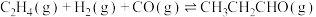

副反应Ⅱ.
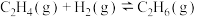


(1)

(2)保持温度不变,在恒容反应器中,按照
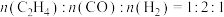 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为

 。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。(3)在装有相同催化剂的。相同恒压容器中,按照
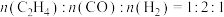 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)(4)T℃时,向恒温恒容的甲容器中,通入1mol
 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
您最近一年使用:0次
8 . 为研究“影响金属与盐酸反应剧烈程度的因素”,某兴趣小组进行如下探究。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出假设】I、可能与金属本身的性质有关:
Ⅱ、可能与盐酸的浓度有关:
Ⅲ、___________ (请你填写一个合理的猜想)。
(2)【实验探究】实验所用金属均已用砂纸打磨。
实验①:为探究猜想I,小李同学分别在两支试管中放入相同质量的锌粒和铁片,然后分别加入同体积同浓度的稀盐酸,观察到放锌粒的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,由此得出结论,金属活动性:Zn>Fe.你认为上述方案是否合理___________ (填“合理”或“不合理”),理由是___________ 。

实验②:为探究猜想Ⅱ,小刘同学利用上列图甲装置进行对照实验,将等质量且过量的锌粒分别与等体积、浓度分别为5%、15%的稀盐酸反应。其中注射器的作用是___________ ,该装置气密性的检查方法是___________ 。(填A或B)
A.打开分液漏斗活塞,拉动注射器活塞一段距离,锥形瓶的水中有气泡产生,说明气密性完好。
B.关闭分液漏斗活塞,推动(或拉动)注射器活塞一段距离,松手后又回到原来位置,说明气密性完好。
实验③:小刘同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的变化关系曲线如图乙所示。请你根据该图中信息写出1条合理结论:___________ 。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出假设】I、可能与金属本身的性质有关:
Ⅱ、可能与盐酸的浓度有关:
Ⅲ、
(2)【实验探究】实验所用金属均已用砂纸打磨。
实验①:为探究猜想I,小李同学分别在两支试管中放入相同质量的锌粒和铁片,然后分别加入同体积同浓度的稀盐酸,观察到放锌粒的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,由此得出结论,金属活动性:Zn>Fe.你认为上述方案是否合理

实验②:为探究猜想Ⅱ,小刘同学利用上列图甲装置进行对照实验,将等质量且过量的锌粒分别与等体积、浓度分别为5%、15%的稀盐酸反应。其中注射器的作用是
A.打开分液漏斗活塞,拉动注射器活塞一段距离,锥形瓶的水中有气泡产生,说明气密性完好。
B.关闭分液漏斗活塞,推动(或拉动)注射器活塞一段距离,松手后又回到原来位置,说明气密性完好。
实验③:小刘同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的变化关系曲线如图乙所示。请你根据该图中信息写出1条合理结论:
您最近一年使用:0次
名校
解题方法
9 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
名校
解题方法
10 . 为了探究温度和浓度对化学反应速率的影响,某同学设计了如下实验:在一张白纸上用黑色记号笔在合适的位置画上三个粗细、深浅一致的“十”字,分别在“十”字上放锥形瓶;按照表格中的试剂和条件进行反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,随着反应的进行,锥形瓶底部的“十”字会被遮盖。下列说法错误的是
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 硫酸 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| Ⅰ | 20 | 10.0 | 0.10 | 10.0 | 0.10 | 0 |
| Ⅱ | 20 | 5.0 | 0.10 | 10.0 | 0.10 | V1 |
| Ⅲ | 40 | 10.0 | 0.10 | 10.0 | 0.10 | V2 |
| A.V1=0,V2=5.0 |
| B.实验还需要秒表,用于测定锥形瓶底部的“十”字完全被遮盖所需的时间 |
C.锥形瓶内发生反应的离子方程式 +2H+= SO2↑+S↓+H2O +2H+= SO2↑+S↓+H2O |
| D.进行实验Ⅲ时,应分别将Na2S2O3溶液和硫酸加热至40℃,然后在锥形瓶内混合 |
您最近一年使用:0次