河北省石家庄市第十五中学2023-2024学年高一下学期期中考试化学试题
河北
高一
期中
2024-05-11
186次
整体难度:
容易
考查范围:
常见无机物及其应用、化学反应原理、认识化学科学、物质结构与性质、化学与STSE、化学实验基础
河北省石家庄市第十五中学2023-2024学年高一下学期期中考试化学试题
河北
高一
期中
2024-05-11
186次
整体难度:
容易
考查范围:
常见无机物及其应用、化学反应原理、认识化学科学、物质结构与性质、化学与STSE、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
1. 中华文明是革故鼎新,辉光日新的文明,静水深流与波澜壮阔交织。下列说法错误的是
| A.鹳鱼石斧图彩绘陶缸是以黏土为主要原料,经高温烧结而成的 |
| B.镶金兽首玛瑙杯的材质是极其稀有的缠丝玛瑙,玛瑙的主要成分为SiO2 |
| C.“天街小雨润如酥,草伍谣看近却无”,pH<5.6的雨水为酸雨,会对植物造成巨大危害 |
| D.5G-A技术闪耀世界,光导纤维的主要成分为高纯硅 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
2. 为了更好地利用化学反应中的物质和能量变化,研究化学反应的快慢和程度具有重要的意义。下列说法正确的是
| A.冰融化成水不属于吸热反应 |
| B.原电池是电能转化为化学能的装置 |
| C.化学反应速率快的反应一定不是可逆反应 |
| D.温度升高,吸热反应的反应速率会减小 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
3. 火腿是一种营养丰富的食品,浙江金华、江苏如皋、江西安福、云南宣威等地出产的火腿赫赫有名,火腿中含盐类物质、水、氨基酸和脂肪等。下列说法错误的是
A.H2O分子的结构模型为 |
B.NaCl的电子式为 |
| C.制作火腿时会适量添加NaNO2,NaNO2是含有共价键的离子化合物 |
| D.火腿存放时,在封口处涂上植物油的目的可能是隔绝空气,减缓腐败速率 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
4. 氮化铝(AlN)陶瓷具有耐腐蚀、耐高温的优点,一种制备氮化铝的方法为将氧化铝高能球磨至纳米级,然后与炭粉混合后通入氮气,发生反应:Al2O3+3C+N2 2AlN+3CO。设NA为阿伏加德罗常数的值,下列说法错误的是
2AlN+3CO。设NA为阿伏加德罗常数的值,下列说法错误的是
 2AlN+3CO。设NA为阿伏加德罗常数的值,下列说法错误的是
2AlN+3CO。设NA为阿伏加德罗常数的值,下列说法错误的是| A.AlN为新型无机非金属材料 |
| B.反应中每生成4.1gAlN,转移电子数为0.6NA |
| C.上述反应属于固氮反应 |
| D.纳米级Al2O3粉末分散在空气中能形成气溶胶 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
5. 2023年,农业绿色发展步伐加快,农业生态环境持续改善。下列说法正确的是
| A.铵盐、硝酸因含有N元素,在农业上常作化肥使用 |
| B.“雷雨发庄稼”,N2与O2在放电的条件下一步转化为NO2,NO2再经过一系列转化生成硝酸盐 |
| C.胆矾和石灰乳混合可制成农药波尔多液,胆矾的化学式为CuSO4·5H2O |
| D.农村常用木柴作燃料做饭,木柴属于化石燃料 |
【知识点】 氮气 硝酸 硫酸盐 绿色化学与可持续发展解读
您最近一年使用:0次
单选题
|
容易(0.94)
名校
解题方法
6. 锌锰干电池的历史悠久,其结构如图所示。下列说法错误的是

| A.锌锰干电池属于一次电池 | B.电池工作时,锌筒为正极 |
| C.电池工作时,石墨棒不会变细 | D.电池工作时,MnO2发生还原反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 常温下,往烧杯中加入10mL1mol/LFeCl3溶液和10mL2mol/LKI溶液,c(I-)随时间变化如图所示,不考虑溶液混合时体积的改变。下列说法正确的是
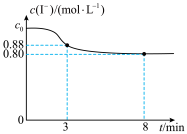
| A.c0=2 |
| B.3~8min内,Fe3+的平均反应速率为0.08mol/(L·min) |
| C.8min时,往烧杯中滴加KSCN溶液,溶液不变红 |
D.烧杯中发生反应的离子方程式为2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
8. 为了探究温度和浓度对化学反应速率的影响,某同学设计了如下实验:在一张白纸上用黑色记号笔在合适的位置画上三个粗细、深浅一致的“十”字,分别在“十”字上放锥形瓶;按照表格中的试剂和条件进行反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,随着反应的进行,锥形瓶底部的“十”字会被遮盖。下列说法错误的是
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 硫酸 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| Ⅰ | 20 | 10.0 | 0.10 | 10.0 | 0.10 | 0 |
| Ⅱ | 20 | 5.0 | 0.10 | 10.0 | 0.10 | V1 |
| Ⅲ | 40 | 10.0 | 0.10 | 10.0 | 0.10 | V2 |
| A.V1=0,V2=5.0 |
| B.实验还需要秒表,用于测定锥形瓶底部的“十”字完全被遮盖所需的时间 |
C.锥形瓶内发生反应的离子方程式 +2H+= SO2↑+S↓+H2O +2H+= SO2↑+S↓+H2O |
| D.进行实验Ⅲ时,应分别将Na2S2O3溶液和硫酸加热至40℃,然后在锥形瓶内混合 |
您最近一年使用:0次
9. 下列由实验操作及现象得出的结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向某红色溶液中通入SO2,溶液褪色 | 原溶液中含有酚酞 |
| B | 常温下某金属遇浓硝酸,迅速产生大量红棕色气体 | 该物质可能为铁 |
| C | 向某溶液中加入NaOH溶液并加热,能产生使湿润的红色石蕊试纸变蓝的气体 | 原溶液中含有 |
| D | 向某钠盐溶液中加入足量稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该盐一定是Na2CO3、NaHCO3中的一种 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
10. X、Y、Z、W、R是短周期原子序数依次增大的五种主族元素,X是宇宙中含量最多的元素,Y、Z、W同周期且相邻,Y的原子序数等于W原子的最外层电子数。X、Y、Z、W、R组成的M是一种温和的还原剂,其结构如图所示。下列说法正确的是
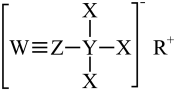
| A.简单离子半径:R>W |
| B.最高价氧化物对应水化物的酸性:W>Z |
| C.最简单氢化物的沸点:Z>W |
| D.M属于共价化合物 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
11. 某同学利用如图所示装置(夹持装置已省略)在通风橱内进行铜与稀硝酸反应的探究实验,下列说法错误的是
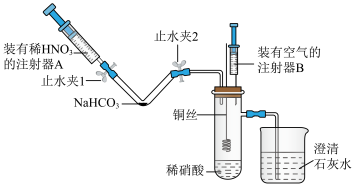
| A.注射器A中的稀硝酸与NaHCO3反应体现了硝酸的酸性 |
| B.当观察到澄清石灰水变浑浊后关闭止水夹1、2,将铜丝伸入稀硝酸中,观察到铜丝溶解,有无色气体产生 |
| C.铜与稀硝酸反应后,将注射器B中的空气注入具支试管,试管内气体会变成红棕色 |
| D.澄清石灰水可吸收挥发出来的NO,同时防止外界空气进入具支试管中干扰实验 |
您最近一年使用:0次
7日内更新
|
195次组卷
|
4卷引用:河北省石家庄市第十五中学2023-2024学年高一下学期期中考试化学试题
河北省石家庄市第十五中学2023-2024学年高一下学期期中考试化学试题(已下线)猜想03 气体的制取、无机实验探究、无机综合应用(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)清单02 氮及其化合物的性质 无机非金属材料(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)高一化学下学期期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
单选题
|
较易(0.85)
名校
12. 往溶液c中单独通入气体a或气体b,无沉淀产生,二者同时通入则会有沉淀产生,下列符合该实验现象的药品组合是

| 选项 | 气体a | 气体b | 溶液c |
| A | CO2 | NO | AlCl3溶液 |
| B | SO2 | NO2 | BaCl2溶液 |
| C | CO2 | SO2 | CaCl2溶液 |
| D | NO | O2 | CuSO4溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
13. 《加快推动建筑领域节能降碳工作方案》的公布,对实现碳达峰碳中和、推动高质量发展意义重大。一种Zn-CO2电池的结构如图所示,工作时,H2O在双极膜界内解离成H+和OH-。下列说法错误的是
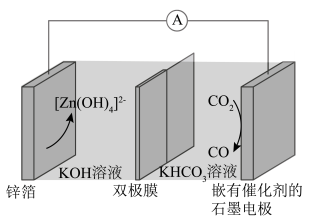
| A.双极膜中产生的H+移向石墨电极 |
| B.锌箔上发生的电极反应为Zn-2e-+4OH-=[Zn(OH)4]2- |
C.正极上的电极反应式为3CO2+2e-+H2O=2 +CO+2H+ +CO+2H+ |
| D.当外电路中转移0.2mole-时,锌箔质量减少6.5g |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
14. T℃时,某化学兴趣小组将1.0mL0.015mol/LKMnO4和1.5mol/LH2SO4的混合溶液与1.0mL0.15mol/L乙醛(CH3CHO)溶液混合后,得到c( )随时间变化的关系如图,已知反应原理为
)随时间变化的关系如图,已知反应原理为 +CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
+CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
 )随时间变化的关系如图,已知反应原理为
)随时间变化的关系如图,已知反应原理为 +CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
+CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
| A.可用浓盐酸和KMnO4配制成酸性KMnO4溶液 |
B.30.0~50.0s内, 的平均速率为0.54mol/(L·h) 的平均速率为0.54mol/(L·h) |
| C.0~30s的平均反应速率大于30~50s的原因是0~30s内生成物的浓度更小 |
D.该实验中反应的离子方程式为2 +5CH3CHO+6H+=2Mn2++5CH3COOH+3H2O +5CH3CHO+6H+=2Mn2++5CH3COOH+3H2O |
您最近一年使用:0次
二、解答题 添加题型下试题
15. 某化学兴趣小组在教师的指导下,利用如图所示装置(夹持和加热装置已省略)和试剂进行NH3的制备及性质探究的一体化实验。请回答下列问题:___________ ;乙处瓶内观察到的现象为___________ ;丙处烧杯中的试剂为稀硫酸,丙处球形干燥管的作用是___________ 。
(2)一段时间后关闭K1,打开K2,丁处瓶内发生反应的离子方程式为___________ ;继续反应一段时间后,关闭K2、K4,打开K3,挤压胶头滴管,己处圆底烧瓶内能观察到的现象为___________ 。
(3)甲装置可以用如图所示装置代替,试剂a可选择___________ (填试剂名称)。氨的催化氧化是工业制硝酸的基础,氨与氧气在催化剂作用下发生反应生成氮的氧化物时,氧化剂和还原剂的物质的量之比为___________ 。
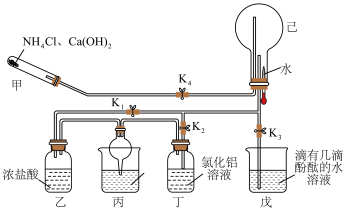
(2)一段时间后关闭K1,打开K2,丁处瓶内发生反应的离子方程式为
(3)甲装置可以用如图所示装置代替,试剂a可选择
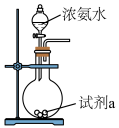
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
解题方法
16. 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
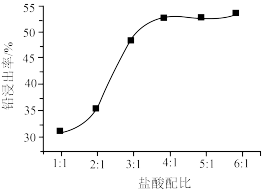
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
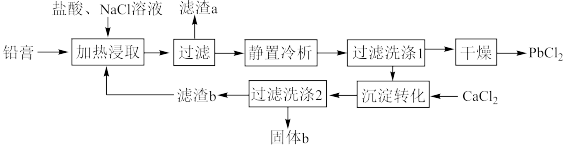
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
17. 甲烷是重要的燃料和化工原料,一种利用CO2制备CH4的反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:___________ ;5~10min内,用H2O(g)表示的平均反应速率v(H2O)=___________ mol/(L·min);下列措施能加快上述反应的正反应速率的是___________ (填标号)。
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是___________ (填标号);反应达到平衡时,H2的转化率为___________ ,平衡时的压强与初始压强的比值为___________ (填最简整数比)。
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
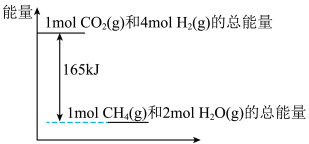
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗___________ L(换算成标准状况下)H2,生成___________ gCH4。
 CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题: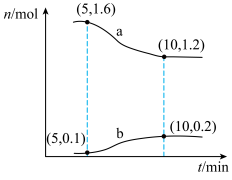
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗
您最近一年使用:0次
解答题-实验探究题
|
较易(0.85)
名校
解题方法
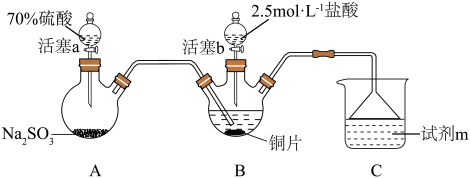
18. 某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应:
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为___________ ,该反应中硫酸体现出的化学性质为___________ ;装置C的作用是___________ ,试剂m可选择___________ (填标号)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为___________ ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2-⇌CuCl↓+2Cl-,下列有关该反应的说法正确的是___________ (填标号)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
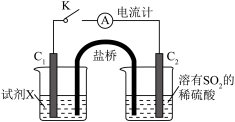
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为___________ ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02mole-时,左侧烧杯溶液中Cu2+的质量减少___________ g。
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为
| 实验装置图 |
| ||
| 序号 | 试剂X | 实验现象 | |
| 电流计 | C1附近溶液 | ||
| ① | 0.1mol·L-1CuSO4溶液 | 指针几乎不偏转 | 无明显现象 |
| ② | 0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(足量) | 指针明显偏转 | 溶液变棕黄色 |
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学反应原理、认识化学科学、物质结构与性质、化学与STSE、化学实验基础
试卷题型(共 18题)
题型
数量
单选题
14
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 硫的氧化物对人体、环境的危害 酸雨 二氧化硅的用途 含硅的无机非金属材料 | |
| 2 | 0.65 | 常见能量转化形式 可逆反应及反应限度 原电池原理理解 | |
| 3 | 0.85 | 有机物的结构式、结构简式、比例模型、球棍模型、最简式 电子式的书写与判断 影响化学反应速率的外因 化学键与物质类别关系的判断 | |
| 4 | 0.85 | 胶体的定义及分类 氧化还原反应与NA相关推算 自然界氮的固定 新型无机非金属材料 | |
| 5 | 0.85 | 氮气 硝酸 硫酸盐 绿色化学与可持续发展 | |
| 6 | 0.94 | 原电池原理 原电池原理理解 原电池正负极判断 原电池电极反应式书写 | |
| 7 | 0.65 | 氧化还原反应的规律 Fe3+的检验 化学反应速率计算 可逆反应及反应限度 | |
| 8 | 0.65 | 浓度对化学反应速率的影响 温度对化学反应速率的影响 外因对化学反应速率影响的综合分析 | |
| 9 | 0.65 | 铵根离子的检验 二氧化硫的化学性质 常见阴离子的检验 | |
| 10 | 0.65 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据原子结构进行元素种类推断 离子化合物的结构及形成过程 | |
| 11 | 0.65 | 硝酸 一氧化氮的化学性质 二氧化氮的物理性质 铜与强氧化性酸的反应 | |
| 12 | 0.85 | 离子反应的发生条件 硝酸的强氧化性 二氧化硫的化学性质 | |
| 13 | 0.65 | 原电池原理理解 原电池正负极判断 原电池电极反应式书写 原电池有关计算 | |
| 14 | 0.65 | 氧化还原反应方程式的书写与配平 化学反应速率计算 浓度对化学反应速率的影响 | |
| 二、解答题 | |||
| 15 | 0.65 | 氨气的实验室制法 物质性质的探究 物质性质实验方案的设计 综合实验设计与评价 | 实验探究题 |
| 16 | 0.65 | 氧化还原反应方程式的书写与配平 硫酸根离子的检验 铅蓄电池 物质分离、提纯综合应用 | 工业流程题 |
| 17 | 0.65 | 化学反应热的计算 化学反应速率计算 化学平衡图像分析 化学平衡状态的判断方法 | 原理综合题 |
| 18 | 0.85 | 氧化还原反应方程式的书写与配平 二氧化硫的制备 原电池电极反应式书写 物质性质的探究 | 实验探究题 |