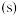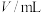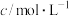名校
1 . 回答下列问题
(1) 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 随时间的变化如下表:
随时间的变化如下表:
①如图中 点处,
点处, (正)
(正)________  (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。
②图中表示 的变化的曲线是
的变化的曲线是________ 。
③下列不能使该反应的反应速率增大的是________ 。
A.及时分离出 气体 B.适当升高温度
气体 B.适当升高温度
C.增大 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
①通过实验 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验________ (实验序号)可探究出温度变化对化学反应速率的影响。
② 组实验中溶液褪色时间t
组实验中溶液褪色时间t________ (填“<”、“=”或“>”)8s,C组实验的反应速率
________ 。(用含有 的式子表示)
的式子表示)
③同学们在实验中发现反应速率总是如图所示,其中 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②________________ 。
(1)
 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 随时间的变化如下表:
随时间的变化如下表:时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 点处,
点处, (正)
(正) (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。②图中表示
 的变化的曲线是
的变化的曲线是③下列不能使该反应的反应速率增大的是
A.及时分离出
 气体 B.适当升高温度
气体 B.适当升高温度C.增大
 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂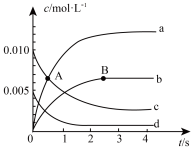
 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
|
|
|
|
| |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 |
| 8 |
C | 313 | 2 | 0.02 |
| 0.1 | 1 | t |
 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验②
 组实验中溶液褪色时间t
组实验中溶液褪色时间t
 的式子表示)
的式子表示)③同学们在实验中发现反应速率总是如图所示,其中
 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②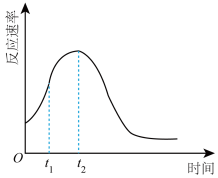
您最近一年使用:0次
解题方法
2 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:___________ 。
(2)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________ 。
(3)用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2NO +H2O 、2NO2+2OH−=NO
+H2O 、2NO2+2OH−=NO +NO
+NO +H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
+H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(4)用NaClO溶液吸收。其他条件同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)在有氧条件下,新型催化剂M能催化NH3与NOx生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图-2)。反应相同时间,NOx的去除率随反应温度的变化曲线如图-3所示,在50~250 ℃内随温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___________ ;当反应温度高于380 ℃时,NOx转化率下降,除因为催化剂活性下降、进入反应器的NOx被还原的量减少外,还有___________ (用化学方程式表示)。
(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(2)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(3)用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2NO
 +H2O 、2NO2+2OH−=NO
+H2O 、2NO2+2OH−=NO +NO
+NO +H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
+H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(4)用NaClO溶液吸收。其他条件同,NO转化为NO
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)在有氧条件下,新型催化剂M能催化NH3与NOx生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图-2)。反应相同时间,NOx的去除率随反应温度的变化曲线如图-3所示,在50~250 ℃内随温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是

您最近一年使用:0次
名校
3 . 回答下列问题
(1)铁丝和铜丝缠绕在一起放入浓硝酸中,一段时间后有气体冒出,此时负极反应的电极方程式为_______ 。
(2)如图所示,某种氢氧燃料电池工作时A极上发生的电极反应为: ,B极发生
,B极发生_______ (填“氧化”或“还原”)反应,电子从该极_______ (填“流入”或“流出”),电极反应式为_______ 。
_______ ,实验②与实验①相比产生的相同体积气体,所需时间不同的原因是_______ ,温度不同的原因是_______ 。
(1)铁丝和铜丝缠绕在一起放入浓硝酸中,一段时间后有气体冒出,此时负极反应的电极方程式为
(2)如图所示,某种氢氧燃料电池工作时A极上发生的电极反应为:
 ,B极发生
,B极发生
| 时间/min | 实验① | 实验② | ||
| 气体体积/mL | 溶液温度/℃ | 气体体积/mL | 溶液温度/℃ | |
| 0 | 0 | 22.0 | 0 | 22.0 |
| 8.5 | 30 | 24.8 | 50 | 23.8 |
| 10.5 | 30 | 26.0 | — | — |

您最近一年使用:0次
4 . 化学反应速率与限度和生产、生活密切相关。回答下列问题:
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(表中氢气体积为累计值,假设溶液体积不变):
①哪一时间段(指0~1min,1~2min,2~3min,3~4min或4~5min)平均反应速率最慢?___________ 。
②另一学生也做同样的实验,为加快生成 的速率且不影响产生氢气的量,他欲在上述稀盐酸中加入少量下列试剂,你认为可行的是
的速率且不影响产生氢气的量,他欲在上述稀盐酸中加入少量下列试剂,你认为可行的是___________ (填字母)。
A.NaCl溶液 B. 固体 C.
固体 C. 溶液 D.通入HCl气体
溶液 D.通入HCl气体
(2)某小组利用 溶液和酸性
溶液和酸性 溶液反应来探究“不同条件对化学反应速率的影响”。方案如下:
溶液反应来探究“不同条件对化学反应速率的影响”。方案如下:
①已知反应后 转化为
转化为 逸出,
逸出, 溶液转化为
溶液转化为 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为___________ 。
②通过实验1、2,可探究___________ 的改变对化学反应速率的影响,其中
___________ 。
③实验___________ (填实验编号)研究温度对反应速率的影响,所得结论为___________ 。
④实验2和3起初反应均很慢,过了一会儿速率突然增大,原因可能是___________ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(表中氢气体积为累计值,假设溶液体积不变):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
②另一学生也做同样的实验,为加快生成
 的速率且不影响产生氢气的量,他欲在上述稀盐酸中加入少量下列试剂,你认为可行的是
的速率且不影响产生氢气的量,他欲在上述稀盐酸中加入少量下列试剂,你认为可行的是A.NaCl溶液 B.
 固体 C.
固体 C. 溶液 D.通入HCl气体
溶液 D.通入HCl气体(2)某小组利用
 溶液和酸性
溶液和酸性 溶液反应来探究“不同条件对化学反应速率的影响”。方案如下:
溶液反应来探究“不同条件对化学反应速率的影响”。方案如下:| 实验编号 | 温度/℃ | 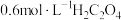 溶液的体积/mL 溶液的体积/mL |  的体积/mL 的体积/mL | 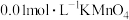 溶液的体积/mL 溶液的体积/mL |  稀 稀 溶液的体积/mL 溶液的体积/mL | 溶液颜色褪至无色所需时间/min |
| 1 | 25 | 3.0 |  | 3.0 | 2.0 | 4.0 |
| 2 | 25 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 25 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
| 4 | 50 | 2.0 | 3.0 | 3.0 | 2.0 | 3.8 |
 转化为
转化为 逸出,
逸出, 溶液转化为
溶液转化为 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为②通过实验1、2,可探究

③实验
④实验2和3起初反应均很慢,过了一会儿速率突然增大,原因可能是
您最近一年使用:0次
解题方法
5 . 回答下列问题:
(1)将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如下图所示: 速度变化的主要原因
速度变化的主要原因______________ 。
② 速度变化的主要原因是
速度变化的主要原因是_____________ 。
(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是____________ ;配制完毕后要加入少量铁屑,其目的是______________ 。
(1)将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如下图所示:
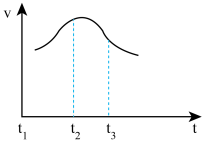
 速度变化的主要原因
速度变化的主要原因②
 速度变化的主要原因是
速度变化的主要原因是(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是
您最近一年使用:0次
名校
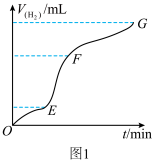
6 . I.用一定质量的Zn跟足量的稀硫酸反应制氢气,请回答:
(1)实验过程如图1所示,EF段化学反应速率加快与该反应是___________ (填“放热”或“吸热”)反应有关。
Ⅱ.某温度时,气体A、B在5 L密闭容器中反应的物质的量随时间变化的曲线如图2所示。由图中数据分析求:___________ 。
(4)反应开始至4 min时,A的平均反应速率为___________ 。
(5)4min时,正、逆反应速率的大小关系为:v(正)___________ v(逆) (填“>”、“<”或“=”)。
(6)平衡时气体A的体积分数为___________ 。
(1)实验过程如图1所示,EF段化学反应速率加快与该反应是
| A.蒸馏水 | B.NaCl溶液 | C.NaNO3固体 | D.CuSO4固体 |
Ⅱ.某温度时,气体A、B在5 L密闭容器中反应的物质的量随时间变化的曲线如图2所示。由图中数据分析求:
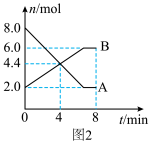
(4)反应开始至4 min时,A的平均反应速率为
(5)4min时,正、逆反应速率的大小关系为:v(正)
(6)平衡时气体A的体积分数为
您最近一年使用:0次
名校
解题方法
7 . I.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小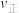
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3) 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(5)①本实验待测数据可以是___________ ,实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响﹔实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响。
②实验发现 比实验
比实验 反应速率快,原因是
反应速率快,原因是___________ 。

 时刻,正逆反应速率大小
时刻,正逆反应速率大小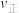
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g |  硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
 | 2.0 | 50.0 | 25 | 0 | 0 |
 | 2.0 | 40.0 | 25 | 0 | 10.0 |
 | 2.0 | 50.0 | 25 | 0.2 | 0 |
 | 2.0 | 50.0 | 35 | 0 | 0 |
(5)①本实验待测数据可以是
 和实验
和实验 可以探究
可以探究 和实验
和实验 可以探究
可以探究②实验发现
 比实验
比实验 反应速率快,原因是
反应速率快,原因是
您最近一年使用:0次
2024-04-28更新
|
334次组卷
|
2卷引用:安徽省合肥市六校联盟2023-2024学年高一下学期4月期中考试化学试题
2024高三下·全国·专题练习
解题方法
8 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。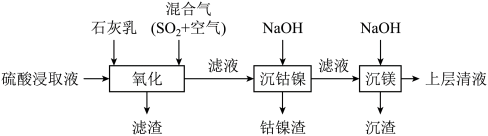
| 物质 |  |  |  |  |
 |  |  |  | 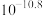 |
(1)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是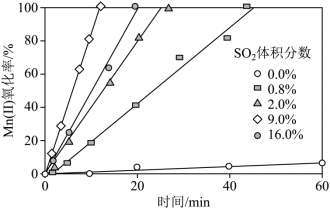
您最近一年使用:0次
解题方法
9 . 小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
(1)写出铝和稀盐酸反应的化学方程式___________ 。
(2)实验②和③表明:该反应快慢与___________ 有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:___________ 和___________ 。
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围___________ 。
| 试验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铝丝消失的时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(2)实验②和③表明:该反应快慢与
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围
您最近一年使用:0次
解题方法
10 . 氧化铁黄(化学式为FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾(FeSO4·7H2O)为原料制备FeOOH。
(1)下列关于铁元素的认识正确的是______。
(2)制备氧化铁黄的关键步骤是FeSO4溶液的氧化。为探究影响氧化FeSO4溶液快慢的因素,现利用FeSO4·7H2O、蒸馏水和稀H2SO4配制四组溶液进行实验,实验结果如下表:
对比实验I和II可知,实验中影响氧化快慢的因素是______ ;
综合对比分析四组实验,简述影响氧化FeSO4溶液快慢的决定因素。______
(1)下列关于铁元素的认识正确的是______。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
| 实验编号 | I | II | III | IV |
| c(FeSO4)/(mol·L-1) | 0.5 | 0.25 | 0.25 | 0.5 |
| 溶液pH | 2.9 | 2.9 | 3.5 | 3.3 |
| 初始颜色 | 浅绿色 | 浅绿色,较I浅 | 浅绿色,同II | 浅绿色,同I |
| 0.5h后颜色 | 浅绿色 | 浅绿色 | 黄绿色 | 浅绿色 |
| 2h后颜色 | 黄绿色 | 浅绿色 | 黄色 | 黄绿色 |
| 5h后颜色 | 浅黄色 | 浅黄色,较I浅 | 黄色,较IV浅 | 黄色 |
综合对比分析四组实验,简述影响氧化FeSO4溶液快慢的决定因素。
您最近一年使用:0次