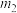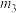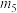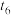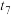名校
1 . 探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+l0CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:
下列说法不正确的是
| 编号 | 温度℃ | 催化剂(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪色平均时间(min) | ||
| 体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
| 2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
| 3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
| 4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
| A.a<12.7,b>6.7 |
| B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢 |
| C.用H2C2O4表示该反应速率,v(实验1)约为6.6×l0-3 mol·L-1·min-1 |
| D.用KMnO4表示该反应速率,v(实验3)>v(实验1) |
您最近一年使用:0次
名校
解题方法
2 . 下列说法不正确的是
| A.将纯铁放入稀硫酸中,反应缓慢,再加入少量硫酸铜溶液,可加快产生氢气的速率 |
| B.稀盐酸跟锌片反应,加入少量的氯化钠溶液,反应速率不变 |
C.反应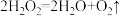 ,加入 ,加入 或升高温度都能加快 或升高温度都能加快 的生成速率 的生成速率 |
D.铁片和稀硫酸反应制取氢气时,改用 的硫酸不可加快产生氢气的速率 的硫酸不可加快产生氢气的速率 |
您最近一年使用:0次
名校
解题方法
3 . I、一定温度时,在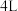 密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:
密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:________________ , 时刻M的转化率为
时刻M的转化率为________________ 。
(2)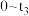 时间内用M表示的化学反应速率为
时间内用M表示的化学反应速率为________  /(
/(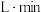 ).
).
(3)下列能表示上述反应达到化学平衡状态的是________(填编号)。
Ⅱ、一定条件下,在容积为 的密闭容器中发生反应:
的密闭容器中发生反应: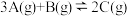 。开始时加入
。开始时加入 、
、 、
、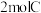 ,在
,在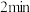 末测得C的物质的量是
末测得C的物质的量是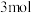 。
。
(4)用B的浓度变化表示反应的平均速率:________________ 。
(5)在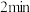 末,A的浓度为
末,A的浓度为________________ 。
(6)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①充入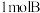 ,化学反应速率
,化学反应速率________________ ;
②将容器的容积变为 ,化学反应速率
,化学反应速率________________ ;
③升高温度,化学反应速率________________ 。
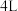 密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:
密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示: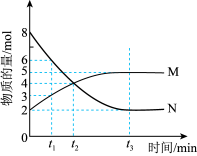
 时刻M的转化率为
时刻M的转化率为(2)
 时间内用M表示的化学反应速率为
时间内用M表示的化学反应速率为 /(
/(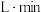 ).
).(3)下列能表示上述反应达到化学平衡状态的是________(填编号)。
A. | B.M与N的物质的量之比保持不变 |
| C.容器中压强保持不变 | D.混合气体密度保持不变 |
Ⅱ、一定条件下,在容积为
 的密闭容器中发生反应:
的密闭容器中发生反应: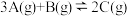 。开始时加入
。开始时加入 、
、 、
、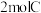 ,在
,在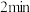 末测得C的物质的量是
末测得C的物质的量是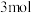 。
。(4)用B的浓度变化表示反应的平均速率:
(5)在
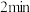 末,A的浓度为
末,A的浓度为(6)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①充入
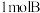 ,化学反应速率
,化学反应速率②将容器的容积变为
 ,化学反应速率
,化学反应速率③升高温度,化学反应速率
您最近一年使用:0次
名校
解题方法
4 . 下列四支试管中,分别盛有等量的锌、酸溶液,其中生成 的反应速率最快的是
的反应速率最快的是
 的反应速率最快的是
的反应速率最快的是试管 | 酸及浓度 | 温度 | 锌的状态 |
① |
|
| 粉末状 |
② |
|
| 粉末状 |
③ |
|
| 粉末状 |
④ |
|
| 大块状 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。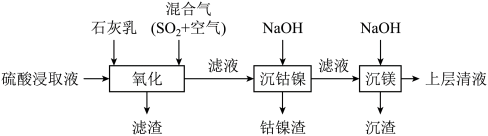
| 物质 |  | 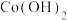 |  |  |
 |  | 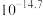 | 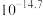 | 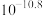 |
(1)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是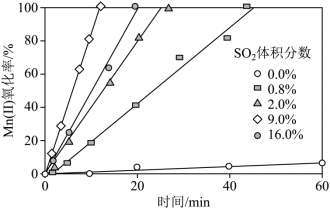
您最近一年使用:0次
6 . 现代社会的一切活动都离不开能源,为了更好的利用化学反应中的物质和能量变化,需要关注化学反应的快慢和程度。
Ⅰ.化学变化过程中均存在物质变化与能量变化,某化学兴趣小组进行如图1所示实验,以验证此结论。请回答下列问题。__________ 生成物成键释放的能量(填“大于”或“小于”);反应②中,反应物的总能量__________ 生成物的总能量(填“大于”或“小于”)。
Ⅱ.某小组利用 溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:
溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:
(2) 和稀硫酸反应的离子方程式为
和稀硫酸反应的离子方程式为__________ 。
(3)用 溶液的浓度变化表示实验b的平均反应速率为
溶液的浓度变化表示实验b的平均反应速率为__________ (忽略混合前后溶液的体积变化)。
(4)通过对比实验a和c,验证稀 的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案
的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案__________ 。
Ⅲ.某同学用等质量的锌粉先后与盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图2所示)。__________  (填“>”“=”或“<”),若用
(填“>”“=”或“<”),若用 硫酸代替上述实验中的
硫酸代替上述实验中的 盐酸,二者的反应速率是否相同?理由是
盐酸,二者的反应速率是否相同?理由是__________ 。
(6)为控制反应速率,防止因反应过快而难以测量 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。
Ⅰ.化学变化过程中均存在物质变化与能量变化,某化学兴趣小组进行如图1所示实验,以验证此结论。请回答下列问题。
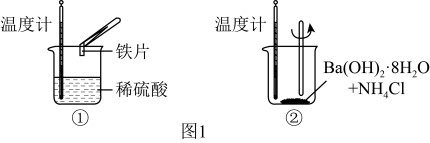
Ⅱ.某小组利用
 溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:
溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:| 实验编号 | T/K |  溶液 溶液 | 稀 溶液 溶液 | 反应完全所用时间/秒 | ||
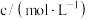 | 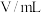 | 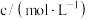 | 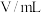 | s | ||
| a | 298 | 0.1 | 10 | 0.2 | 10 | 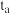 |
| b | 323 | 0.1 | 10 | 0.2 | 10 | 5 |
| c | 298 | 0.1 | 10 | 0.2 | 5 | 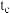 |
(2)
 和稀硫酸反应的离子方程式为
和稀硫酸反应的离子方程式为(3)用
 溶液的浓度变化表示实验b的平均反应速率为
溶液的浓度变化表示实验b的平均反应速率为(4)通过对比实验a和c,验证稀
 的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案
的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案Ⅲ.某同学用等质量的锌粉先后与盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图2所示)。
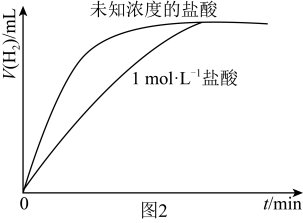
 (填“>”“=”或“<”),若用
(填“>”“=”或“<”),若用 硫酸代替上述实验中的
硫酸代替上述实验中的 盐酸,二者的反应速率是否相同?理由是
盐酸,二者的反应速率是否相同?理由是(6)为控制反应速率,防止因反应过快而难以测量
 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
7 . 工业上利用反应:N2(g) + 3H2(g)⇌2NH3(g)合成氨气。已知在1×105Pa和25℃时,拆开1mol N≡N键和1mol H-H键所需能量分别为946 kJ和436 kJ,生成1molN-H键放出的能量为391kJ。回答下列问题:
(1)根据上述数据判断,在1×105 Pa和25 ℃时,工业合成氨的反应是_______ 反应(填“吸热”或“放热”);每消耗1 molN2,反应放出或吸收的热量Q1为_______ kJ;1 molN2和3 molH2在该条件下反应,达平衡时,放出或吸收的热量为Q2 kJ,则Q2_______ Q1(填“>”“<”或“=”)。
(2)①合成氨反应在恒容密闭容器中进行,达到平衡后,只改变某一条件,下列说法正确的是_______ (填序号)。
a.升高温度,V(正)、V(逆)均增大 b.升高温度,V(正)增大,V(逆)减小
c.充入一定量的氮气,V(正)、V(逆)均增大 d.充入一定量的氩气,V(正)、V(逆)均增大
②下列叙述能说明上述反应已达化学平衡状态的是_______ (填序号)。
a.V正(N2)=V逆(NH3) b.n(N2)∶n(H2)∶n(NH3)=1∶3∶2
c.容器中气体的密度不随时间而变化 d.容器中气体的平均相对分子质量不随时间而变化
(3)一定温度下,将1 mol N2和3 mol H2置于1L的恒容密闭容器中反应,测得不同温度(T)、不同时间段内,容器中NH3的物质的量数据如下:
表中x、y的大小关系为x_______ y。(填“>”“<”“=”“≥”或“≤”)。
(1)根据上述数据判断,在1×105 Pa和25 ℃时,工业合成氨的反应是
(2)①合成氨反应在恒容密闭容器中进行,达到平衡后,只改变某一条件,下列说法正确的是
a.升高温度,V(正)、V(逆)均增大 b.升高温度,V(正)增大,V(逆)减小
c.充入一定量的氮气,V(正)、V(逆)均增大 d.充入一定量的氩气,V(正)、V(逆)均增大
②下列叙述能说明上述反应已达化学平衡状态的是
a.V正(N2)=V逆(NH3) b.n(N2)∶n(H2)∶n(NH3)=1∶3∶2
c.容器中气体的密度不随时间而变化 d.容器中气体的平均相对分子质量不随时间而变化
(3)一定温度下,将1 mol N2和3 mol H2置于1L的恒容密闭容器中反应,测得不同温度(T)、不同时间段内,容器中NH3的物质的量数据如下:
| 1小时 | 2小时 | 3小时 | 4小时 | |
| T3 | 0.38 mol | 0.49 mol | 0.56 mol | 0.56 mol |
| T4 | 0.42 mol | 0.51 mol | x mol | y mol |
您最近一年使用:0次
8 . 下列有关合成氨工业的说法,正确的是
A.根据勒夏特列原理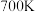 左右比室温更有利于合成氨的反应 左右比室温更有利于合成氨的反应 |
B.由于氨易液化,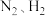 在实际生产中可循环使用,所以总体来说合成氨的产率很高 在实际生产中可循环使用,所以总体来说合成氨的产率很高 |
| C.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
D.合成氨采用的压强是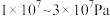 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
您最近一年使用:0次
解题方法
9 . Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明______ 对反应速率有影响。
(2)我们最好选取实验______ (填3个实验序号)研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的______ 反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______ 。
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:______ 。
(5)分析有关数据,写出X、Y、Z的反应方程式______ 。
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 |
|
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 |
|
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 |
|
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 |
|
6 | 50.0 | 8.0 | 粉末 | 25 |
| 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 |
| 16.1 |
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明
(2)我们最好选取实验
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
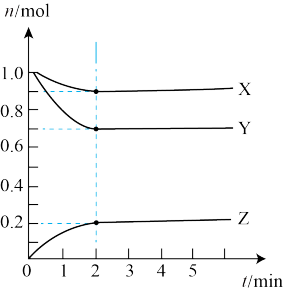
(5)分析有关数据,写出X、Y、Z的反应方程式
您最近一年使用:0次
名校
解题方法
10 . 合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如图:(图中ad表示物质吸附在催化剂表面时的状态) 2NH3(g)的△H=
2NH3(g)的△H=______ kJ•mol-1,对总反应速率影响较大的是步骤_______ 。(填写编号)
(2)若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______ 。
(3)下列关于硫酸工业和合成氨工业说法错误的是_______ 。
合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。_______ mol•L-1•min-1。
(5)由图可判断该反应是_______ (选填“吸热”或“放热”)反应,在______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(6)判断图中n1、n2相对大小:n1______ n2。(选填“<”或“>”)
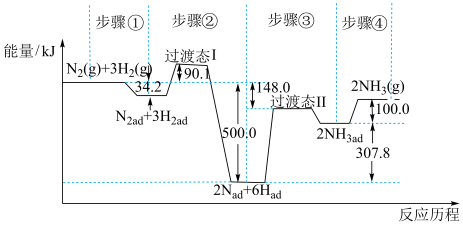
 2NH3(g)的△H=
2NH3(g)的△H=(2)若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
| A.升高温度,使单位体积内活化分子百分数增加 |
| B.增加反应物的浓度,使活化分子百分数增加 |
| C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加 |
| D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加 |
(3)下列关于硫酸工业和合成氨工业说法错误的是
| A.都采用了高压 | B.都使用了催化剂 |
| C.生产流程中都有造气和净化 | D.都使用了热交换器 |
合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。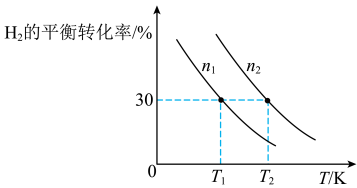
(5)由图可判断该反应是
(6)判断图中n1、n2相对大小:n1
您最近一年使用:0次

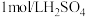 溶液
溶液
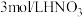 溶液
溶液
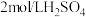 溶液
溶液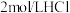 溶液
溶液