名校
解题方法
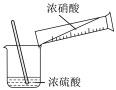
1 . 溴苯是一种化工原料,纯净溴苯是一种无色液体,某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应后的产物。请回答下列问题:
(1)装置中冷凝管除导气外,还有___________ 的作用,冷凝水从___________ (填“a”或“b”)口进入。
(2)实验开始时,关闭 ,打开
,打开 和滴液漏斗活塞,滴加
和滴液漏斗活塞,滴加 苯和
苯和 液溴的混合液,反应开始。写出装置II发生的主要有机反应的化学方程式
液溴的混合液,反应开始。写出装置II发生的主要有机反应的化学方程式___________ ,反应类型___________ ,装置III中能说明苯与液溴发生的是此反应类型的现象是___________ 。III中小试管内苯的作用是___________ 。
(3)三颈烧瓶内反应后液体呈棕黄色,进行下列实验操作就可得到较纯净的溴苯,正确实验操作顺序是(操作步骤必要时可重复):___________ 。
①用 的
的 溶液洗涤,振荡,分液;
溶液洗涤,振荡,分液;
②通过过滤、蒸馏,可得到无色、较纯净的溴苯 ;
;
③用蒸馏水洗涤,振荡,分液;
④加入无水 粉末干燥
粉末干燥
(4)下列关于苯和溴苯的说法正确的是___________(填字母)。
(5)本实验的产率为___________ (精确到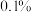 )。
)。

| 苯 | 溴 | 溴苯 | |
密度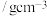 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
| 相对分子量 | 78 | 160 | 157 |
(1)装置中冷凝管除导气外,还有
(2)实验开始时,关闭
 ,打开
,打开 和滴液漏斗活塞,滴加
和滴液漏斗活塞,滴加 苯和
苯和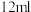 液溴的混合液,反应开始。写出装置II发生的主要有机反应的化学方程式
液溴的混合液,反应开始。写出装置II发生的主要有机反应的化学方程式(3)三颈烧瓶内反应后液体呈棕黄色,进行下列实验操作就可得到较纯净的溴苯,正确实验操作顺序是(操作步骤必要时可重复):
①用
 的
的 溶液洗涤,振荡,分液;
溶液洗涤,振荡,分液;②通过过滤、蒸馏,可得到无色、较纯净的溴苯
 ;
;③用蒸馏水洗涤,振荡,分液;
④加入无水
 粉末干燥
粉末干燥(4)下列关于苯和溴苯的说法正确的是___________(填字母)。
| A.苯是一种密度比水大、不溶于水、有特殊气味的无色液体 |
| B.仅用水即可鉴别苯和溴苯 |
| C.溴苯中苯是官能团 |
| D.溴苯是非电解质 |
(5)本实验的产率为
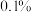 )。
)。
您最近半年使用:0次
名校
解题方法
2 . 用 氧化甲苯制备苯甲酸。实验方法:将甲苯和
氧化甲苯制备苯甲酸。实验方法:将甲苯和 溶液在100℃反应一段时间后停止反应,过滤,将含有苯甲酸钾
溶液在100℃反应一段时间后停止反应,过滤,将含有苯甲酸钾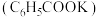 和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。
和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。
 氧化甲苯制备苯甲酸。实验方法:将甲苯和
氧化甲苯制备苯甲酸。实验方法:将甲苯和 溶液在100℃反应一段时间后停止反应,过滤,将含有苯甲酸钾
溶液在100℃反应一段时间后停止反应,过滤,将含有苯甲酸钾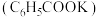 和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。
和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。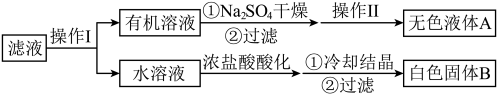
| A.操作I是分液,操作II是蒸馏 |
| B.无色液体A是甲苯,白色固体是B苯甲酸 |
| C.为了得到更多的白色固体B,冷却结晶时温度越低越好 |
D.浓盐酸的作用是:   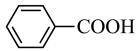  |
您最近半年使用:0次
解题方法
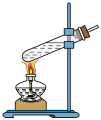
3 . 富马酸亚铁(结构简式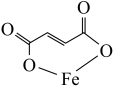 ,刚对分子质量170)是治疗贫血药物的一种。实验制备富马酸亚铁并测其产品中富马酸亚铁的质量分数。
,刚对分子质量170)是治疗贫血药物的一种。实验制备富马酸亚铁并测其产品中富马酸亚铁的质量分数。
Ⅰ.富马酸( )的制备。制取装置如图所示(夹持仪器已略去),按如图装置打开分液漏斗活塞,滴加糠醛(
)的制备。制取装置如图所示(夹持仪器已略去),按如图装置打开分液漏斗活塞,滴加糠醛(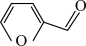 ),在90~100℃条件下层续加热2~3h。
),在90~100℃条件下层续加热2~3h。
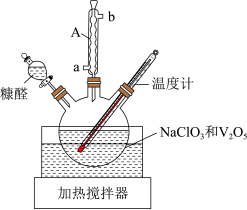
Ⅱ.富马酸亚铁的制备
步骤1:将4.64 g富马酸置于100 mL烧杯中,加水20 mL,在热沸搅拌下加入
 溶液10 mL,使其pH为6.5~6.7;
溶液10 mL,使其pH为6.5~6.7;步骤2:将上述溶液转移至如图所示的装置中,缓慢加入40 mL 2 mol⋅L

 溶液,维持温度100℃,充分搅拌1.5 h;
溶液,维持温度100℃,充分搅拌1.5 h;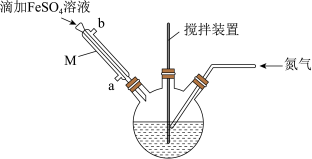
(2)在回流过程中一直通入氮气的目的是
(3)步骤1控制溶液pH为6.5~6.7;若反应后溶液的pH太小;则引起的后果是
Ⅲ.产品纯度测定
步骤①:准确称取粗产品0.1600 g,加煮沸过的3 mol⋅L

 溶液15 mL,待样品完全溶解后,加煮沸过的冷水50 mL和4滴邻二氮菲-亚铁指示剂,立即用0.0500 mol⋅L
溶液15 mL,待样品完全溶解后,加煮沸过的冷水50 mL和4滴邻二氮菲-亚铁指示剂,立即用0.0500 mol⋅L
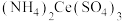 (硫酸高铈铵)标准溶液进行滴定。用去标准液的体积为16.82 mL(反应式为
(硫酸高铈铵)标准溶液进行滴定。用去标准液的体积为16.82 mL(反应式为 ),
),步骤②:不加产品,重复步骤①操作,滴定终点用去标准液0.02 mL。
(4)
(5)产品中富马酸亚铁的质量分数为
您最近半年使用:0次
名校
解题方法
4 . 3-苯基乳酸可作为抗菌剂用于食品、化妆品等行业。实验室制备3-苯基乳酸原理如图,相关物质信息如表格所示。
实验室制备3-苯基乳酸和纯度测量步骤如下:
Ⅰ.将3.30g苯丙氨酸置于容器中,再加入70mL 0.50 硫酸溶液,搅拌使固体溶解。将溶液冷却至5±1℃。
硫酸溶液,搅拌使固体溶解。将溶液冷却至5±1℃。
Ⅱ.边搅拌边滴加 溶液,控制滴加速度使反应体系温度维持在5~7℃。加完后在此温度下继续搅拌50min。
溶液,控制滴加速度使反应体系温度维持在5~7℃。加完后在此温度下继续搅拌50min。
Ⅲ.改用温水浴再搅拌10min,此时容器内温度为20~25℃。得到白色固体。
Ⅳ.加入乙酸乙酯使固体溶解并将反应液转移至分液漏斗,分出水相。向有机相中加入无水 ,过滤,蒸出溶剂,得粗产品。
,过滤,蒸出溶剂,得粗产品。
Ⅴ.用乙酸乙酯溶剂将粗产品重结晶(用水浴加热溶解,再用冰水浴冷却使结晶完全)。过滤,洗涤,干燥得产品1.66g。
Ⅵ.取0.1660g产品,放入锥形瓶中,加入1mL 95%乙醇,再加入25mL蒸馏水,2~3滴酚酞。用0.3000mol/L NaOH标准溶液滴至粉红色,并在30s后不褪色,消耗NaOH V mL。
回答下列问题
(1)下列说法正确的是___________(填字母)。
(2)步骤Ⅱ滴加 溶液要控制在较低温度的原因是
溶液要控制在较低温度的原因是___________ 。
(3)实际实验中,步骤Ⅱ和步骤Ⅲ中分别尽量将体系温度控制在7℃和25℃,原因是___________ 。
(4)第Ⅳ步加入无水 的作用为
的作用为___________ 。
(5)第Ⅴ步重结晶操作及过滤操作中,除溶解用的圆底烧瓶和水浴锅以外,还需要下列仪器中的___________ (填仪器名称)。___________ %(计算结果精确至0.1),产品纯度为___________ (用含V的代数式表示)。

| 物质 | 性状 | 沸点 | 溶解性 | 相对分子质量 |
| 苯丙氨酸 | 白色固体 | 溶于水 | 165 | |
| 3-苯基乳酸 | 白色固体 | 微溶于水,易溶于热的有机溶剂 | 166 | |
| 乙酸乙酯 | 无色液体 | 77℃(易挥发) | ||
 | 白色固体 | 易溶于水,酸性下易受热分解 |
Ⅰ.将3.30g苯丙氨酸置于容器中,再加入70mL 0.50
 硫酸溶液,搅拌使固体溶解。将溶液冷却至5±1℃。
硫酸溶液,搅拌使固体溶解。将溶液冷却至5±1℃。Ⅱ.边搅拌边滴加
 溶液,控制滴加速度使反应体系温度维持在5~7℃。加完后在此温度下继续搅拌50min。
溶液,控制滴加速度使反应体系温度维持在5~7℃。加完后在此温度下继续搅拌50min。Ⅲ.改用温水浴再搅拌10min,此时容器内温度为20~25℃。得到白色固体。
Ⅳ.加入乙酸乙酯使固体溶解并将反应液转移至分液漏斗,分出水相。向有机相中加入无水
 ,过滤,蒸出溶剂,得粗产品。
,过滤,蒸出溶剂,得粗产品。Ⅴ.用乙酸乙酯溶剂将粗产品重结晶(用水浴加热溶解,再用冰水浴冷却使结晶完全)。过滤,洗涤,干燥得产品1.66g。
Ⅵ.取0.1660g产品,放入锥形瓶中,加入1mL 95%乙醇,再加入25mL蒸馏水,2~3滴酚酞。用0.3000mol/L NaOH标准溶液滴至粉红色,并在30s后不褪色,消耗NaOH V mL。
回答下列问题
(1)下列说法正确的是___________(填字母)。
| A.苯丙氨酸含有手性碳原子 |
B.α-重氮乙酸盐中与碳原子相连的N原子杂化方式为 |
C.制备过程中会产生 |
| D.3-苯基乳酸可以发生缩聚反应 |
(2)步骤Ⅱ滴加
 溶液要控制在较低温度的原因是
溶液要控制在较低温度的原因是(3)实际实验中,步骤Ⅱ和步骤Ⅲ中分别尽量将体系温度控制在7℃和25℃,原因是
(4)第Ⅳ步加入无水
 的作用为
的作用为(5)第Ⅴ步重结晶操作及过滤操作中,除溶解用的圆底烧瓶和水浴锅以外,还需要下列仪器中的
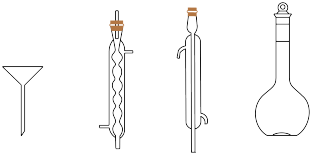
您最近半年使用:0次
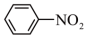
5 . 实验室制备硝基苯(密度 ,不溶于水)时,经过配制混酸、硝化反应(
,不溶于水)时,经过配制混酸、硝化反应( )、洗涤分离、干燥蒸馏等步骤。下列图示装置和原理能达到目的的是
)、洗涤分离、干燥蒸馏等步骤。下列图示装置和原理能达到目的的是
 ,不溶于水)时,经过配制混酸、硝化反应(
,不溶于水)时,经过配制混酸、硝化反应( )、洗涤分离、干燥蒸馏等步骤。下列图示装置和原理能达到目的的是
)、洗涤分离、干燥蒸馏等步骤。下列图示装置和原理能达到目的的是
|
|
| A.配制混酸 | B.硝化反应 |
|
|
| C.分离硝基苯 | D.蒸馏硝基苯 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
6 . 如图是制备乙炔和研究乙炔性质的实验装置图,下列有关说法错误的是
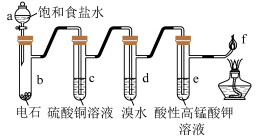
| A.a中用饱和食盐水代替蒸馏水可减缓反应速率 |
B.c中 溶液作用是除去影响后续实验的杂质 溶液作用是除去影响后续实验的杂质 |
| C.d、e溶液褪色原理不同,前者是氧化后者是加成 |
| D.f处产生明亮、伴有浓烟的火焰 |
您最近半年使用:0次
名校
解题方法
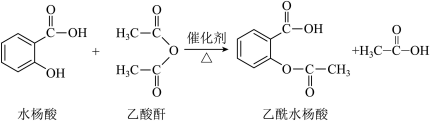
7 . 乙酰水杨酸(阿司匹林)是应用广泛的解热、镇痛和抗炎药,它对肠胃的刺激较小,在体内还具有抗血栓的作用,可用于预防心脑血管疾病,与青霉素、安定并称为“医药史上三大经典药物”。其合成原理如下:
(一)制备过程
①向100mL的三颈烧瓶中依次加入6.9g干燥的水杨酸、8.0mL新蒸的乙酸酐和0.5mL浓硫酸(作催化剂),磁力搅拌下,小心加热,控制温度在70℃左右反应30min。
②稍冷后,将反应液缓慢倒入100mL冰水中冷却15min,用图2装置减压抽滤,将所有产品收集到布氏漏斗中,滤饼用少量冷水多次洗涤,继续抽滤,得到乙酰水杨酸粗品。
(二)提纯过程
③将粗产品转移至100mL圆底烧瓶中,再加入20mL乙酸乙酯,加热溶解,如有不溶物出现,趁热过滤,热滤液置冰箱中冷却至-5℃~0℃,抽滤,洗涤,干燥,得无色晶体乙酰水杨酸,称重得4.50g。
回答下列问题:
(1)图2中“抽滤”操作相对于普通过滤的优点是_______ 。
(2)步骤①中加热操作宜采用_______ ,图1中仪器A的名称为_______ ,A的作用是防止外界的水蒸气进入三颈烧瓶导致发生副反应,降低水杨酸的转化率。写出该副反应的化学方程式_______ 。
(3)步骤②用冷水洗涤后,如何检验阿司匹林中是否还有杂质水杨酸剩余?_______ 。
(4)步骤③的提纯方法是_______ (写操作名称)。
(5)计算乙酰水杨酸(阿司匹林)的产率为_______ 。
| 物质 | 相对分子质量 | 密度/g/cm3 | 熔点/℃ | 其他性质 |
| 水杨酸 | 138 | 1.44 | 157~159 | 溶于乙醇、微溶于水 |
| 乙酸酐 | 102 | 1.08 | -72~-74 | 沸点140℃,无色透明液体,遇水形成乙酸 |
| 阿司匹林 | 180 | 1.35 | 135~138 | 分解温度为128~135℃,溶于乙醇、微溶于水 |
| 乙酸乙酯 | 88 | 0.90 | -87 | 沸点77℃,微溶于水,溶于乙醇等有机溶剂 |

(一)制备过程
①向100mL的三颈烧瓶中依次加入6.9g干燥的水杨酸、8.0mL新蒸的乙酸酐和0.5mL浓硫酸(作催化剂),磁力搅拌下,小心加热,控制温度在70℃左右反应30min。
②稍冷后,将反应液缓慢倒入100mL冰水中冷却15min,用图2装置减压抽滤,将所有产品收集到布氏漏斗中,滤饼用少量冷水多次洗涤,继续抽滤,得到乙酰水杨酸粗品。
(二)提纯过程
③将粗产品转移至100mL圆底烧瓶中,再加入20mL乙酸乙酯,加热溶解,如有不溶物出现,趁热过滤,热滤液置冰箱中冷却至-5℃~0℃,抽滤,洗涤,干燥,得无色晶体乙酰水杨酸,称重得4.50g。
回答下列问题:
(1)图2中“抽滤”操作相对于普通过滤的优点是
(2)步骤①中加热操作宜采用
(3)步骤②用冷水洗涤后,如何检验阿司匹林中是否还有杂质水杨酸剩余?
(4)步骤③的提纯方法是
(5)计算乙酰水杨酸(阿司匹林)的产率为
您最近半年使用:0次
名校
解题方法
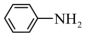
8 . 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。可利用硝基苯制取苯胺,原理如下:
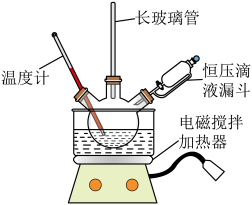
I.制取硝基苯。
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液漏斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。___________ 代替(填仪器名称),图中恒压滴液漏斗侧面橡胶管的作用___________ 。
(2)下列说法中正确的是___________(填序号)。
(3)三颈烧瓶中发生反应的化学方程式___________ 。
(4)提纯产品的过程中需要用5%NaOH溶液洗涤三颈烧瓶中的粗产品,其目的是___________ 。
Ⅱ.制取苯胺
①组装好实验装置(如下图,夹持仪器已略去),并检查气密性。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
③打开活塞K,通入H2一段时间。
④利用油浴加热,使反应液温度维持在140℃进行反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
(5)若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果除爆炸外还有___________ 。
(6)步骤⑤中,加入生石灰的作用是___________ 。
(7)若实验中硝基苯用量为10 mL,最后得到苯胺5.6g,苯胺的产率为___________ (计算结果精确到0.1%)。
 +3H2
+3H2
 +2H2O
+2H2O
| 物质 | 相对分子质量 | 沸点/℃ | 密度 g/mL | 溶解性 |
| 硝基苯 | 123 | 210.9 | 1.23 | 不溶于水,易溶于乙醇、乙醚 |
| 苯胺 | 93 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚;还原性强、易被氧化 |
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液漏斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。
(2)下列说法中正确的是___________(填序号)。
| A.配制混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中,并不断搅拌、冷却 |
| B.温度控制在50~60℃原因之一是减少副反应的发生 |
| C.制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤 |
| D.浓硫酸可以降低该反应活化能 |
(3)三颈烧瓶中发生反应的化学方程式
(4)提纯产品的过程中需要用5%NaOH溶液洗涤三颈烧瓶中的粗产品,其目的是
Ⅱ.制取苯胺
①组装好实验装置(如下图,夹持仪器已略去),并检查气密性。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
③打开活塞K,通入H2一段时间。
④利用油浴加热,使反应液温度维持在140℃进行反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
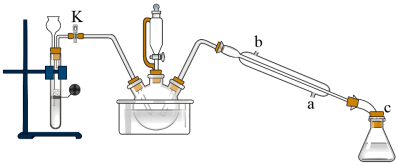
(5)若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果除爆炸外还有
(6)步骤⑤中,加入生石灰的作用是
(7)若实验中硝基苯用量为10 mL,最后得到苯胺5.6g,苯胺的产率为
您最近半年使用:0次
名校
解题方法
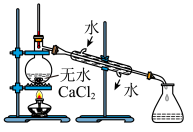
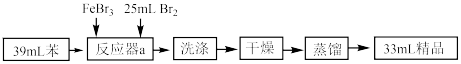
9 . 溴苯是一种重要的有机物,主要用于分析试剂和有机合成。实验室可以用苯、液溴为原料制备一定量的溴苯,制备过程及制备装置如图所示:
(1)虚线框中的仪器能明显提高原料的利用率,该仪器的名称是___________ ,仪器a最合适的容积是___________ (填字母)。
A. B.
B. C.
C. D.
D.
(2)仪器a中反应的化学方程式为___________ 。
(3)洗涤过程:水洗→ 溶液洗→水洗,第一次水洗的操作是
溶液洗→水洗,第一次水洗的操作是___________ ,进行分液。用 溶液洗涤的目的是
溶液洗涤的目的是___________ 。
(4)蒸馏时需要使用温度计。温度计的位置是___________ 。若该实验中溴足量,溴苯的产率为___________ %(结果保留三位有效数字)。

| 苯 | 溴 | 溴苯 | |
密度/ | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
(1)虚线框中的仪器能明显提高原料的利用率,该仪器的名称是
A.
 B.
B. C.
C. D.
D.
(2)仪器a中反应的化学方程式为
(3)洗涤过程:水洗→
 溶液洗→水洗,第一次水洗的操作是
溶液洗→水洗,第一次水洗的操作是 溶液洗涤的目的是
溶液洗涤的目的是(4)蒸馏时需要使用温度计。温度计的位置是
您最近半年使用:0次
10 . 草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。___________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为___________ 。该过程中,可能产生新的杂质气体Cl2,其原因是:___________ (用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是___________ 。
②装置D中生成H2C2O4的化学方程式为___________ 。
③从装置D中得到产品,还需经过___________ (填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是___________ 。
②产品中H2C2O4·2H2O的质量分数为___________ (列出含 m、c、V 的表达式)。
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
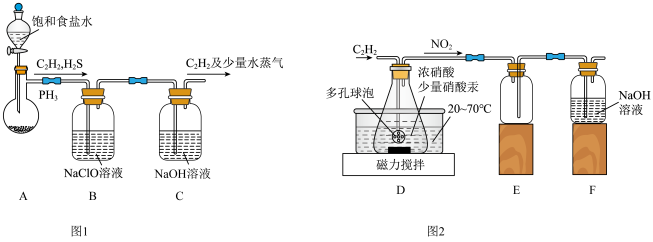
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是
②装置D中生成H2C2O4的化学方程式为
③从装置D中得到产品,还需经过
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是
②产品中H2C2O4·2H2O的质量分数为
您最近半年使用:0次