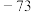解题方法
1 . 乙酸异丙酯被称为“万能溶剂”,具有水果香味,有毒。实验室在通风橱中制备和提纯乙酸异丙酯的装置(夹持和加热装置略)如图所示。
制备原理为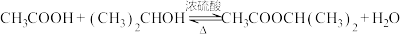 。
。
实验步骤:
Ⅰ.将醋酸、异丙醇和浓硫酸加入蒸馏烧瓶A中,用止水夹将支管口封闭,在搅拌条件下加热回流 以上;
以上;
Ⅱ.反应液降温后注入分液漏斗中,依次用饱和碳酸钠溶液、饱和食盐水、水洗涤,每次洗涤均将液体静置后除去水层;最后加入无水硫酸钠,过滤;
Ⅲ.将步骤Ⅱ中滤出的液体进行精馏,得到乙酸异丙酯成品。
回答下列问题:
(1)仪器E的名称是_______ 。
(2)仪器B的冷凝水的进水口是_______ (填“a”或“b”);仪器D不能用仪器B代替,其原因是_______ 。
(3)步骤Ⅱ中,先用饱和碳酸钠溶液洗涤反应液的目的是_______ 。最后加入无水硫酸钠的作用是_______ 。
(4)Q是与乙酸异丙酯具有相同官能团的同分异构体,Q有_______ 种(不考虑立体异构)。

制备原理为
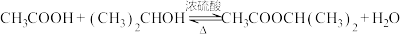 。
。实验步骤:
Ⅰ.将醋酸、异丙醇和浓硫酸加入蒸馏烧瓶A中,用止水夹将支管口封闭,在搅拌条件下加热回流
 以上;
以上;Ⅱ.反应液降温后注入分液漏斗中,依次用饱和碳酸钠溶液、饱和食盐水、水洗涤,每次洗涤均将液体静置后除去水层;最后加入无水硫酸钠,过滤;
Ⅲ.将步骤Ⅱ中滤出的液体进行精馏,得到乙酸异丙酯成品。
回答下列问题:
(1)仪器E的名称是
(2)仪器B的冷凝水的进水口是
(3)步骤Ⅱ中,先用饱和碳酸钠溶液洗涤反应液的目的是
(4)Q是与乙酸异丙酯具有相同官能团的同分异构体,Q有
您最近半年使用:0次
名校
解题方法
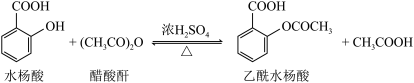
2 . 工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】
【物质性质】
【实验流程】
实验过程:在 锥形瓶中加入水杨酸
锥形瓶中加入水杨酸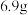 及醋酸酐
及醋酸酐 ,充分摇动使固体完全溶解。缓慢滴加
,充分摇动使固体完全溶解。缓慢滴加 浓硫酸后加热,维持瓶内温度在
浓硫酸后加热,维持瓶内温度在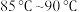 条件下,充分反应。稍冷后进行如下操作.
条件下,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入 冷水中,析出固体,过滤。
冷水中,析出固体,过滤。
②在所得固体中加入 饱和碳酸氢钠溶液,溶解、过滤。
饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤、洗涤、干燥得粗产品。
④粗产品经纯化得白色的乙酰水杨酸晶体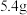 。
。
回答下列问题:
(1)下列玻璃仪器中,操作①中需使用的有________ (填选项字母)
(2)②中饱和碳酸氢钠的作用是_____________________________ 。
(3)③中如何洗涤粗产品(具体操作)_____________________________________________ 。
(4)若要检验粗产品中是否含有水杨酸,可取少许粗产品加入几滴乙醇使其溶解,再滴加入1~2滴______ 溶液.观察是否发生显色反应。
(5)④采用的纯化方法为_____________________________________________ 。
(6)本实验的产率是_______________ %。
【反应原理】

【物质性质】
名称 | 相对分子质量 | 熔点( | 溶解度( |
水杨酸 | 138 | 159 | 微溶于冷水,易溶于热水 |
乙酸酐 | 102 |
| 在水中逐渐分解 |
乙酰水杨酸 | 180 | 135~138 | 微溶于水 |
实验过程:在
 锥形瓶中加入水杨酸
锥形瓶中加入水杨酸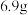 及醋酸酐
及醋酸酐 ,充分摇动使固体完全溶解。缓慢滴加
,充分摇动使固体完全溶解。缓慢滴加 浓硫酸后加热,维持瓶内温度在
浓硫酸后加热,维持瓶内温度在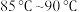 条件下,充分反应。稍冷后进行如下操作.
条件下,充分反应。稍冷后进行如下操作.①在不断搅拌下将反应后的混合物倒入
 冷水中,析出固体,过滤。
冷水中,析出固体,过滤。②在所得固体中加入
 饱和碳酸氢钠溶液,溶解、过滤。
饱和碳酸氢钠溶液,溶解、过滤。③滤液用浓盐酸酸化后冷却、过滤、洗涤、干燥得粗产品。
④粗产品经纯化得白色的乙酰水杨酸晶体
 。
。回答下列问题:
(1)下列玻璃仪器中,操作①中需使用的有

(2)②中饱和碳酸氢钠的作用是
(3)③中如何洗涤粗产品(具体操作)
(4)若要检验粗产品中是否含有水杨酸,可取少许粗产品加入几滴乙醇使其溶解,再滴加入1~2滴
(5)④采用的纯化方法为
(6)本实验的产率是
您最近半年使用:0次
名校
3 . 草酸(乙二酸)存在于自然界的植物中,其钙盐难溶于水,草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解,草酸及其盐在生产生活中有重要用途。某兴趣小组计划制备草酸并研究其性质。
(1)制备草酸。用含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为3:2)溶液氧化淀粉水解液制备草酸,其装置如图所示。[已知:硝酸氧化淀粉水解液过程中主要反应:C6H12O6+HNO3→H2C2O4+NO2↑+NO↑+H2O(未配平)]
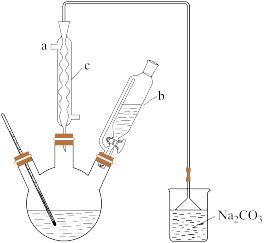
①该反应的温度需控制在55~60℃,适宜的加热方式为_______ 。
②仪器c的名称为_______ ,a为冷凝水的_______ 口。(填“进水”、“出水”) 。
③碳酸钠溶液用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,写出对应的的化学方程式:_______ 。
(2)研究草酸热稳定性。写出草酸晶体(H2C2O4·2H2O)加热分解生成气态产物的化学方程式:_______ ,最合适的分解装置是_______ (填标号)。
a.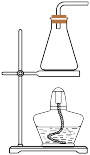 b.
b.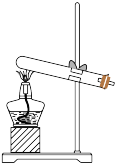 c.
c.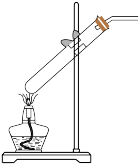 d.
d.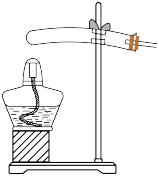
(3)草酸及其盐可用于测定血钙的含量。方法是:取10.00mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,充分反应。将沉淀过滤洗涤后用稀硫酸溶解,并稀释至100mL,取出25.00mL用标准KMnO4溶液滴定。
①溶解CaC2O4沉淀时不能用盐酸,原因是:_______ 。
②滴定终点的现象为_______ 。
(1)制备草酸。用含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为3:2)溶液氧化淀粉水解液制备草酸,其装置如图所示。[已知:硝酸氧化淀粉水解液过程中主要反应:C6H12O6+HNO3→H2C2O4+NO2↑+NO↑+H2O(未配平)]

①该反应的温度需控制在55~60℃,适宜的加热方式为
②仪器c的名称为
③碳酸钠溶液用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,写出对应的的化学方程式:
(2)研究草酸热稳定性。写出草酸晶体(H2C2O4·2H2O)加热分解生成气态产物的化学方程式:
a.
 b.
b. c.
c. d.
d.
(3)草酸及其盐可用于测定血钙的含量。方法是:取10.00mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,充分反应。将沉淀过滤洗涤后用稀硫酸溶解,并稀释至100mL,取出25.00mL用标准KMnO4溶液滴定。
①溶解CaC2O4沉淀时不能用盐酸,原因是:
②滴定终点的现象为
您最近半年使用:0次
名校
4 . A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,易溶于水并有特殊香味:B的产量可以用来衡量一个国家石油化学工业的发展水平,有关物质的转化关系如图所示。
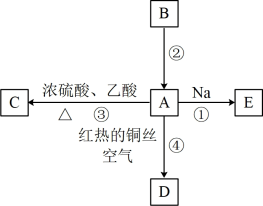
Ⅰ.根据图示完成下列问题:
(1)A中官能团的名称为_______ 。
(2)反应②的反应类型是_______ 。
(3)反应④的化学方程式为_______ 。
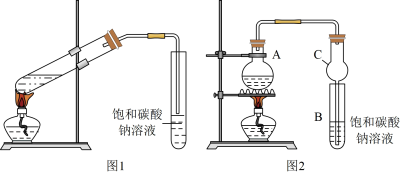
Ⅱ.某校化学探究小组甲、乙两同学分别使用图1、图2装置探究制备反应③的情况。
已知:①无水氯化钙可与乙醇形成难溶于水的 。
。
②相关有机物的沸点:
(4)甲同学向试管中加入3 mL乙醇,然后边摇动试管边慢慢加入2 mL浓硫酸和2 mL冰醋酸。用酒精灯小心均匀地加热试管3-5分钟,产生的蒸汽经导管通到饱和碳酸钠溶液的液面上。关于制备乙酸乙酯的说法错误的是_______ (填标号)。
A.换成水浴加热原料的损失会减少
B.不断蒸出乙酸乙酯,会降低其产率
C.饱和碳酸钠的作用是吸收乙醇,中和乙酸,降低乙酸乙酯溶解度
D.分离乙酸乙酯所需的玻璃仪器是蒸馏烧瓶
E.除去乙酸乙酯中少量的乙醇和水,可先加足量无水氯化钙过滤,再加无水硫酸钠后蒸馏
(5)最终制得纯净的乙酸乙酯2.2 g,产率是_______ (计算结果保留3位有效数字)。
(6)常用同位素 示踪法来确定反应机理,
示踪法来确定反应机理,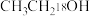 和
和 制取乙酸乙酯的反应体系中存在
制取乙酸乙酯的反应体系中存在 的物质有
的物质有_______ (标出 位置)。
位置)。
(7)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明 对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是
对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_______ mL和_______ mol/L。
②分析实验_______ (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。

Ⅰ.根据图示完成下列问题:
(1)A中官能团的名称为
(2)反应②的反应类型是
(3)反应④的化学方程式为
Ⅱ.某校化学探究小组甲、乙两同学分别使用图1、图2装置探究制备反应③的情况。

已知:①无水氯化钙可与乙醇形成难溶于水的
 。
。②相关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77 |
密度( ) ) | 0.714 | 0.778 | 1.05 | 0.897 |
A.换成水浴加热原料的损失会减少
B.不断蒸出乙酸乙酯,会降低其产率
C.饱和碳酸钠的作用是吸收乙醇,中和乙酸,降低乙酸乙酯溶解度
D.分离乙酸乙酯所需的玻璃仪器是蒸馏烧瓶
E.除去乙酸乙酯中少量的乙醇和水,可先加足量无水氯化钙过滤,再加无水硫酸钠后蒸馏
(5)最终制得纯净的乙酸乙酯2.2 g,产率是
(6)常用同位素
 示踪法来确定反应机理,
示踪法来确定反应机理,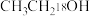 和
和 制取乙酸乙酯的反应体系中存在
制取乙酸乙酯的反应体系中存在 的物质有
的物质有 位置)。
位置)。(7)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:
| 实验编号 | 烧瓶A中的试剂 | 试管B中试剂 | 测得有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、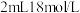 浓硫酸 浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、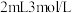 硫酸 硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是
对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是②分析实验
您最近半年使用:0次
名校
5 . 石河子一中强基计划化学学科实验小组同学查阅资料,发现硫脲[CS(NH2)2]是用于制造药物、染料、金属矿物的浮选剂等的原料,同学们用Ca(HS)2与CaCN2(石灰氮)合成硫脲并测定产品纯度。
已知:①硫脲是白色、有光泽的晶体,相对分子质量76,溶于水,20℃时溶解度为13.6g;在150℃时转变成NH4SCN。②酸性:H2CO3>H2S。
(1)制备Ca(HS)2溶液:所用装置如图所示。

①装置a的名称为____ 。
②装置b中盛放的试剂____ 。
③装置c中的长直导管的作用是____ ,三颈烧瓶中通入CO2不能过量,原因是____ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见强碱,该反应的化学方程式为____ 。
(3)产品纯度的测定。
称取ag粗产品,配制成100mL溶液,量取20.00mL该溶液,用bmol/L的酸性KMnO4溶液滴定,滴至终点时平均消耗酸性KMnO4溶液的体积为VmL。
已知:5CS(NH2)2+14MnO +32H+=14Mn2++5CO2↑+5N2↑+5SO
+32H+=14Mn2++5CO2↑+5N2↑+5SO +26H2O。
+26H2O。
①滴定至终点时的现象是____ 。
②该产品的纯度为____ (写出表达式即可)。
已知:①硫脲是白色、有光泽的晶体,相对分子质量76,溶于水,20℃时溶解度为13.6g;在150℃时转变成NH4SCN。②酸性:H2CO3>H2S。
(1)制备Ca(HS)2溶液:所用装置如图所示。

①装置a的名称为
②装置b中盛放的试剂
③装置c中的长直导管的作用是
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见强碱,该反应的化学方程式为
(3)产品纯度的测定。
称取ag粗产品,配制成100mL溶液,量取20.00mL该溶液,用bmol/L的酸性KMnO4溶液滴定,滴至终点时平均消耗酸性KMnO4溶液的体积为VmL。
已知:5CS(NH2)2+14MnO
 +32H+=14Mn2++5CO2↑+5N2↑+5SO
+32H+=14Mn2++5CO2↑+5N2↑+5SO +26H2O。
+26H2O。①滴定至终点时的现象是
②该产品的纯度为
您最近半年使用:0次
解题方法
6 . 硝基苯是一种无色、有苦杏仁气味的液体,难溶于水,密度比水大,用于生产染料、香料、炸药等有机合成工业。在制备与纯化硝基苯的实验中,下列装置(部分夹持及加热仪器略去)能用到但有错误的是
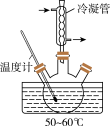 | 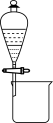 |  |  |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
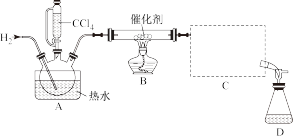
7 . CH4与氯气反应可生成氯仿(CHCl3),但很难得到纯净的氯仿,氯仿常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下:
实验步骤:
①检验装置气密性;
②通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入19.37mL(0.2mol)CCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分离出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿16.73g。请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为_______ 。
(2)B处生成氯仿,反应的化学方程式为_______ 。
(3)C处应选用的仪器为_______ (填选项字母),其名称为_______ 。
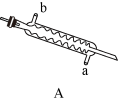


(4)步骤⑥中,用NaHCO3溶液洗涤的目的为_______ 。
(5)该实验中,氯仿的产率为_______ 。
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为____ 。
 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 | |
| 物质 | CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 | |
①检验装置气密性;
②通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入19.37mL(0.2mol)CCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分离出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿16.73g。请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为
(2)B处生成氯仿,反应的化学方程式为
(3)C处应选用的仪器为
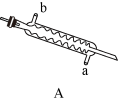


(4)步骤⑥中,用NaHCO3溶液洗涤的目的为
(5)该实验中,氯仿的产率为
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
8 . 将1-丁醇、溴化钠和70%的硫酸,经回流、蒸馏、萃取分液制得1-溴丁烷,部分装置如图所示。制备反应: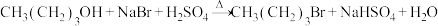 。下列说法正确的是
。下列说法正确的是
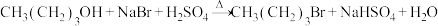 。下列说法正确的是
。下列说法正确的是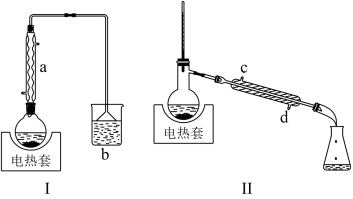
| A.该制备反应利用了硫酸的氧化性和脱水性 |
| B.装置Ⅰ中a的作用是冷凝回流,b的作用是吸收尾气 |
| C.反应结束后的混合物用装置Ⅱ蒸馏时,c为进水口,d为出水口 |
D.若装置Ⅱ蒸出的粗产品含有 ,用 ,用 萃取分液除去 萃取分液除去 |
您最近半年使用:0次
2022-11-02更新
|
328次组卷
|
2卷引用:北京市海淀区2022-2023学年高三上学期期中考试化学试题
名校
解题方法
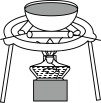
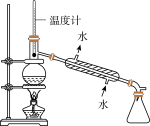
9 . 下列操作规范(或装置正确)且能达到实验目的的是
| A | B | C | D |
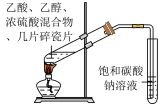 | 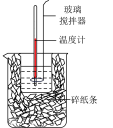 | 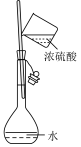 |  |
| 制取乙酸乙酯 | 测定中和热 | 稀释浓硫酸 | 测定醋酸浓度 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-11-02更新
|
173次组卷
|
2卷引用:浙江省余姚中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
10 . 对甲基苯胺可用对硝基甲苯作原料在一定条件制得。主要反应及装置如下:

主要反应物和产物的物理性质见下表:
实验步骤如下:
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如图,a处缺少的装置是_______ (填仪器名称),实验步骤③和④的分液操作中使用到下列仪器中的_______ (填标号)。
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH=7~8的目的之一是使Fe3+转化为氢氧化铁沉淀,另一个目的是_______ 。
(3)步骤③中液体M是分液时的_______ 层(填“上”或“下”)液体,加入盐酸的作用是_______ 。
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有_______ 。
(5)步骤⑤中,以下洗涤剂中最合适的是_______ (填标号)。
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是_______ %。(计算结果保留一位小数)

主要反应物和产物的物理性质见下表:
| 化合物 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
| 对硝基甲苯 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
| 对甲基苯胺 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
| 对甲基苯胺盐酸盐 | 易溶于水,不溶于乙醇、苯 | 243~245 | -- | -- |
| 苯 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如图,a处缺少的装置是
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH=7~8的目的之一是使Fe3+转化为氢氧化铁沉淀,另一个目的是
(3)步骤③中液体M是分液时的
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有
(5)步骤⑤中,以下洗涤剂中最合适的是
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是
您最近半年使用:0次
2022-10-31更新
|
1162次组卷
|
4卷引用:四川省绵阳中学2021-2022学年高三上学期高考化学仿真试卷(一)


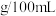 水
水