1 . 磷化氢(PH3)具有能量密度高、可再生优势,常用作新能源材料。一种工业上利用副产法制备PH3的流程如图所示:
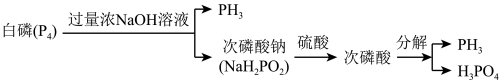
| A.白磷(P4)属于共价晶体 |
| B.次磷酸钠是酸式盐 |
| C.白磷与浓NaOH溶液反应,氧化剂与还原剂的物质的量之比为1:3 |
| D.流程中的每一步反应均属于氧化还原反应 |
您最近一年使用:0次
名校
2 . 设 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是
 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是A.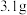 白磷( 白磷( ,正四面体结构)中含有 ,正四面体结构)中含有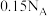 个 个 键 键 |
B. 氧气在充分反应过程中,转移的电子数目一定为 氧气在充分反应过程中,转移的电子数目一定为 |
C.标准状况下,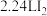 与 与 充分反应,生成的 充分反应,生成的 分子数目为 分子数目为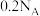 |
D.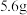 铁粉与 铁粉与 的硝酸充分反应,产生的 的硝酸充分反应,产生的 分子数目为 分子数目为 |
您最近一年使用:0次
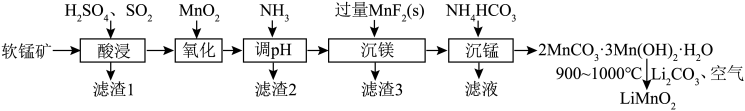
3 . 层状LiMnO2在电动车、空间技术等范畴具有十分广阔的应用前景。LiMnO2可由软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3、SiO2、MgO等)制备,其制备流程如图:
回答下列问题:
(1) LiMnO2中锰元素的化合价为______ ;“酸浸”后过滤,所得滤液中主要含有的金属阳离子有______ 。
(2)为了提高“酸浸”的浸取速率,可采取的措施有______ (写出两点)。
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为______ 。
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是______ 。
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是______ 。
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为______ %(已知:EDTA与Mn2+反应的化学计量数之比为1∶1)。
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1) LiMnO2中锰元素的化合价为
(2)为了提高“酸浸”的浸取速率,可采取的措施有
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为
您最近一年使用:0次
名校
解题方法
4 . 锗是一种战略性金属,广泛应用于光学及电子工业领域。一种用锌浸渣(主要含ZnFe2O4、CaSO4,另含少量ZnS、SiO2以及GeS2)提取Ge和ZnSO4⋅H2O的工艺流程如下:
②常温下,Ksp[Ge(OH)4]=4.0×10-46,Ksp[Fe(OH)3]=4.0×10-38。请回答下列问题:
(1)Ge在元素周期表中的位置为___________ 。
(2)“氧化酸浸”工序中,溶液pH≈1.5,浸渣的主要成分为SiO2、S和___________ (填化学式);GeS2被双氧水氧化的离子方程式为___________ 。
(3)“中和沉淀”工序中,所加化合物A为___________ (填一种物质的化学式);调节溶液pH=4.4,Ge和Fe共沉淀,此时滤液中c(Ge4+):c(Fe3+)=___________ 。
(4)①ZnSO4在水溶液中的溶解度曲线如图所示,则从滤液中回收ZnSO4⋅H2O的操作为蒸发浓缩、___________ 、洗涤、干燥。___________ 工序循环使用。
(5)“水解”工序中,GeCl4水解生成GeO2的化学方程式为___________ 。

②常温下,Ksp[Ge(OH)4]=4.0×10-46,Ksp[Fe(OH)3]=4.0×10-38。请回答下列问题:
(1)Ge在元素周期表中的位置为
(2)“氧化酸浸”工序中,溶液pH≈1.5,浸渣的主要成分为SiO2、S和
(3)“中和沉淀”工序中,所加化合物A为
(4)①ZnSO4在水溶液中的溶解度曲线如图所示,则从滤液中回收ZnSO4⋅H2O的操作为蒸发浓缩、

(5)“水解”工序中,GeCl4水解生成GeO2的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i: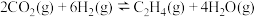
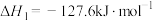
反应ii: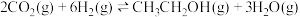
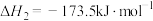
反应iii: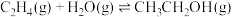
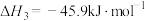
请回答下列问题:
(1)已知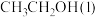 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示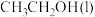 燃烧热的热化学方程式为
燃烧热的热化学方程式为________ 。
(2)在一定温度下,向2L恒容密闭容器中充入 和
和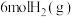 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如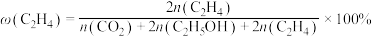 ]与时间的关系如图所示。
]与时间的关系如图所示。
①表示乙烯占比的曲线是________ (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数K=________ (保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为 、
、 ,适当升温后,
,适当升温后,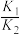
________ (填“增大”“减小”或“无法判断”),理由是________ 。
(3)近日,中国科学技术大学某课题组以Pd掺杂的 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(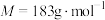 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。________ ,CD段发生反应的化学方程式为________ 。
反应i:
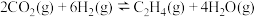
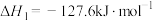
反应ii:
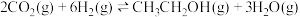
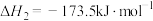
反应iii:
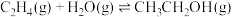
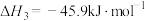
请回答下列问题:
(1)已知
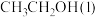 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示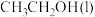 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在一定温度下,向2L恒容密闭容器中充入
 和
和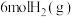 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如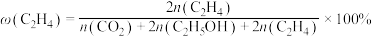 ]与时间的关系如图所示。
]与时间的关系如图所示。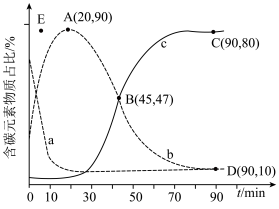
①表示乙烯占比的曲线是
②若选择对反应i催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应iii的平衡常数K=
④设反应i和反应ii的化学平衡常数分别为
 、
、 ,适当升温后,
,适当升温后,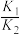
(3)近日,中国科学技术大学某课题组以Pd掺杂的
 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)( )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。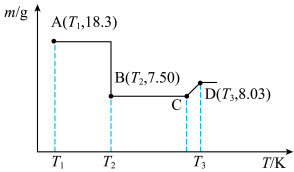
您最近一年使用:0次
名校
6 . 不列有关实验操作,现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 两支试管各盛有4mL | 加入 草酸溶液的试管中溶液紫色消失更快 草酸溶液的试管中溶液紫色消失更快 | 其他条件相同,反应物浓度越大,反应速率越快 |
| B | 向 | 溶液分层,上层呈橙红色 | 氧化性: |
| C | 向含相同浓度的KBr、KI混合溶液中依次加入少量氯水和 | 溶液分层,下层呈紫红色 | 氧化性: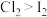 , , |
| D | 向脱脂棉上滴加蒸馏水和浓硫酸,反应后,再滴入少量新制氢氧化铜,加热 | 有砖红色沉淀产生 | 纤维素水解产物有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . “龙行龘龘,欣欣家国”,美好生活与化学紧密相连。下列说法正确的是
| A.免洗洗手液有效成分中的活性银离子能使蛋白质变性 |
| B.维生素C可用做水果罐头的抗氧化剂是由于其难以被氧化 |
| C.重油在高温、高压和催化剂作用下通过水解反应转化为小分子烃 |
| D.“天目一号”气象星座卫星的光伏发电系统工作时可将化学能转化为电能 |
您最近一年使用:0次
解题方法
8 . 某小组同学探究Mg与 溶液的反应。
溶液的反应。
已知:i.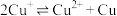
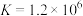
ⅱ.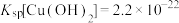
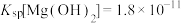
ⅲ. 为无色、
为无色、 为黄色
为黄色
实验I:将长约15cm打磨光亮的镁条放入2mL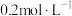
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:
(1)第一阶段析出红色固体发生反应的离子方程式是______ 。
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因______ 。
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是______ 。
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是______ 。
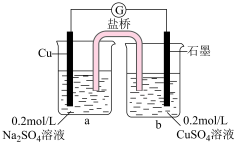
③小组同学采用电化学装置进行验证。______ 。从而证明了甲同学的猜想。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是______ 。
实验Ⅱ:改用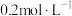
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
(5)经验证蓝色沉淀为 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是______ (填序号)。
a.反应放热,促使 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀
b.存在平衡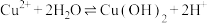 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀
c.由于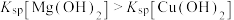 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀
(6)综上所述,影响Mg与 溶液反应的影响因素是
溶液反应的影响因素是______ 。
 溶液的反应。
溶液的反应。已知:i.
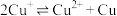
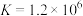
ⅱ.
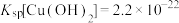
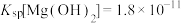
ⅲ.
 为无色、
为无色、 为黄色
为黄色实验I:将长约15cm打磨光亮的镁条放入2mL
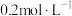
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:| 时间 | 第一阶段 0~1min | 第二阶段 1~8min | 第三阶段 8~25min | 第四阶段 25min~18h |
| 实验现象 | 镁条表面出现红色固体,伴有大量气体产生 | 仍然伴有大量气体,溶液变为淡蓝色,试管底部有蓝色沉淀产生 | 气体量不断减少,沉淀变为黄色 | 沉淀变为橙色,红色铜几乎不可见 |
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是
③小组同学采用电化学装置进行验证。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是
实验Ⅱ:改用
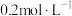
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。(5)经验证蓝色沉淀为
 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是a.反应放热,促使
 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀b.存在平衡
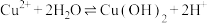 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀c.由于
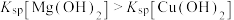 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀(6)综上所述,影响Mg与
 溶液反应的影响因素是
溶液反应的影响因素是
您最近一年使用:0次
解题方法
9 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□ □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应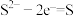 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
 | 向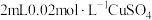 溶液中加入 溶液中加入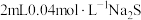 溶液 溶液 | 产生黑色固体 |
 | 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
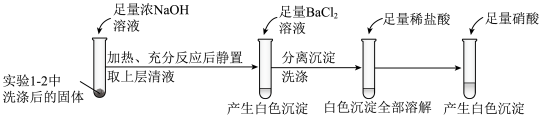
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
 □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
| 序号 | 实验方案 | 实验现象 | |
| 3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
| 3-2 | a: 溶液 溶液b: 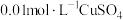 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
| 3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 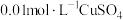 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
| 3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 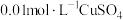 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
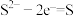 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近一年使用:0次
名校
10 .  可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。
回答下列问题:
(1) 的价层电子排布图
的价层电子排布图_______ ,“酸浸”过程中,滤渣1的主要成分为S、_______ (填化学式)。
(2)“酸浸”过程中 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。_______ 。
②80~100min时, 浓度上升的原因可能是
浓度上升的原因可能是_______ 。
(3)“沉铁”过程中依次加入的试剂X、Y为_______ (填字母)。
A.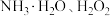 B.
B. C.
C.
(4)“滤液”萃取前调 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,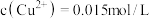 多次萃取后水相中
多次萃取后水相中 为
为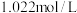 ,则铜的萃取率为
,则铜的萃取率为_______ (结果保留小数点后一位,溶液体积变化忽略不计)。
(5)利用 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:_______ 。
(6)结合图像分析,若要获得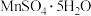 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热_______ 得到_______ ℃饱和溶液,_______ ,过滤酒精洗涤,低温干燥。
 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。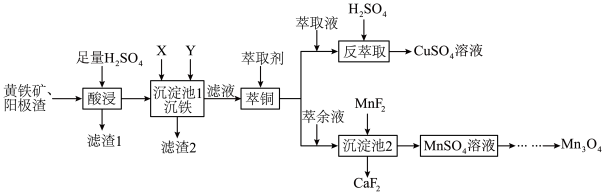
 |  |  |  | |
| 完全沉淀时的pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)
 的价层电子排布图
的价层电子排布图(2)“酸浸”过程中
 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。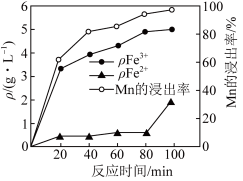
②80~100min时,
 浓度上升的原因可能是
浓度上升的原因可能是(3)“沉铁”过程中依次加入的试剂X、Y为
A.
 B.
B. C.
C.
(4)“滤液”萃取前调
 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,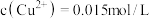 多次萃取后水相中
多次萃取后水相中 为
为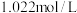 ,则铜的萃取率为
,则铜的萃取率为(5)利用
 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:(6)结合图像分析,若要获得
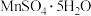 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热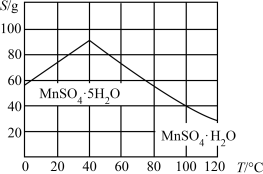
您最近一年使用:0次











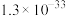
 酸性高锰酸钾溶液,分别加入2mL
酸性高锰酸钾溶液,分别加入2mL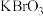 溶液中通入少量氯气,然后再加入少量苯,振荡,静置
溶液中通入少量氯气,然后再加入少量苯,振荡,静置 ,振荡,静置
,振荡,静置


