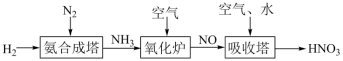
1 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2)氨气在氧化炉中发生反应的化学方程式为___________ 。
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
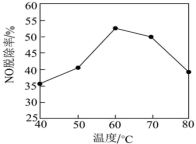
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是___________ 。
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成
 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是
您最近一年使用:0次
2 . 环境保护是化学的重要任务,请完成下列问题。
(1)采用“联合脱硫脱氮技术”处理烟气(含 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是___________ 。
②反应釜 中
中 转化为
转化为 反应的化学方程式为
反应的化学方程式为___________ 。
(2)烟气(主要污染物 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
①烟气经 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为___________ 。
②尿素 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为___________ 。
(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为___________ 。
②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量___________ (填“大于”“小于”或“等于”) 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是___________ 。
(1)采用“联合脱硫脱氮技术”处理烟气(含
 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。

 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是②反应釜
 中
中 转化为
转化为 反应的化学方程式为
反应的化学方程式为(2)烟气(主要污染物
 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。①烟气经
 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为②尿素
 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用
 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收
 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
您最近一年使用:0次
名校
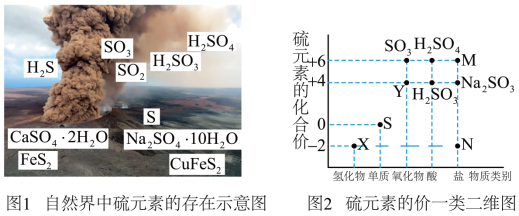
3 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2)在X、Y、S中属于非电解质的是___________ (填化学式);X与Y反应中氧化剂与还原剂的物质的量之比为___________ 。
(3)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸以及稀硝酸和 做原料,设计了两种制取胆矾的方案。
做原料,设计了两种制取胆矾的方案。
方案甲: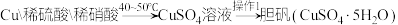
i.该方法中首先要将Cu与稀硫酸和稀硝酸混合,为了只得到 溶液,需向50mL 1.0mol/L稀硝酸中加入
溶液,需向50mL 1.0mol/L稀硝酸中加入___________ mL 1.0mol/L稀硫酸与之混合。
ii.操作1:___________ 、___________ 、过滤、洗涤和干燥
方案乙: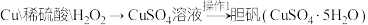
iii.该方法的化学方程式___________ 。
iv.这两种方案,你认为哪一种方案更合理?___________ (填“方案甲”或“方案乙”)。
(2)在X、Y、S中属于非电解质的是
(3)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸以及稀硝酸和
 做原料,设计了两种制取胆矾的方案。
做原料,设计了两种制取胆矾的方案。方案甲:
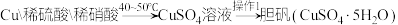
i.该方法中首先要将Cu与稀硫酸和稀硝酸混合,为了只得到
 溶液,需向50mL 1.0mol/L稀硝酸中加入
溶液,需向50mL 1.0mol/L稀硝酸中加入ii.操作1:
方案乙:
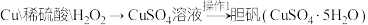
iii.该方法的化学方程式
iv.这两种方案,你认为哪一种方案更合理?
您最近一年使用:0次
名校
4 . 84消毒液是常用的消毒剂之一,下列有关84消毒液的说法正确的是
A.基态Cl原子的价电子排布式为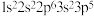 |
B.向该溶液中加入浓盐酸,每产生1 mol ,转移的电子数约为 ,转移的电子数约为 |
C.向该溶液中滴入少量 溶液,反应的离子方程式为 溶液,反应的离子方程式为 |
D.该溶液中, 、 、 、 、 , , 可以大量共存 可以大量共存 |
您最近一年使用:0次
5 . 硒和碲广泛用于玻璃工业、橡胶和半导体工业.实验室中以碲碱渣(主要含 、
、 ,还有微量的
,还有微量的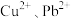 及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示.
及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示. 与
与 ;
;
② 为两性氧化物;③盐酸“酸浸”后硒以
为两性氧化物;③盐酸“酸浸”后硒以 形式存在.
形式存在.
下列说法错误的是
 、
、 ,还有微量的
,还有微量的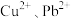 及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示.
及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示.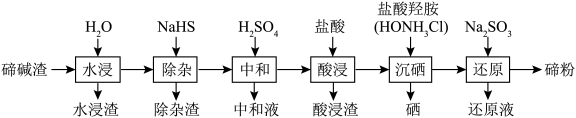
 与
与 ;
;②
 为两性氧化物;③盐酸“酸浸”后硒以
为两性氧化物;③盐酸“酸浸”后硒以 形式存在.
形式存在.下列说法错误的是
| A.流程中涉及的六种工序中,进行物质分离时均需用到烧杯、漏斗和玻璃棒 |
| B.粉碎碲碱渣、延长水浸时间均可以提高硒和碲元素的浸出率 |
C.“中和”时加入过量硫酸,可以提高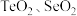 的转化率 的转化率 |
D.“沉硒”时同时生成了 和HCl,则其主要的化学方程式为 和HCl,则其主要的化学方程式为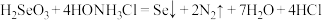 |
您最近一年使用:0次
6 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为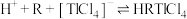 .
.
请回答下列问题:
(1)基态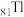 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.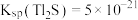 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中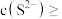
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
②向含铊废水中加入溴水,使 充分氧化成
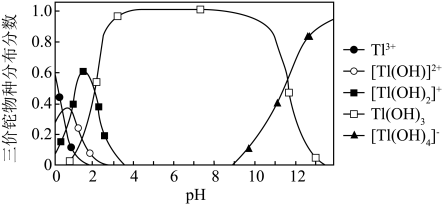
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: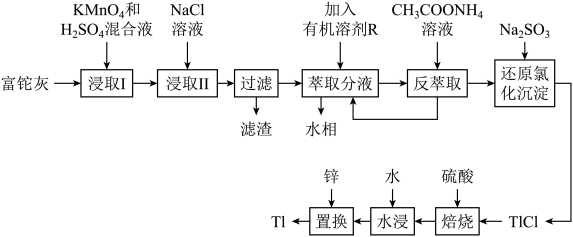
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
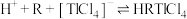 .
.请回答下列问题:
(1)基态
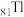 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.
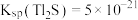 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中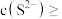
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
解题方法
7 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,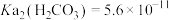 ,
,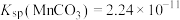
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
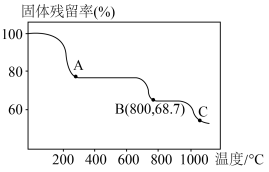
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: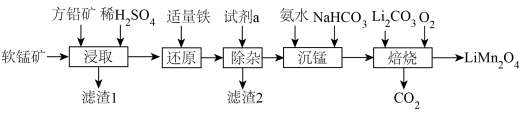
 ,
,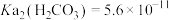 ,
,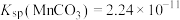
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
您最近一年使用:0次
名校
解题方法
8 . 工业上采用酸性高浓度含砷废水主要以亚砷酸(H3AsO3)形式存在,提取As2O3的工艺流程如下:
Ⅰ.As2S3与过量的 存在以下反应:
存在以下反应: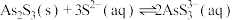 ;
;
Ⅱ.亚砷酸盐的溶解性大于相应砷酸盐。
回答下列问题:
(1)沉砷中FeSO4的作用是___________ :
(2)H2O2的作用是___________ ;滤渣I中含有FeAsO4、 、
、 和
和___________ (填化学式)。
(3)加生石灰和过氧化氢过程中,也可将砷元素转化为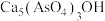 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
A.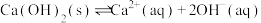

B.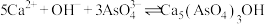

资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是___________ 。
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为___________ 。
(5)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:___________ 。
(6)已知 的
的 ,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以
,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以 形式存在)中Fe3+的浓度为
形式存在)中Fe3+的浓度为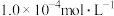 ,则低浓度含砷废水中
,则低浓度含砷废水中 的浓度为
的浓度为___________ mg⋅L-1,___________ (填“符合”或“不符合”)排放标准。

Ⅰ.As2S3与过量的
 存在以下反应:
存在以下反应: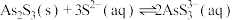 ;
;Ⅱ.亚砷酸盐的溶解性大于相应砷酸盐。
回答下列问题:
(1)沉砷中FeSO4的作用是
(2)H2O2的作用是
 、
、 和
和(3)加生石灰和过氧化氢过程中,也可将砷元素转化为
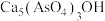 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:A.
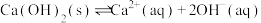

B.
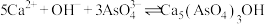

资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为
(5)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

(6)已知
 的
的 ,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以
,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以 形式存在)中Fe3+的浓度为
形式存在)中Fe3+的浓度为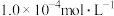 ,则低浓度含砷废水中
,则低浓度含砷废水中 的浓度为
的浓度为
您最近一年使用:0次
名校
解题方法
9 . 研究人员拟设计黄铜矿(主要含 )制备硝酸铜和绿矾晶体的流程如下:
)制备硝酸铜和绿矾晶体的流程如下:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 价,已知“焙烧”生成 、CuO和
、CuO和 则其化学反应方程式为
则其化学反应方程式为_______ 。
(2)“置换”步骤中发生的所有反应的离子方程式有
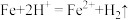 、
、_______ 。
(3)流程中“操作A”所需的玻璃仪器有烧杯、玻璃棒、_______ 。
(4)“浸洗”步骤中加入用于分离Cu、Fe的溶液A是_______ (填“稀 ”或“稀
”或“稀 ”)。
”)。
(5)“反应”步骤中,10% 为氧化剂,20%
为氧化剂,20% 提供
提供 ,可以避免污染性气体的产生,写出该“反应”的离子方程式:
,可以避免污染性气体的产生,写出该“反应”的离子方程式:_______ 。
(6)绿矾晶体( )在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
)在空气中极易变质;验证绿矾晶体已变质可选择的试剂为_______ 。
 )制备硝酸铜和绿矾晶体的流程如下:
)制备硝酸铜和绿矾晶体的流程如下: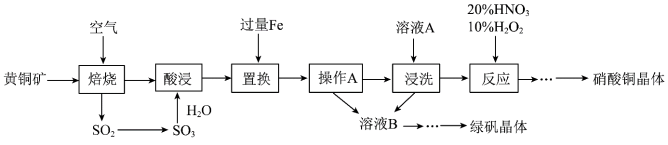
(1)
 中铁元素的化合价为
中铁元素的化合价为 、CuO和
、CuO和 则其化学反应方程式为
则其化学反应方程式为(2)“置换”步骤中发生的所有反应的离子方程式有

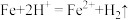 、
、(3)流程中“操作A”所需的玻璃仪器有烧杯、玻璃棒、
(4)“浸洗”步骤中加入用于分离Cu、Fe的溶液A是
 ”或“稀
”或“稀 ”)。
”)。(5)“反应”步骤中,10%
 为氧化剂,20%
为氧化剂,20% 提供
提供 ,可以避免污染性气体的产生,写出该“反应”的离子方程式:
,可以避免污染性气体的产生,写出该“反应”的离子方程式:(6)绿矾晶体(
 )在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
)在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
您最近一年使用:0次
名校
解题方法
10 . 微生物在电子供体的作用下可将 (存在形式为
(存在形式为 )还原为更易被去除的
)还原为更易被去除的 ,根据电子供体的不同可分为自养还原和异养还原。为去除水中锑(+5)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是
,根据电子供体的不同可分为自养还原和异养还原。为去除水中锑(+5)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是
 (存在形式为
(存在形式为 )还原为更易被去除的
)还原为更易被去除的 ,根据电子供体的不同可分为自养还原和异养还原。为去除水中锑(+5)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是
,根据电子供体的不同可分为自养还原和异养还原。为去除水中锑(+5)酸盐,某大学建立升流式硫自养固定床生物反应器,其反应机理如图所示。下列说法正确的是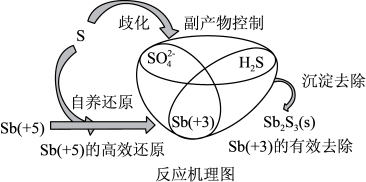
| A.在生物反应器中可以实现S单质的循环利用 |
B.自养还原过程的离子方程式为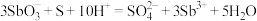 |
C.歧化过程中,氧化产物与还原产物的物质的量之比为 |
D. 的沉淀去除过程发生了氧化还原反应 的沉淀去除过程发生了氧化还原反应 |
您最近一年使用:0次



