在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生反应的总化学方程式:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图所示。下列说法正确的是
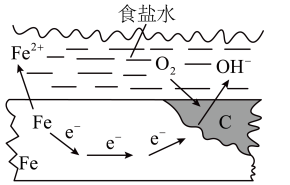

| A.铁片发生还原反应而被腐蚀 |
| B.铁片腐蚀过程中负极发生的电极反应:Fe-2e-=Fe2+ |
| C.铁片里的铁和碳与食盐水形成了无数微小原电池,发生了析氢腐蚀 |
| D.防止铁片腐蚀的一种方法是将铁片接到电源正极 |
更新时间:2023-08-04 14:34:38
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】下列离子方程式正确的是
| A.钢铁腐蚀的负极反应:Fe – 3e- === Fe3+ |
B.HCO 的水解:HCO 的水解:HCO +H2O +H2O CO CO +H3O+ +H3O+ |
C.用惰性电极电解饱和食盐水: 2Cl–+2H2O H2↑+ Cl2↑+2OH– H2↑+ Cl2↑+2OH– |
| D.AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag+ + I- === AgI↓ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列实例中,不存在氧化还原反应的是
| A.海水晒盐 | B.炸药爆炸 | C.漂白粉消毒 | D.钢铁生锈 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】化学与生活密切相关,下列说法错误的是
| A.碳纤维是一种新型有机高分子材料 |
| B.棉、麻完全燃烧的产物为二氧化碳和水 |
| C.三星堆青铜器生锈主要发生电化学腐蚀 |
| D.Na、K合金可用作原子反应堆的导热剂 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】铜板上铁铆钉若较长时间地没泡在海水中会生锈甚至腐烂,其腐蚀原理如图所示。下列有关此过程的说法不正确的是
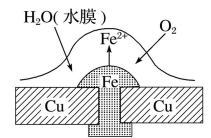

| A.正极上的主要电极反应式为:2H2O+O2+4e-=4OH- |
| B.此过程中铜并未被腐蚀 |
| C.此过程中会有微小电流从Fe移向Cu |
| D.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】某学习小组按下图探究金属电化学腐蚀与防护的原理,下列说法正确的是
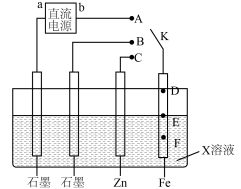
| A.若b为正极,K连接A时,铁棒防腐的方式称为牺牲阳极的阴极保护法 |
| B.相同条件下,若X为食盐水,K分别连接B、C时前者铁棒的腐蚀速度更慢 |
| C.若X为模拟海水,K未闭合时铁棒上E点表面铁锈最多,腐蚀最严重的位置则是F |
| D.若在X溶液中预先加入适量的K4[Fe(CN)6]溶液,可有效提升铁棒腐蚀或防腐的观察效果 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】在城市中地下常埋有许多金属管道和输电线路,地面上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,下列有关说法错误的是
| A.会引起金属管道或铁轨腐蚀 |
| B.该过程金属管道或铁轨只发生了吸氧腐蚀 |
| C.应将埋在地下的金属管道或铁轨涂上绝缘膜防止被腐蚀 |
| D.为防止金属管道或铁轨腐蚀,可以将它们与直流电源的负极相连 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐3】铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为 。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。铁制品在潮湿的空气中容易生锈,下列对铁制品的防锈措施中不合理的是
。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。铁制品在潮湿的空气中容易生锈,下列对铁制品的防锈措施中不合理的是
 。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。铁制品在潮湿的空气中容易生锈,下列对铁制品的防锈措施中不合理的是
。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。铁制品在潮湿的空气中容易生锈,下列对铁制品的防锈措施中不合理的是| A.将铁制品放在干燥的环境中 | B.在铁制品表面喷上氯化钠溶液 |
| C.在铁中加入镍、铬等金属制成合金 | D.在铁制品表面烧制搪瓷 |
您最近一年使用:0次