用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
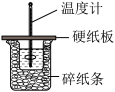
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________________ 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值____________ (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________ (填“相等、不相等”),所求中和热△H_______________ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会_______ (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________ (填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
已知反应后溶液的比热容C为4.18KJ·℃-1· kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________ (保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:_____________ 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)大烧杯上如不盖硬纸板,求得的中和热数值
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会
(5)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 中和热△H | |||
| 起始平均温度 | 反应最高温度 | ||||
| ① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
| A.实验装置保温、隔热效果差 |
| B.量取稀盐酸溶液的体积时仰视读数 |
| C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中 |
| D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度 |
更新时间:2017-02-17 14:46:42
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是:______________ 。
(2)烧杯间填满碎纸条的作用是:_____________________________ 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________ (填“偏大、偏小、无影响”)
(4)加入NaOH溶液的正确操作是_____________ (填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是______________
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量_______ (填“小于”、“等于”或“大于”)57.3kJ
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJ•mol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJ•mol﹣1.则CH3COOH在水溶液中电离的△H等于______________ .
A.﹣67.7kJ•mol﹣1 B.﹣43.5kJ•mol﹣1 C.+43.5kJ•mol﹣1 D.+67.7kJ•mol﹣1

(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)烧杯间填满碎纸条的作用是:
(3)大烧杯上如不盖硬纸板,求得的中和热数值
(4)加入NaOH溶液的正确操作是
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJ•mol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJ•mol﹣1.则CH3COOH在水溶液中电离的△H等于
A.﹣67.7kJ•mol﹣1 B.﹣43.5kJ•mol﹣1 C.+43.5kJ•mol﹣1 D.+67.7kJ•mol﹣1
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】50mL 0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
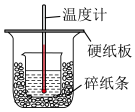
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________ 。由图可知该装置仍有不妥之处,如不改正,求得的中和热数值会____________ (填“偏大”“偏小”“无影响”)。
(2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_______________ 。
(3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
②近似认为0.55 mol·L-1 NaOH溶液和0.50 mol·L-1盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=________ (取小数点后一位)。
(4)下列情况会使测得中和热的数值偏小的是________ (填字母)。
A.用浓硫酸代替盐酸进行上述实验
B. 用相同浓度和体积的氨水代替NaOH溶液进行上述实验
C. 用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):
(3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.1 | |
| 2 | 25.9 | 25.9 | 25.9 | 29 | |
| 3 | 27.0 | 27.4 | 27.2 | 31.7 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.2 | |
(4)下列情况会使测得中和热的数值偏小的是
A.用浓硫酸代替盐酸进行上述实验
B. 用相同浓度和体积的氨水代替NaOH溶液进行上述实验
C. 用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
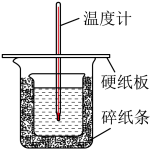
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________ ,除此之外,装置中的一个明显错误是___________________________________ 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________ 。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______ (填“相等”“不相等”),若实验操作均正确,则所求中和热__________ (填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________ 。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________ 。(提示:ΔH=-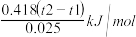 ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________ 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____ 57.3 kJ(填“大于”、“小于”或“等于”)。

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量
(4)倒入NaOH溶液的正确操作是:
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
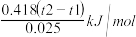 ,保留一位小数)。
,保留一位小数)。③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和热测定的实验,实验试剂及其用量如表所示。
(1)实验①中碱液过量的目的是____ 。
(2)甲同学预计ΔH1≠ΔH2,其依据是____ 。
(3)若实验测得①中终了温度为31.8℃,则该反应的中和热ΔH1=___ (已知硫酸、NaOH溶液密度近似为1.0g·cm-3,中和后混合液的比热容c=4.18J·g-1·℃-1;计算结果保留2位小数)。
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH___ (填“偏大”“偏小”或“不变”,下同)。
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q____ 。
| 反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/kJ·mol-1 | |
| 硫酸 | 碱溶液 | |||
| ①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 25.1 | 25.1 | ΔH1 | |
| ②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 25.1 | 25.1 | ΔH2 | |
(2)甲同学预计ΔH1≠ΔH2,其依据是
(3)若实验测得①中终了温度为31.8℃,则该反应的中和热ΔH1=
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】50mL 0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________ 。由图可知该装置仍有不妥之处,如不改正,求得的中和热数值会____________ (填“偏大”“偏小”“无影响”)。
(2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_______________ 。
(3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
②近似认为0.55 mol·L-1 NaOH溶液和0.50 mol·L-1盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=________ (取小数点后一位)。
(4)下列情况会使测得中和热的数值偏小的是________ (填字母)。
A.用浓硫酸代替盐酸进行上述实验
B. 用相同浓度和体积的氨水代替NaOH溶液进行上述实验
C. 用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):
(3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.1 | |
| 2 | 25.9 | 25.9 | 25.9 | 29 | |
| 3 | 27.0 | 27.4 | 27.2 | 31.7 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.2 | |
(4)下列情况会使测得中和热的数值偏小的是
A.用浓硫酸代替盐酸进行上述实验
B. 用相同浓度和体积的氨水代替NaOH溶液进行上述实验
C. 用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】宇宙中所有的一切都是能量的变化,研究化学反应中的能量变化意义重大。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热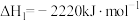 ,正丁烷的燃烧热
,正丁烷的燃烧热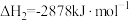 :异丁烷的燃烧热
:异丁烷的燃烧热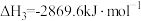 。下列有关说法正确的是
。下列有关说法正确的是_________ (填字母)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)某实验小组用0.50 NaOH溶液和0.50
NaOH溶液和0.50
 溶液进行中和热的测定。
溶液进行中和热的测定。
①实验中用到的玻璃仪器有大、小烧杯、______________________ 。
②取50mL NaOH溶液和30mL 溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。
近似认为0.50 NaOH溶液和0.50
NaOH溶液和0.50
 溶液的密度都是1
溶液的密度都是1 ,中和后混合溶液的比热容
,中和后混合溶液的比热容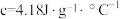 ,则△H≈
,则△H≈___________ (结果保留小数点后一位)。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
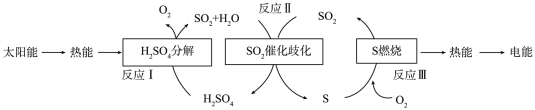
反应Ⅰ: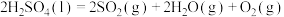

反应Ⅲ:
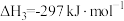
反应Ⅱ的热化学方程式:_____________________ 。
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。如图为第ⅥA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
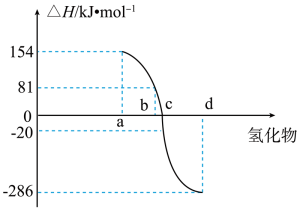
①图中a对应的氢化物是___________ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热△H的关系:____________________________________________ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为_____________________ 。(沸点:硒化氢-41.3℃;硒:6849℃)
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热
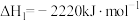 ,正丁烷的燃烧热
,正丁烷的燃烧热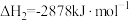 :异丁烷的燃烧热
:异丁烷的燃烧热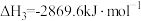 。下列有关说法正确的是
。下列有关说法正确的是A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)某实验小组用0.50
 NaOH溶液和0.50
NaOH溶液和0.50
 溶液进行中和热的测定。
溶液进行中和热的测定。①实验中用到的玻璃仪器有大、小烧杯、
②取50mL NaOH溶液和30mL
 溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。温度 实验 次数 | 起始温度 | 终止温度 | ||
| NaOH溶液 | 平均值 | ||
1 | 26.2 | 26.0 | 26.4 | 30.4 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
 NaOH溶液和0.50
NaOH溶液和0.50
 溶液的密度都是1
溶液的密度都是1 ,中和后混合溶液的比热容
,中和后混合溶液的比热容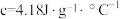 ,则△H≈
,则△H≈(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应Ⅰ:
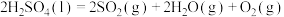

反应Ⅲ:

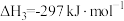
反应Ⅱ的热化学方程式:
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。如图为第ⅥA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。

①图中a对应的氢化物是
②硒化氢在上述条件下发生分解反应的热化学方程式为
您最近一年使用:0次

 /℃
/℃ /℃
/℃

