山东省青岛市五十八中2021-2022学年九年级下学期自主招生化学试题
山东
九年级
自主招生
2023-01-24
380次
整体难度:
适中
考查范围:
物质的化学变化、身边的化学物质、化学实验、物质构成的奥秘
山东省青岛市五十八中2021-2022学年九年级下学期自主招生化学试题
山东
九年级
自主招生
2023-01-24
380次
整体难度:
适中
考查范围:
物质的化学变化、身边的化学物质、化学实验、物质构成的奥秘
一、选择题 添加题型下试题
选择题-单选题
|
较易(0.85)
解题方法
1. 某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别放在表面皿中,研究它们在空气中的稳定性。该学生采用的研究方法是
①假说法 ②实验法 ③分类法 ④比较法
①假说法 ②实验法 ③分类法 ④比较法
| A.①②③④ | B.①③ | C.②④ | D.①② |
您最近一年使用:0次
2. 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是
| A.胆矾的化学式为CuSO4·5H2O | B.25g胆矾溶于100g水所得溶液溶质质量分数为20% |
| C.胆矾可作为湿法冶铜的原料 | D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应 |
您最近一年使用:0次
选择题-单选题
|
容易(0.94)
名校
解题方法
3. 下列属于置换反应的是
A.4NH3+5O2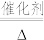 4NO+6H2O 4NO+6H2O | B.2C2H5OH+O2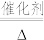 2CH3CHO+2H2O 2CH3CHO+2H2O |
| C.2Na2O2+2CO2=2Na2CO3+O2 | D.8NH3+3Cl2=6NH4Cl+N2 |
您最近一年使用:0次
2023-01-22更新
|
116次组卷
|
2卷引用:山东省青岛市五十八中2021-2022学年九年级下学期自主招生化学试题
选择题-单选题
|
较易(0.85)
解题方法
4. 某溶液中只含有Na+、Al3+、Cl-、X四种离子,已知这四种离子的个数比为3:2:5:2,则X离子可能是
A.CO | B.NO | C.SO | D.Mg2+ |
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
解题方法
5. 完成下列实验所选装置正确的是
A. 制取并收集氢气 制取并收集氢气 |
B. 测定黄铜(Cu、Zn合金)中Zn的含量 测定黄铜(Cu、Zn合金)中Zn的含量 |
C. 蒸发食盐水得NaCl晶体 蒸发食盐水得NaCl晶体 |
D. 制取氧气,随开随用,随关随停 制取氧气,随开随用,随关随停 |
您最近一年使用:0次
选择题-单选题
|
较难(0.4)
解题方法
6. 为了测定NaCl、Na2CO3·10H2O和NaHCO3的混合物中各组分的含量,青岛五十八中高一某同学设计如下实验:取一定质量的混合物,通过测量反应前后②和③装置质量的变化,测定该混合物中各组分的质量分数。下列说法中正确的是


| A.②和③中应依次盛装碱石灰和无水CaCl2 |
B.若测得②和③分别增重m2g和m3g,则混合物中Na2CO3·10H2O的质量为28.6×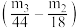 |
| C.实验时应先点燃酒精灯,再关闭b、打开a,一段时间后测定②和③的质量变化 |
| D.若将①装置换成盛有NaOH溶液的洗气瓶,则测得的NaCl含量偏小 |
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
解题方法
7. 下列选项的各组物质,不能满足下图中物质一步转化关系的是


| X | Y | Z | |
| A | Na2CO3 | NaOH | NaCl |
| B | Mg | MgO | MgCl2 |
| C | CaCO3 | CaO | Ca(OH)2 |
| D | Na2SO4 | NaOH | Na2CO3 |
| A.A | B.B | C.C | D.D |
【知识点】 盐类参与的反应解读 各类物质间反应的总结解读
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
解题方法
8. 已知铜在氯化铁溶液中发生反应: 。将Fe、Cu和FeCl2、FeCl3、CuCl2溶液置于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是
。将Fe、Cu和FeCl2、FeCl3、CuCl2溶液置于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是
 。将Fe、Cu和FeCl2、FeCl3、CuCl2溶液置于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是
。将Fe、Cu和FeCl2、FeCl3、CuCl2溶液置于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是| A.Cu、Fe2+、Fe | B.Cu、Fe3+ |
| C.Fe2+、Fe3+ | D.Cu、Cu2+、Fe |
【知识点】 金属与盐溶液反应 金属活动顺序理解和判断解读
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
解题方法
9. 某同学进行氧气的制备实验,操作如下:①按照自上而下、从左到右的顺序安装实验装置,并检查装置的气密性;②先向锥形瓶中加入约0.1g 二氧化锰,然后向分液漏斗中加入约15mL过氧化氢溶液,并将盛满水的集气瓶倒扣于水槽中;③打开分液漏斗活塞,将过氧化氢迅速加入锥形瓶中,立即收集气体,集满后用玻璃片在水面下盖住瓶口,移出水面,正放在实验台上。上述实验中存在的错误有几处?
| A.1 | B.2 | C.3 | D.4 |
【知识点】 过氧化氢制取氧气实验解读
您最近一年使用:0次
选择题-单选题
|
较难(0.4)
名校
10. 用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是

| A.Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B.CuO没有全部被还原 |
| C.Ⅱ装置中玻璃管内有水冷凝 |
| D.Ⅲ装置后缺少干燥装置 |
【知识点】 有关质量守恒定律的计算解读 氢气还原金属氧化物解读
您最近一年使用:0次
2018-05-31更新
|
662次组卷
|
8卷引用:湖北省武汉市武汉二中、广雅中学2017届九年级上学期月考(四)化学试题
二、多选题 添加题型下试题
多选题
|
较难(0.4)
解题方法
11. 碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。
步骤1:将铜粉加入稀盐酸中,并持续通入空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
下列有关说法正确的是
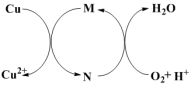
步骤1:将铜粉加入稀盐酸中,并持续通入空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
下列有关说法正确的是

| A.a、b、c 之间的关系式为:a=b+c |
| B.图中M、N分别为Fe2+、Fe3+ |
| C.步骤1中铜元素失去电子,氧元素得到电子 |
| D.制备67.5 g CuCl2,理论上消耗8 g O2 |
您最近一年使用:0次
三、选择题 添加题型下试题
选择题-单选题
|
适中(0.65)
解题方法
12. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 测定食醋的pH | 洁净的玻璃片 | 食醋、pH试纸 |
| B | 制取并收集一瓶二氧化碳气体 | 锥形瓶、分液漏斗、导管、集气瓶 | 石灰石、稀硫酸 |
| C | 除去铜粉中的杂质氧化铜 | 烧杯、玻璃棒、漏斗 | 稀硫酸 |
| D | 鉴别Na2CO3溶液和稀氢氧化钠溶液 | 试管、胶头滴管 | 酚酞溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
选择题-单选题
|
较易(0.85)
您最近一年使用:0次
2020-06-30更新
|
122次组卷
|
5卷引用:2020年江苏省盐城市滨海县中考二模化学试题
选择题-单选题
|
困难(0.15)
解题方法
14. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要的铁盐。为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:

下列说法正确的是

下列说法正确的是
| A.步骤②中可以用盐酸代替硫酸 |
| B.步骤②所需的玻璃仪器只有酒精灯、温度计、烧杯、玻璃棒 |
| C.操作⑤为加热浓缩、冷却结晶、过滤、洗涤、干燥 |
| D.采用热重分析法测定硫酸铁铵晶体样品所含结晶水数:将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。则硫酸铁铵晶体的化学式为NH4Fe(SO4)2∙10H2O |
您最近一年使用:0次
四、多选题 添加题型下试题
多选题
|
困难(0.15)
解题方法
15. 已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。青岛五十八中高一某化学小组欲探究H2C2O4溶液(无色)和酸性KMnO4溶液(紫红色)反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(假设溶液密度均为1g·cm-3,忽略溶液混合时的体积变化):
下列说法不正确的是
| 编号 | 0.1%的酸性KMnO4溶液体积/mL | 1%的H2C2O4溶液体积/mL | 水的体积/mL | 反应温度/℃ | 反应时间/min |
| Ⅰ | 2 | 2 | 0 | 20 | 2.1 |
| Ⅱ | V1 | 2 | 1 | 20 | 5.5 |
| Ⅲ | V2 | 2 | 0 | 50 | 0.5 |
| A.实验时应将H2C2O4溶液缓缓倒入酸性KMnO4溶液中 |
| B.V1=1,V2=2 |
| C.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响 |
| D.实验计时是从溶液混合开始,溶液呈紫红色时结束 |
【知识点】 常见的酸碱指示剂及其变色情况解读 盐类参与的反应解读 控制变量
您最近一年使用:0次
五、实验题 添加题型下试题
实验题
|
较难(0.4)
16. 三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和印刷,在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。某化学研究小组对K3[Fe(C2O4)3]·3H2O受热分解生成的气体产物进行探究。





(1)实验所需的装置如上图所示,A装置烧瓶中盛有饱和NH4Cl和饱和NaNO2的混合溶液,加热可生成N2。 干燥管中盛放的试剂可以是________。
(2)各装置的连接顺序为:A—_______________ (部分装置可重复使用) 。
(3)检查装置气密性后,先通一段时间N2,其目的是_____________ 。结束实验时先熄灭C处酒精灯并继续通入N2至常温,其目的是________________ 。
(4)D装置中澄清石灰水的作用是____________________ 。
(5)有同学认为该装置在实验安全方面不够严谨,并提出应该在装置末端加一个点燃的酒精灯,其目的是__________ 。





(1)实验所需的装置如上图所示,A装置烧瓶中盛有饱和NH4Cl和饱和NaNO2的混合溶液,加热可生成N2。 干燥管中盛放的试剂可以是________。
| A.无水硫酸铜 | B.熟石灰 | C.碱石灰 | D.无水CaCl2 |
(3)检查装置气密性后,先通一段时间N2,其目的是
(4)D装置中澄清石灰水的作用是
(5)有同学认为该装置在实验安全方面不够严谨,并提出应该在装置末端加一个点燃的酒精灯,其目的是
您最近一年使用:0次
六、填空与简答 添加题型下试题
填空与简答-流程题
|
较难(0.4)
解题方法
17. 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如下图所示:

相关金属离子在一定浓度时,形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中ZnS发生反应的化学方程式为______________________ 。
(2)滤渣1的主要成分有两种,除PbSO4外还有_______ (写化学式);滤渣2为Fe(OH)3,若不通入氧气,其后果是_______________________ 。
(3)溶液中的Cd 2+可用锌粉除去,还原除杂工序中反应的化学方程式为___________________ 。
(4)电解硫酸锌溶液制备单质锌时,同时生成H2SO4,沉积锌后的电解液可返回___ 工序继续使用。

相关金属离子在一定浓度时,形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe 3+ | Fe 2+ | Zn2+ | Cd 2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
(1)焙烧过程中ZnS发生反应的化学方程式为
(2)滤渣1的主要成分有两种,除PbSO4外还有
(3)溶液中的Cd 2+可用锌粉除去,还原除杂工序中反应的化学方程式为
(4)电解硫酸锌溶液制备单质锌时,同时生成H2SO4,沉积锌后的电解液可返回
您最近一年使用:0次
填空与简答-流程题
|
困难(0.15)
解题方法
18. 常温下,一氧化二氯(Cl2O)为棕黄色气体,熔点为-116℃,浓度过高时易分解爆炸。为降低风险和便于贮存,制出Cl2O后,一般将其“固化”为固态。某小组按以下两阶段制备Cl2O。
第一阶段:制备HgO 。
配制15%的NaCl溶液和30%的HgCl2溶液,将二者以一定质量比混合得到5%NaCl和20%HgCl2的混合液;在室温下,边搅拌边缓慢地向混合液中加入过量NaOH溶液,生成黄色沉淀;将沉淀反复洗涤数次,直至没有氯离子;真空抽滤后将沉淀在暗处干燥,得到干燥的HgO 。
(1)配制15%的NaCl溶液,除用到托盘天平、烧杯、玻璃棒外,还需要的玻璃仪器有______ 。
(2)配制混合液时,15%NaCl溶液和30%HgCl2溶液的质量比为______________ 。
(3)检验沉淀已经洗涤至没有氯离子的操作及现象为________________________________ 。
第二阶段:制备Cl2O 。
制备干燥、纯净的Cl2;然后在干燥的氮气气流中,用Cl2和HgO在18~20℃条件下制备Cl2O ;将产生的Cl2O气体“固化”;最后进行尾气处理。
(4)将干燥、纯净的Cl2通入下面装置中制备Cl2O并“固化”。

①制备Cl2O时还得到了HgCl2·HgO 固体,则装置Ⅰ中制备反应的化学方程式为________________ 。干燥的氮气的作用除了将产生的Cl2O 送入后续装置“固化”外,还有________________ 。
②常用冷却剂的相关数据如下表。“固化”时装置Ⅱ中的冷却剂为______ (填标号)。
A.液氯 B. 液氨 C. 液氧
第一阶段:制备HgO 。
配制15%的NaCl溶液和30%的HgCl2溶液,将二者以一定质量比混合得到5%NaCl和20%HgCl2的混合液;在室温下,边搅拌边缓慢地向混合液中加入过量NaOH溶液,生成黄色沉淀;将沉淀反复洗涤数次,直至没有氯离子;真空抽滤后将沉淀在暗处干燥,得到干燥的HgO 。
(1)配制15%的NaCl溶液,除用到托盘天平、烧杯、玻璃棒外,还需要的玻璃仪器有
(2)配制混合液时,15%NaCl溶液和30%HgCl2溶液的质量比为
(3)检验沉淀已经洗涤至没有氯离子的操作及现象为
第二阶段:制备Cl2O 。
制备干燥、纯净的Cl2;然后在干燥的氮气气流中,用Cl2和HgO在18~20℃条件下制备Cl2O ;将产生的Cl2O气体“固化”;最后进行尾气处理。
(4)将干燥、纯净的Cl2通入下面装置中制备Cl2O并“固化”。

①制备Cl2O时还得到了HgCl2·HgO 固体,则装置Ⅰ中制备反应的化学方程式为
②常用冷却剂的相关数据如下表。“固化”时装置Ⅱ中的冷却剂为
| 物质 | O2 | NH3 | Cl2 |
| 熔点/℃ | -218.4 | -77.3 | -101 |
| 沸点/℃ | -183 | -33.35 | -34.6 |
您最近一年使用:0次
填空与简答-流程题
|
较难(0.4)
解题方法
19. 工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
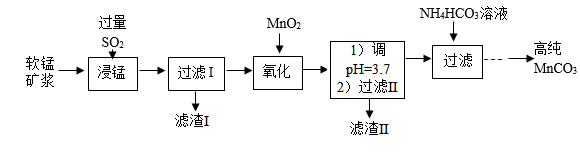
已知:MnO2+SO2=MnSO4。
(1)“浸锰”过程中Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+H2SO4=2FeSO4+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
ii.……
写出ii的化学方程式:______________________ 。
(2)“过滤Ⅰ”所得滤液中主要存在的两种金属阳离子为___________ (填离子符号)
(3)“氧化”过程中被MnO2氧化的物质有(写化学式):______________________ 。
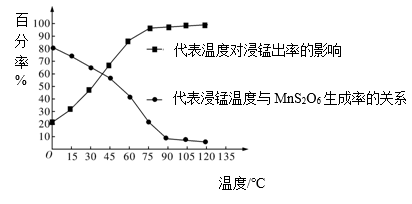
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是___________ ;向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________ 。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的化学方程式:______________ 。

已知:MnO2+SO2=MnSO4。
(1)“浸锰”过程中Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+H2SO4=2FeSO4+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
ii.……
写出ii的化学方程式:
(2)“过滤Ⅰ”所得滤液中主要存在的两种金属阳离子为
(3)“氧化”过程中被MnO2氧化的物质有(写化学式):
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的化学方程式:
您最近一年使用:0次
七、科学探究题 添加题型下试题
科学探究题
|
较难(0.4)
解题方法
20. 青岛五十八中自招班化学兴趣小组为了探究氨的性质,设计了如下实验方案。
实验一:氨气还原氧化铜,实验装置如图1所示。

已知:(ⅰ)Mg(OH)2在加热条件下与氯化铵反应,生成氨气和碱式氯化镁[Mg(OH)Cl];
(ⅱ)Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)= Cu+CuSO4+H2O。
(1)装置A中发生反应的化学方程式为__________________________________ 。
(2)反应结束后装置C中的氧化铜完全转化为红色固体,为了探究红色固体的成分,进行了如下实验探究:
实验二:氨气与铝反应,实验装置如图2所示。

已知:(ⅲ)铝可以与氨气反应:2Al+2NH3 2AlN+3H2;
2AlN+3H2;
(ⅳ)AlN性质稳定,基本不与水、酸反应,在加热时溶于浓碱可产生氨气。
按图2所示连接好装置,检查装置气密性,并加入药品,打开装置F处分液漏斗活塞,待装置中空气排尽后再点燃装置H处酒精灯。
(3)能判断铝粉反应完全的实验现象为__________ 。
(4)为了得到纯净的氮化铝,可将装置H中的固体冷却后转移至烧杯中,加入______ 溶解、______ (填操作名称)、洗涤、干燥即可。
实验一:氨气还原氧化铜,实验装置如图1所示。

已知:(ⅰ)Mg(OH)2在加热条件下与氯化铵反应,生成氨气和碱式氯化镁[Mg(OH)Cl];
(ⅱ)Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)= Cu+CuSO4+H2O。
(1)装置A中发生反应的化学方程式为
(2)反应结束后装置C中的氧化铜完全转化为红色固体,为了探究红色固体的成分,进行了如下实验探究:
| 实验操作 | 实验现象 | 实验结论 |
| 取10.4 g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | 红色固体为 |
| 若溶液变蓝 | 红色固体中肯定含有 | |
| 取上述反应后的混合物过滤、洗涤、干燥、称重 | 称得固体质量为6.4 g | 红色固体的成分及其质量为 |
实验二:氨气与铝反应,实验装置如图2所示。

已知:(ⅲ)铝可以与氨气反应:2Al+2NH3
 2AlN+3H2;
2AlN+3H2;(ⅳ)AlN性质稳定,基本不与水、酸反应,在加热时溶于浓碱可产生氨气。
按图2所示连接好装置,检查装置气密性,并加入药品,打开装置F处分液漏斗活塞,待装置中空气排尽后再点燃装置H处酒精灯。
(3)能判断铝粉反应完全的实验现象为
(4)为了得到纯净的氮化铝,可将装置H中的固体冷却后转移至烧杯中,加入
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:物质的化学变化、身边的化学物质、化学实验、物质构成的奥秘
试卷题型(共 20题)
题型
数量
选择题
13
多选题
2
实验题
1
填空与简答
3
科学探究题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、选择题 | |||
| 1 | 0.85 | 化学研究对象 金属与氧气反应 | 单选题 |
| 2 | 0.65 | 置换反应 金属与盐溶液反应 溶质质量分数概念 常见盐的俗名、用途 | 单选题 |
| 3 | 0.94 | 置换反应 | 单选题 |
| 4 | 0.85 | 有关质量守恒定律的计算 常见酸碱盐的溶解性 溶液中物质是否共存相关判断 | 单选题 |
| 5 | 0.65 | 启普发生器原理及使用 金属与酸反应原理 气体发生、收集装置 蒸发结晶 | 单选题 |
| 6 | 0.4 | 化学方程式与实验的计算 碳酸氢钠、碳酸钠、碳酸钙 盐类参与的反应 | 单选题 |
| 7 | 0.65 | 盐类参与的反应 各类物质间反应的总结 | 单选题 |
| 8 | 0.65 | 金属与盐溶液反应 金属活动顺序理解和判断 | 单选题 |
| 9 | 0.65 | 过氧化氢制取氧气实验 | 单选题 |
| 10 | 0.4 | 有关质量守恒定律的计算 氢气还原金属氧化物 | 单选题 |
| 12 | 0.65 | 制取二氧化碳的原理 酸的通性 常见的酸碱指示剂及其变色情况 溶液的酸碱性的判断与pH的测定 | 单选题 |
| 13 | 0.85 | 盐类参与的反应 | 单选题 |
| 14 | 0.15 | 结晶分离混合物 酸的通性 盐类参与的反应 过滤 | 单选题 |
| 二、多选题 | |||
| 11 | 0.4 | 用质量守恒定律确定物质组成 化合价代数和的计算与应用 金属与盐溶液反应 金属与酸反应原理 | |
| 15 | 0.15 | 常见的酸碱指示剂及其变色情况 盐类参与的反应 控制变量 | |
| 三、实验题 | |||
| 16 | 0.4 | 二氧化碳的检验、验满及净化 一氧化碳燃烧实验 碱的通性 设计实验探究物质的成分 | |
| 四、填空与简答 | |||
| 17 | 0.4 | 化学方程式的书写 金属与盐溶液反应 酸的通性 | 流程题 |
| 18 | 0.15 | 配制一定质量分数溶液的仪器 固体配制一定质量分数溶液 浓溶液稀释配制一定质量分数溶液 盐类参与的反应 | 流程题 |
| 19 | 0.4 | 化学方程式的书写 盐类参与的反应 物质推断的综合应用 | 流程题 |
| 五、科学探究题 | |||
| 20 | 0.4 | 化学方程式的书写 含杂质的化学方程式计算 酸的通性 化学变化现象的观察及描述 | |