考点14 常见溶液的定量描述和计算
全国
九年级
专题练习
2019-08-27
234次
整体难度:
适中
考查范围:
身边的化学物质、化学实验、物质的化学变化
考点14 常见溶液的定量描述和计算
全国
九年级
专题练习
2019-08-27
234次
整体难度:
适中
考查范围:
身边的化学物质、化学实验、物质的化学变化
一、填空与简答 添加题型下试题
填空与简答-简答题
|
较难(0.4)
1. 化学中有许多概念是对立的又是统一的。图(1)反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。

(1)从图14-1(1)可以看出饱和溶液与浓溶液、稀溶液的关系是_______ 、_________ 。
(2)常温下0.9%的医用生理盐水可归于图14-1(1)中_______ 区域(选填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的氯化钠溶液,若要使它变为饱和溶液,一般采用的方法是_________ 或________ 。
(3)在甲、乙、丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精充分搅拌后(保持各自的温度不变),结果如图(2)所示。
①甲烧杯中溶液可归于图14-1(1)中_______ 区域(选填“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②由以上实验可得出结论影响物质溶解度的因素有______________ 、______________ 。
③将乙烧杯中的溶液降温到 ℃时恰好达到饱和状态,硝酸钾的溶解度是
℃时恰好达到饱和状态,硝酸钾的溶解度是_________ g/100g水。再往乙烧杯中加入10g水,改变温度至 ℃时,溶液又恰好达到饱和状态,则
℃时,溶液又恰好达到饱和状态,则
________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)由上述实验可知,饱和溶液与不饱和溶液是对立的,在一定条件下又可以__________ 。

(1)从图14-1(1)可以看出饱和溶液与浓溶液、稀溶液的关系是
(2)常温下0.9%的医用生理盐水可归于图14-1(1)中
(3)在甲、乙、丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精充分搅拌后(保持各自的温度不变),结果如图(2)所示。
①甲烧杯中溶液可归于图14-1(1)中
②由以上实验可得出结论影响物质溶解度的因素有
③将乙烧杯中的溶液降温到
 ℃时恰好达到饱和状态,硝酸钾的溶解度是
℃时恰好达到饱和状态,硝酸钾的溶解度是 ℃时,溶液又恰好达到饱和状态,则
℃时,溶液又恰好达到饱和状态,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)由上述实验可知,饱和溶液与不饱和溶液是对立的,在一定条件下又可以
您最近一年使用:0次
二、选择题 添加题型下试题
选择题-单选题
|
适中(0.65)
名校
2. 60℃时,A、B两种物质的溶解度A<B。分别取60℃时等质量的A、B两种物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为m g和n g(A、B均不含结晶水)。下列判断正确的是
| A.60℃时,取任意A、B溶液,其所含溶质的质量一定为A<B |
| B.30℃时,A、B饱和溶液中溶质的质量分数一定为A<B |
| C.30℃时,溶解度A>B,则析出晶体质量一定为m<n |
| D.30℃时,溶解度A<B,则析出晶体质量分数一定为m>n |
【知识点】 固体溶解度曲线的应用解读 溶解度的相关计算解读
您最近一年使用:0次
2019-02-16更新
|
61次组卷
|
2卷引用:湖南省长沙市第一中学2017届九年级第一学期期末考试化学试题
选择题-单选题
|
适中(0.65)
3. 相同温度下,将等质量的氧化钙和氢氧化钙固体分别放入盛有等质量水的甲、乙两只烧杯中,搅拌后均完全溶解,下列说法正确的是( )
| A.所得溶液中溶质的质量:甲小于乙 | B.所得溶液的溶质质量分数:甲乙可能相同 |
| C.溶液的状态:乙一定是不饱和溶液 | D.所得溶液中溶剂的质量:甲大于乙 |
【知识点】 饱和溶液和不饱和溶液判断解读 溶质质量分数概念解读
您最近一年使用:0次
2019-08-26更新
|
200次组卷
|
3卷引用:考点14 常见溶液的定量描述和计算
三、多选题 添加题型下试题
多选题
|
适中(0.65)
4. 甲、乙的溶解度曲线如图所示,将 ℃甲、乙的饱和溶液分别降温到
℃甲、乙的饱和溶液分别降温到 ℃。下列说法中一定正确的是( )
℃。下列说法中一定正确的是( )

 ℃甲、乙的饱和溶液分别降温到
℃甲、乙的饱和溶液分别降温到 ℃。下列说法中一定正确的是( )
℃。下列说法中一定正确的是( )
| A.两溶液仍饱和 |
| B.溶质质量分数:甲>乙 |
| C.溶液质量:甲<乙 |
| D.降温度并加入溶质可以使c点变为b点 |
您最近一年使用:0次
多选题
|
适中(0.65)
5. 20℃时,将等质量的甲、乙固体(不含结晶水),分别加入盛有100g水的烧杯中,充分搅拌后现象如图14-3(1),加热到50时现象如图(2)(不考虑水分蒸发),甲、乙固体的溶解度曲线如图14-3(3)。
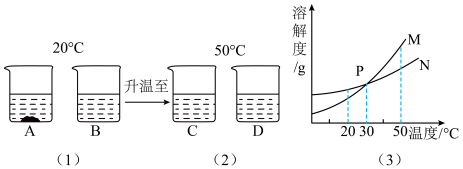
下列说法正确的是( )

下列说法正确的是( )
| A.图14-3(1)中乙溶液一定不饱和 |
| B.图14-3(2)中两溶液中溶质质量分数一定相等 |
| C.图14-3(2)中两溶液降温至30℃一定都不会析出晶体 |
| D.乙溶液中含有少量甲杂质,提纯的方法是降温结晶 |
您最近一年使用:0次
多选题
|
较难(0.4)
6. 图为某固体饱和溶液的浓度(溶质质量分数)随温度变化的曲线。该固体从溶液中析出时不带结晶水。M、N两点分别表示该固体形成的两份溶液在不同温度时的浓度,当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断正确的是( )


| A.升温10℃时,M点沿曲线向上移,N点向右平移 |
| B.加水稀释(假设温度都不变)时,M、N点均不动 |
| C.都降温10℃时,M点沿曲线向左下移,N点向左平移 |
| D.恒温蒸发溶剂时,先是M点不动,N点向上移至曲线;继续蒸发溶剂M、N点都不动 |
您最近一年使用:0次
四、填空与简答 添加题型下试题
填空与简答-简答题
|
较难(0.4)
7. 氯化钠和氯化钾都是重要的资源。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:

已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是_________ (填编号);与B溶液中溶质质量分数相等的溶液是_________ (填编号)
(2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。据图回答:

溶解度变化受温度影响最大的是_________ ;t℃时,溶解度受温度影响最小的是_________ ;t℃时,将25g硒酸镉加入_________ g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是_______________ 。
(3)某温度下甲、乙两个烧杯中各盛有100g相同浓度的 溶液,现将甲烧杯中的溶液蒸发掉35g水,析出晶体5g;乙烧杯中的溶液蒸发掉45g水,析出
溶液,现将甲烧杯中的溶液蒸发掉35g水,析出晶体5g;乙烧杯中的溶液蒸发掉45g水,析出 晶体10g。则该温度下
晶体10g。则该温度下 的溶解度为
的溶解度为__________ ;原溶液的溶质质量分数为__________ ;若将甲烧杯中的溶液配制成溶质质量分数为2%的植物营养液,需加水__________ g。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:

已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是
(2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。据图回答:

溶解度变化受温度影响最大的是
(3)某温度下甲、乙两个烧杯中各盛有100g相同浓度的
 溶液,现将甲烧杯中的溶液蒸发掉35g水,析出晶体5g;乙烧杯中的溶液蒸发掉45g水,析出
溶液,现将甲烧杯中的溶液蒸发掉35g水,析出晶体5g;乙烧杯中的溶液蒸发掉45g水,析出 晶体10g。则该温度下
晶体10g。则该温度下 的溶解度为
的溶解度为
您最近一年使用:0次
填空与简答-简答题
|
较难(0.4)
8. 溶解和结晶是生活中的常见现象。
(1)下表是 、
、 不同温度下的溶解度(单位:g/100g水)(两者溶解度互不影响)
不同温度下的溶解度(单位:g/100g水)(两者溶解度互不影响)
①20℃时将20g 放入50g水中溶解所得溶液的质量是
放入50g水中溶解所得溶液的质量是________ g。量取水时应沿________ 视线(选填如图14-8所示量筒的局部示意图中“a”或“b”)进行读数;________ 视线(选填“a”或“b”)对应的读数较大。

②图14-9是 、
、 在饱和溶液中溶质的质量分数随温度变化的曲线。现将
在饱和溶液中溶质的质量分数随温度变化的曲线。现将 、
、 各35g分别溶于150g水中并同时加热,分别蒸发掉50g水,冷却到
各35g分别溶于150g水中并同时加热,分别蒸发掉50g水,冷却到 ℃时是否有晶体析出,简述理由:
℃时是否有晶体析出,简述理由:_______ ;冷却到 ℃时析出晶体的成分及其质量是
℃时析出晶体的成分及其质量是________ 。

③ 溶液中含有少量
溶液中含有少量 杂质时,可通过
杂质时,可通过____________ 的方法提纯。
④对③析出的晶体和剩余溶液描述正确的是____________ (填写编号)
A 剩余溶液一定是 饱和溶液 B 剩余溶液一定是
饱和溶液 B 剩余溶液一定是 不饱和溶液
不饱和溶液
C 上述方法可以将两者完全分离 D 析出的晶体中只含有
⑤在一定温度下,将含69g ,18g
,18g 的混合物完全溶解在50g水中。改变温度使
的混合物完全溶解在50g水中。改变温度使 析出,
析出, 不析出,则温度t(℃)的范围是
不析出,则温度t(℃)的范围是____________ 。
⑥A是80℃含有120g水的 溶液。经过如下结晶操作,得到102g
溶液。经过如下结晶操作,得到102g 固体。
固体。

对以上过程的分析,正确的是__________ (选填编号)
A A到B的过程中,溶质质量没有改变 B B中溶质与溶剂的质量比为169∶100
C 在60℃至80℃之间开始析出 固体 D A溶液为不饱和溶液,其质量为253.6g
固体 D A溶液为不饱和溶液,其质量为253.6g
(2)用硫酸铜进行如图所示的实验,完成下列填空(用编号表示)。

①所得三个溶液中:一定属于饱和溶液的是_________ ,溶液中溶剂质量的大小关系是_________ 。
②20℃时,在上述A的滤液中加入a g无水硫酸铜,恢复至原温度可析出b g硫酸铜晶体。下列分析正确的是_________ 。
A 溶液中溶剂的量不变,颜色不变 B b g硫酸铜晶体中含硫酸铜的质量大于a g
C 溶液的浓度不变,颜色也不变 D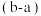 g表示原溶液损失的溶质质量
g表示原溶液损失的溶质质量
③若在上述C中( )加入 m g
)加入 m g  或加入 n g
或加入 n g  均可使溶液达到饱和,则m与n的关系是
均可使溶液达到饱和,则m与n的关系是__________________ 。(用代数式表示)
(1)下表是
 、
、 不同温度下的溶解度(单位:g/100g水)(两者溶解度互不影响)
不同温度下的溶解度(单位:g/100g水)(两者溶解度互不影响)| 温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 |
 | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
①20℃时将20g
 放入50g水中溶解所得溶液的质量是
放入50g水中溶解所得溶液的质量是
②图14-9是
 、
、 在饱和溶液中溶质的质量分数随温度变化的曲线。现将
在饱和溶液中溶质的质量分数随温度变化的曲线。现将 、
、 各35g分别溶于150g水中并同时加热,分别蒸发掉50g水,冷却到
各35g分别溶于150g水中并同时加热,分别蒸发掉50g水,冷却到 ℃时是否有晶体析出,简述理由:
℃时是否有晶体析出,简述理由: ℃时析出晶体的成分及其质量是
℃时析出晶体的成分及其质量是
③
 溶液中含有少量
溶液中含有少量 杂质时,可通过
杂质时,可通过④对③析出的晶体和剩余溶液描述正确的是
A 剩余溶液一定是
 饱和溶液 B 剩余溶液一定是
饱和溶液 B 剩余溶液一定是 不饱和溶液
不饱和溶液C 上述方法可以将两者完全分离 D 析出的晶体中只含有

⑤在一定温度下,将含69g
 ,18g
,18g 的混合物完全溶解在50g水中。改变温度使
的混合物完全溶解在50g水中。改变温度使 析出,
析出, 不析出,则温度t(℃)的范围是
不析出,则温度t(℃)的范围是⑥A是80℃含有120g水的
 溶液。经过如下结晶操作,得到102g
溶液。经过如下结晶操作,得到102g 固体。
固体。
对以上过程的分析,正确的是
A A到B的过程中,溶质质量没有改变 B B中溶质与溶剂的质量比为169∶100
C 在60℃至80℃之间开始析出
 固体 D A溶液为不饱和溶液,其质量为253.6g
固体 D A溶液为不饱和溶液,其质量为253.6g(2)用硫酸铜进行如图所示的实验,完成下列填空(用编号表示)。

①所得三个溶液中:一定属于饱和溶液的是
②20℃时,在上述A的滤液中加入a g无水硫酸铜,恢复至原温度可析出b g硫酸铜晶体。下列分析正确的是
A 溶液中溶剂的量不变,颜色不变 B b g硫酸铜晶体中含硫酸铜的质量大于a g
C 溶液的浓度不变,颜色也不变 D
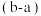 g表示原溶液损失的溶质质量
g表示原溶液损失的溶质质量③若在上述C中(
 )加入 m g
)加入 m g  或加入 n g
或加入 n g  均可使溶液达到饱和,则m与n的关系是
均可使溶液达到饱和,则m与n的关系是
您最近一年使用:0次
填空与简答-简答题
|
适中(0.65)
9. 溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中温度下降。这种物质是________ (填字母)。
A 氯化钠 B 硝酸铵 C 氢氧化钠 D 浓硫酸
(2)在实验室里配制55g10%的氯化钠溶液,操作如图所示,回答下列问题:

①请用图中的序号表示配制溶液的正确操作顺序___________ 。
②认真观察,改正图中的错误操作_______________ 。若不进行改正,其他操作步骤正确,则所配制溶液的溶质的质量分数_________ (填“大于”“小于”或“等于”)10%。
③步骤⑤需要量取水_________ mL,若量取水时采用俯视的方法读数,会导致所配溶液的溶质质量分数_________ (填“偏大”“偏小”或“无影响”)
④用15%的氯化钠溶液浸泡瓜果片刻可以起到消毒作用。要使上述氯化钠溶液的溶质质量分数变为15%,可采取的简便方法是____________ 。
(3)某注射用药液的配制方法如下:先把1.0g药品溶于水配制成4.0mL溶液a;再取0.1mL溶液a,加水稀释至1.0mL,得溶液b;然后取0.1mL溶液b加水稀释至1.0mL,得溶液c;最后取0.4mL溶液c,加水稀释至1.0mL,得溶液d。由于在整个配制过程中药液很稀,其密度都可近似看作 。则最终得到的药液(溶液d)中溶质的质量分数为
。则最终得到的药液(溶液d)中溶质的质量分数为___________ 。
(1)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中温度下降。这种物质是
A 氯化钠 B 硝酸铵 C 氢氧化钠 D 浓硫酸
(2)在实验室里配制55g10%的氯化钠溶液,操作如图所示,回答下列问题:

①请用图中的序号表示配制溶液的正确操作顺序
②认真观察,改正图中的错误操作
③步骤⑤需要量取水
④用15%的氯化钠溶液浸泡瓜果片刻可以起到消毒作用。要使上述氯化钠溶液的溶质质量分数变为15%,可采取的简便方法是
(3)某注射用药液的配制方法如下:先把1.0g药品溶于水配制成4.0mL溶液a;再取0.1mL溶液a,加水稀释至1.0mL,得溶液b;然后取0.1mL溶液b加水稀释至1.0mL,得溶液c;最后取0.4mL溶液c,加水稀释至1.0mL,得溶液d。由于在整个配制过程中药液很稀,其密度都可近似看作
 。则最终得到的药液(溶液d)中溶质的质量分数为
。则最终得到的药液(溶液d)中溶质的质量分数为
您最近一年使用:0次
五、综合应用题 添加题型下试题
综合应用题
|
适中(0.65)
10. 在含氯化钠杂质的某工业纯碱样品13.6g中逐渐加入溶质质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示:

(1)配制100g上述稀盐酸需要量取36.5%浓盐酸(密度1.20g/mL)________ mL和水( )
)________ mL。
(2)该纯碱样品所含碳酸钠的质量分数为________ 。
(3)完全反应后,所得溶液留作学生分组实验用,请将其溶质成分及其质量分数填写在右图标签上________ 。

(1)配制100g上述稀盐酸需要量取36.5%浓盐酸(密度1.20g/mL)
 )
)(2)该纯碱样品所含碳酸钠的质量分数为
(3)完全反应后,所得溶液留作学生分组实验用,请将其溶质成分及其质量分数填写在右图标签上
您最近一年使用:0次
六、选择题 添加题型下试题
选择题-单选题
|
适中(0.65)
11. 将40℃的饱和石灰水冷却到10℃,或加入少量生石灰但温度仍保持40℃,这两种情况下均不改变的是()
A. 的溶解度 的溶解度 | B.溶液的溶质质量分数 |
| C.溶质的质量 | D.溶液中Ca元素的质量 |
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
12. 室温时,将0.56g氧化钙加入1000g氢氧化钙的饱和溶液中,充分反应后,恢复至原温度,过滤(假设固体没有损失)、洗涤、烘干,滤渣的质量可能是( )
| A.0.77g | B.0.74g | C.0.59g | D.0.56g |
【知识点】 不含杂质的化学方程式计算解读 固体溶解度的影响因素解读
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
13. 如右图所示,20℃时100g硫酸铜饱和溶液中,分别加入下列物质后,相关分析错误的是
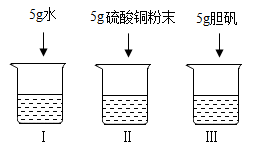

| A.溶质质量:Ⅰ=Ⅲ>Ⅱ | B.溶剂质量:Ⅰ>Ⅲ>Ⅱ |
| C.溶液质量:Ⅰ>Ⅱ=Ⅲ | D.溶质质量分数:Ⅰ<Ⅱ=Ⅲ |
您最近一年使用:0次
2016-11-28更新
|
269次组卷
|
3卷引用:2016届上海市虹口区九年级上学期期末教学质量监控化学试卷
选择题-单选题
|
适中(0.65)
14. 如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述或应用正确的是( )


| A.30℃时M的溶解度小于N的溶解度 |
| B.N中混有少量M时采用蒸发结晶进行提纯 |
| C.P点表示M、N两种固体物质的溶解度相等 |
| D.阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液 |
您最近一年使用:0次
选择题-单选题
|
适中(0.65)
15. ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示.下列说法正确的是( )


| A.ZnSO4饱和溶液的溶质质量分数随温度升高而增大 |
| B.点A对应的ZnSO4溶液是不饱和溶液 |
| C.点B对应的ZnSO4溶液升温或降温均能达到饱和 |
| D.40℃时,ZnSO4的溶解度为41g |
您最近一年使用:0次
2016-11-28更新
|
664次组卷
|
9卷引用:2015年初中毕业升学考试(江苏南通卷)化学
七、多选题 添加题型下试题
多选题
|
较难(0.4)
16. t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成图中的斜线。下列说法正确的是( )


| A.该物质的溶解度随温度的升高而增大 |
| B.t℃时该物质的溶解度为50g |
C.溶液中溶质质量分数的关系是: |
| D.n点表示溶液中溶质的质量分数为25% |
您最近一年使用:0次
八、选择题 添加题型下试题
17. 20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是

| A.图丙中M表示b的溶解度曲线 |
| B.图甲溶液中溶质的质量分数a大于b |
| C.图乙中a、b溶液一定是不饱和溶液 |
| D.30℃时a、b溶液溶质质量分数不相等 |
您最近一年使用:0次
2016-11-28更新
|
2118次组卷
|
41卷引用:2015届北京市朝阳区九年级综合练习(一)化学试卷
2015届北京市朝阳区九年级综合练习(一)化学试卷2015届北京市朝阳区九年级5月综合练习(一)化学试卷2015年初中毕业升学考试(内蒙古呼和浩特卷)化学人教版2018届九年级下册化学同步练习:第九单元 滚动小专题(二) 溶解度曲线的应用人教版(河南专版)2018届九年级下册化学同步练习:第九单元 滚动小专题(二) 溶解度曲线的应用广东省广州市第二中学2018届九年级3月月考化学试题北京市门头沟区2018年九年级二模化学试题【市级联考】山东省威海市乳山市(五四制)2019届九年级上学期期末考试化学试题山东省莱芜市莱城区腰关中学2019届九年级上学期第二次月考化学试题江苏省南通市北城中学2019届九年级下学期3月阶段性练习化学试题山东省青岛市第三十九中学2019届九年级下学期4月中考模拟化学试题【市级联考】山东省青岛市2019届九年级下学期中考模拟化学试题北京市怀柔区2019年九年级一模化学试题山东省泰安市新泰市2019届九年级下学期中考二模化学试题考点14 常见溶液的定量描述和计算2020中考化学章节强化训练——专题十二:溶液备战2020中考化学考题专项训练——溶液2019年甘肃省泾川市中考模拟化学试题2020年北京市海淀区首都师大二附中中考零模化学试题(已下线)2019年北京各城区一模化学试题分类汇编—选择题(图形图像图表题分析)(已下线)【万唯原创】2016年河南省中考化学试题研究卷九年级第九单元(已下线)【万唯原创】2020年河南省中考化学预测卷大题加练题型一2020年安徽省合肥市瑶海区中考三模化学试题2020年安徽省宿州市砀山县中考三模化学试题(已下线)【万唯原创】2016年陕西省中考化学面对面卷(科广版)九年级练习册第七章(已下线)【万唯原创】2016年山西省中考化学试题研究卷模块一第6讲(已下线)【万唯原创】2016年山西省中考化学面对面卷九年级练习册第九单元(已下线)6.3 物质的溶解性-2020-2021学年九年级化学下册课时同步练(沪教版)人教版 初中化学 考点14 常见溶液的定量描述和计算2021年5月山东省威海市乳山市(五四制)中考模拟化学试题安徽省黄山市歙县武阳中学2018届九年级中考一模化学试题黑龙江省化学虎林市云山农场中心学校2021-2022学年九年级上学期期末化学试题2022年安徽省铜陵市中考模拟化学试题2022年湖北省孝感黄冈咸宁三市中考适应性考试化学试题(三)黑龙江省大庆市肇源县第四中学2021-2022学年九年级3月月考化学试题2022年内蒙古兴安盟乌兰浩特市初中毕业生学业模拟化学试题2023年湖北省黄冈孝感咸宁三市初中学业考试适应性试化学试题(三)山西省临汾市襄汾县第二中学2022-2023学年九年级下学期期中化学试题2023年河北省沧州市南皮县桂和中学中考模拟化学试题2024年安徽省芜湖市第二十九中学中考第一次模拟考试化学试卷安徽省六安市轻工中学2023-2024学年九年级下学期4月期中化学试题
18. A、B、C三种物质的溶解度曲线如图5所示。下列分析正确的是

| A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等 |
| B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1∶3 |
| C.将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A |
| D.将C的饱和溶液变为不饱和溶液,可采用升温的方法 |
您最近一年使用:0次
2016-11-28更新
|
1178次组卷
|
53卷引用:2015年初中毕业升学考试(江苏苏州卷)化学
2015年初中毕业升学考试(江苏苏州卷)化学2016届山东省济宁市曲阜市姚村镇中学九年级上学期期末化学试卷2016届江苏省泰州市泰兴市济川中学九年级下第一次月考化学试卷2016届四川省仁寿县华兴联谊学校九年级下学期4月一诊考试化学试卷2016届四川省广安市邻水县九年级综合测试一化学试卷2016届江苏省句容市、丹阳市中考网上阅卷模拟训练化学试卷2017届江西省抚州市崇仁县第二中学九年级下学期第一次月考化学试卷2017届江苏省常州市金坛区九年级下学期(3月)教学情况调研化学试卷山东省淄博市博山区2017届九年级中考一模化学试题四川省成都市师大一中2018届九年级中考模拟化学试题鲁教版2018届九年级下册化学同步练习:期中测试江苏省常熟市2018届九年级上学期期末考试化学试题江苏省泰兴市济川中学2018届九年级3月阶段性考试化学试题【全国市级联考】江苏省徐州市2018届九年级第一次模拟考试化学试题湖南省张家界市武陵源二中2019届九年级下学期期中考试化学试题【区级联考】山东省淄博市博山区2019届九年级下学期中考一模化学试题新疆温宿县塔格拉克牧场中学2019届九年级下学中考二模化学试题云南省红河州开远市2019届九年级下学期中考一模化学试题湖南省永州市2019届九年级下学期中考二模化学试题第二章 大考点二 综合应用训练考点14 常见溶液的定量描述和计算2016年山东省泰安市肥城市中考一模化学试题广西贵港市桂平市2017-2018学年九年级上学期期末化学试题江西省南昌市红谷滩新区红谷滩实验学校2018-2019学年九年级上学期期末化学试题2019年5月山东省济宁市梁山县马营镇初级中学中考模拟化学试题2020年湖南省衡阳市雁峰区船山实验中学中考模拟化学试题2020年5月江苏省南京市高淳区中考一模化学试题河北省沧州市青县2017-2018学年九年级上学期期末化学试题河北省沧州市青县2018-2019学年九年级上学期期末化学试题(已下线)【万唯原创】2017年河北省中考化学面对面卷九年级第九单元(已下线)【万唯原创】2016年河北省中考化学面对面卷练习册九年级第九单元(已下线)【万唯原创】2016年河南省中考化学试题研究卷九年级第九单元(已下线)【万唯原创】2017年河南省中考化学面对面卷九年级专题六(已下线)【万唯原创】2017年河南省中考化学试题研究卷九年级专题六(已下线)【万唯原创】2016年安徽省中考化学面对面卷九年级练习册第九单元专项训练2020年湖北省恩施州宣恩县民族实验中学中考模拟化学试题(已下线)【万唯原创】2016年安徽省中考化学试题研究卷精练本命题点72020年江苏省苏州市昆山市三校联合调研化学试题2020年江苏省苏州市昆山市中考模拟化学试题(5月份)人教版 初中化学 考点14 常见溶液的定量描述和计算广东省清远市清新区凤霞中学2020-2021学年九年级下学期开学考试化学试题2021年江苏省苏州市中考一模化学试题2021年江苏省无锡市宜兴市实验中学中考三模化学试题2016年江苏省镇江市句容市、丹徒区中考二模化学试题(已下线)(人教版)2021年中考化学第二次模拟考试(已下线)必刷卷01-2021年中考化学考前信息必刷卷(南京专用)2021年新疆乌鲁木齐市重点初中中考二模化学试题2018年内蒙古呼伦贝尔市海拉尔区铁路第三中学中考二模化学试题2018年云南省普洱市澜沧县中考三模化学试题黑龙江省齐齐哈尔市龙江县部分学校联考2023-2024学年九年级上学期第三次月考化学试题第6章 第3节 物质的溶解性-九年级下册初三化学【能力拓展练习】上教版2024年黑龙江省部分学校第一次模拟化学试题四川省眉山市松峰学校2023——2024学年九年级下学期期中物理化学试题 -初中化学
九、填空与简答 添加题型下试题
填空与简答-填空题
|
适中(0.65)
19. 下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
①从上表数据可以看出,氢氧化钙的溶解度随温度的升高而________________ 。
②40℃时,将20g水配成氢氧化钠饱和溶液,需氢氧化钠的质量为______ 克。若将40℃时422克的氢氧化钠饱和溶液稀释为20%的溶液,需加水__________ 克。
③80℃时含有Ca(OH)2和NaOH两种溶质的饱和溶液,若要从中得到较纯净的NaOH晶体,应采取的物理方法是________________ 。
④现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液), 此时甲乙两杯溶液中_________ 。

A甲的溶质的质量分数与乙的相同
B甲的溶质的质量分数大于乙的
C甲的溶质的质量小于乙的
D甲、乙都是饱和溶液
| 温度/℃ | 0 | 20 | 40 | 80 | 100 | |
| 溶解度/ g/100g水 | Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.094 | 0.076 |
| NaOH | 31 | 91 | 111 | 313 | 336 | |
②40℃时,将20g水配成氢氧化钠饱和溶液,需氢氧化钠的质量为
③80℃时含有Ca(OH)2和NaOH两种溶质的饱和溶液,若要从中得到较纯净的NaOH晶体,应采取的物理方法是
④现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液), 此时甲乙两杯溶液中

A甲的溶质的质量分数与乙的相同
B甲的溶质的质量分数大于乙的
C甲的溶质的质量小于乙的
D甲、乙都是饱和溶液
您最近一年使用:0次
填空与简答-简答题
|
较难(0.4)
20. 甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示。

(1)20℃时,三种物质的溶解度由大到小依次为_________ 。
(2)取甲、乙、丙中的某一种固体进行如下所示的实验。

①溶液a的溶质质量分数是_________ 。(精确到0.1%)
②取用的固体是_________ ;温度t的范围是_________ 。
③关于溶液d和溶液e的说法错误的是_________ 。
A.溶质质量可能相等 B.溶液d中溶质质量可能大于溶液e
C.溶液的溶质质量分数可能相同 D.溶解度可能变大
(3)向100g50℃的水中加入45g乙固体,发现全部溶解,一段时间后又有部分乙的晶体析出。你认为“全部溶解”的原因可能是_________ 。

(1)20℃时,三种物质的溶解度由大到小依次为
(2)取甲、乙、丙中的某一种固体进行如下所示的实验。

①溶液a的溶质质量分数是
②取用的固体是
③关于溶液d和溶液e的说法错误的是
A.溶质质量可能相等 B.溶液d中溶质质量可能大于溶液e
C.溶液的溶质质量分数可能相同 D.溶解度可能变大
(3)向100g50℃的水中加入45g乙固体,发现全部溶解,一段时间后又有部分乙的晶体析出。你认为“全部溶解”的原因可能是
您最近一年使用:0次
十、实验题 添加题型下试题
实验题
|
适中(0.65)
21. 配制并稀释一定质量分数的 溶液。
溶液。
(1)配制50g质量分数为6%的 溶液:①计算:需要
溶液:①计算:需要 3.0g,水4.0g;②称量:用托盘天平称量3.0g的
3.0g,水4.0g;②称量:用托盘天平称量3.0g的 。天平调零后,分别在天平左右托盘放上质量相同的纸片,先
。天平调零后,分别在天平左右托盘放上质量相同的纸片,先__________________ ,然后___________ ,至托盘天平恰好平衡;③量取:用量筒量取47.0mL水。请在图(1)中画出47.0mL水的液面位置______________ ;④溶解:若采用图(2)所示操作可能产生的后果是______________ 。

(2)稀释溶液:(由于整个配制过程中溶液很稀,其密度可近似看作1g/mL)①取1mL6%的 溶液加水稀释至100mL,得到溶液a;②若用3.0g
溶液加水稀释至100mL,得到溶液a;②若用3.0g 配制与溶液a浓度相同的溶液,其体积是
配制与溶液a浓度相同的溶液,其体积是________ mL。
 溶液。
溶液。(1)配制50g质量分数为6%的
 溶液:①计算:需要
溶液:①计算:需要 3.0g,水4.0g;②称量:用托盘天平称量3.0g的
3.0g,水4.0g;②称量:用托盘天平称量3.0g的 。天平调零后,分别在天平左右托盘放上质量相同的纸片,先
。天平调零后,分别在天平左右托盘放上质量相同的纸片,先
(2)稀释溶液:(由于整个配制过程中溶液很稀,其密度可近似看作1g/mL)①取1mL6%的
 溶液加水稀释至100mL,得到溶液a;②若用3.0g
溶液加水稀释至100mL,得到溶液a;②若用3.0g 配制与溶液a浓度相同的溶液,其体积是
配制与溶液a浓度相同的溶液,其体积是
您最近一年使用:0次
2019-08-26更新
|
235次组卷
|
3卷引用:考点14 常见溶液的定量描述和计算
考点14 常见溶液的定量描述和计算(已下线)《单元测试定心卷》第三单元 溶液(基础过关)-2020-2021学年九年级化学上册单元测试定心卷(鲁教版)人教版 初中化学 考点14 常见溶液的定量描述和计算
十一、综合应用题 添加题型下试题
综合应用题
|
较难(0.4)
22. 海水是一种宝贵的资源。



(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含 外还含有
外还含有 、
、 等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是
等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是_________ 。
A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是
B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是 和
和
D.20°时向40g 固体和40g
固体和40g 固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_________ g。
(3)海水中的硼酸(化学式为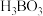 )可用于玻璃业,下表为硼酸的部分溶解度数据。
)可用于玻璃业,下表为硼酸的部分溶解度数据。
①由表可知,硼酸的溶解度随着温度的升高而_________ (填“增大”“减小”或“不变”)。
②60℃时,100g硼酸饱和溶液中含有硼酸_________ g(保留整数)。
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是_________ (用“甲”“乙”“丙”表示)
b.若要达到实验目的,需改变实验甲中的一个条件是_________ (填编号)。
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含 ,
, 、
、 )200g,向溶液中先滴加足量的
)200g,向溶液中先滴加足量的_________ ,充分反应后,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,测得模拟海水中氯元素的质量分数为_________ %(保留三位小数)。



(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含
 外还含有
外还含有 、
、 等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是
等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是

B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是
 和
和
D.20°时向40g
 固体和40g
固体和40g 固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为
(3)海水中的硼酸(化学式为
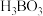 )可用于玻璃业,下表为硼酸的部分溶解度数据。
)可用于玻璃业,下表为硼酸的部分溶解度数据。| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/(g/100g水) | 3 | 5 | 9 | 15 | 23 |
①由表可知,硼酸的溶解度随着温度的升高而
②60℃时,100g硼酸饱和溶液中含有硼酸
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是
b.若要达到实验目的,需改变实验甲中的一个条件是
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含
 ,
, 、
、 )200g,向溶液中先滴加足量的
)200g,向溶液中先滴加足量的
您最近一年使用:0次
2019-08-26更新
|
369次组卷
|
4卷引用:考点14 常见溶液的定量描述和计算
考点14 常见溶液的定量描述和计算人教版 初中化学 考点14 常见溶液的定量描述和计算(已下线)2021年福建省中考化学真题变式汇编(已下线)第九单元 溶液(B卷能力提升练)-【单元测试】2022-2023学年九年级化学下册分层训练AB卷(广东专用)
综合应用题
|
较难(0.4)
23. 实验小组测定某敞口放置的氢氧化钠溶液的变质情况,实验并记录如图所示。

(1)用36.5%浓盐酸(密度1.2g/mL)配制250g上述稀盐酸的操作方法是_______ 。
(2)C烧杯溶液中溶质的成分及其质量是______________ 。
(3)原样品溶液中氢氧化钠的质量分数是_________ ;氢氧化钠变质的百分率为_________ 。
(4)向E烧杯内加入54.4g水,所得溶液中溶质的质量分数为__________________ (只列式,不计算)

(1)用36.5%浓盐酸(密度1.2g/mL)配制250g上述稀盐酸的操作方法是
(2)C烧杯溶液中溶质的成分及其质量是
(3)原样品溶液中氢氧化钠的质量分数是
(4)向E烧杯内加入54.4g水,所得溶液中溶质的质量分数为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:身边的化学物质、化学实验、物质的化学变化
试卷题型(共 23题)
题型
数量
填空与简答
6
选择题
9
多选题
4
综合应用题
3
实验题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、填空与简答 | |||
| 1 | 0.4 | 饱和溶液和不饱和溶液的转换 固体溶解度概念 固体溶解度曲线的应用 | 简答题 |
| 7 | 0.4 | 固体溶解度概念 固体溶解度曲线的应用 固体溶解度的影响因素 | 简答题 |
| 8 | 0.4 | 固体溶解度概念 固体溶解度曲线的应用 溶解度的相关计算 量筒的正确使用方法和注意事项 | 简答题 |
| 9 | 0.65 | 溶解时能量的变化 固体配制一定质量分数溶液 配制一定溶质质量分数的计算 | 简答题 |
| 19 | 0.65 | 结晶分离混合物 饱和溶液和不饱和溶液的转换 溶解度的相关计算 溶质质量分数的涵义 | 填空题 |
| 20 | 0.4 | 饱和溶液和不饱和溶液的转换 固体溶解度曲线的应用 固体溶解度的影响因素 溶解度的相关计算 | 简答题 |
| 二、选择题 | |||
| 2 | 0.65 | 固体溶解度曲线的应用 溶解度的相关计算 | 单选题 |
| 3 | 0.65 | 饱和溶液和不饱和溶液判断 溶质质量分数概念 | 单选题 |
| 11 | 0.65 | 饱和溶液和不饱和溶液的转换 固体溶解度的影响因素 溶质质量分数概念 | 单选题 |
| 12 | 0.65 | 不含杂质的化学方程式计算 固体溶解度的影响因素 | 单选题 |
| 13 | 0.65 | 饱和溶液和不饱和溶液判断 溶解度的相关计算 溶质质量分数的涵义 | 单选题 |
| 14 | 0.65 | 饱和溶液和不饱和溶液判断 固体溶解度曲线的应用 固体溶解度的影响因素 | 单选题 |
| 15 | 0.65 | 固体溶解度曲线的应用 固体溶解度的影响因素 溶解度的相关计算 溶质质量分数的涵义 | 单选题 |
| 17 | 0.4 | 固体溶解度曲线的应用 固体溶解度的影响因素 溶解度的相关计算 溶质质量分数的涵义 | 单选题 |
| 18 | 0.65 | 饱和溶液和不饱和溶液的转换 固体溶解度曲线的应用 溶解度的相关计算 图像分析溶质质量分数的变化 | 单选题 |
| 三、多选题 | |||
| 4 | 0.65 | 饱和溶液和不饱和溶液判断 固体溶解度曲线的应用 溶质质量分数的涵义 | |
| 5 | 0.65 | 饱和溶液和不饱和溶液的转换 固体溶解度曲线的应用 固体溶解度的影响因素 | |
| 6 | 0.4 | 固体溶解度曲线的应用 固体溶解度的影响因素 溶质质量分数的涵义 | |
| 16 | 0.4 | 固体溶解度曲线的应用 固体溶解度的影响因素 溶质质量分数的涵义 | |
| 四、综合应用题 | |||
| 10 | 0.65 | 含杂质的化学方程式计算 化学方程式与实验的计算 配制一定溶质质量分数的计算 | |
| 22 | 0.4 | 含杂质的化学方程式计算 固体溶解度曲线的应用 固体溶解度的影响因素 溶质质量分数的涵义 | |
| 23 | 0.4 | 含杂质的化学方程式计算 化学方程式与实验的计算 碱的通性 碳酸氢钠、碳酸钠、碳酸钙 | |
| 五、实验题 | |||
| 21 | 0.65 | 固体配制一定质量分数溶液 配制一定溶质质量分数的计算 | |



