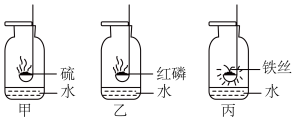
多种物质都可催化过氧化氢分解,如 MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是 NaClO 和 NaCl)、FeCl3、K2SO4能否催化过氧化 氢分解。
(1)MnO2催化过氧化氢分解的符号表达式是______ 。
(2)如图所示,分别向三支试管中多次加入 5%过氧化氢溶液,每次 2mL,如有气泡产生, 则将______ 伸入试管,检验是否有氧气生成。结果如下表。
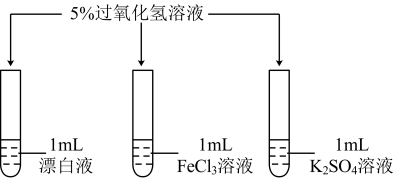
请填写上述表格中的①______ ②______ 。
(3)由上述表格分析,下列物质中也可能是过氧化氢分解催化剂的是______(填下列标号)。
(4)探究不同催化剂催化效果的实验方案:将等体积 5%过氧化氢溶液加到不同催化剂中,比较用排水法收集 50mL 氧气的快慢。请从下图中选择合适的 仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是______ (填标号)。

(1)MnO2催化过氧化氢分解的符号表达式是
(2)如图所示,分别向三支试管中多次加入 5%过氧化氢溶液,每次 2mL,如有气泡产生, 则将

| 研究对象 | 第1次 | 第2次 | 第3次 | 第4次 |
| 漂白液 | 大量气泡 | 较多气泡 | 少量气泡 | 无气泡 |
| FeCl3溶液 | 较多气泡 | 较多气泡 | 较多气泡 | 较多气泡 |
| K2SO4溶液 | ①______ | / | / | / |
| 实验结论 | i、实验中产生的气体都是氧气。 (查阅得知:  ) )ii、K2SO4不能催化过氧化氢分解。 iii、②______可能是过氧化氢分解的催化剂。 iv……。 | |||
(3)由上述表格分析,下列物质中也可能是过氧化氢分解催化剂的是______(填下列标号)。
| A.CuCl2 | B.Fe2(SO4)3 | C.Na2SO4 | D.NaCl |
(4)探究不同催化剂催化效果的实验方案:将等体积 5%过氧化氢溶液加到不同催化剂中,比较用排水法收集 50mL 氧气的快慢。请从下图中选择合适的 仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是

更新时间:2021-11-09 23:27:57
|
相似题推荐
实验题
|
适中
(0.65)
【推荐1】如图是实验室制取氧气及氧气的化学性质部分实验装置,请回答下列问题。

(1)实验室过氧化氢溶液和二氧化锰混合制氧气发生反应的符号表达式是:________ 。为了气流平稳且氧气较纯,选择制取和收集氧气的装置组合可以是________ (填字母);若用环保空塑料输液袋G装置收集氧气,验满的方法是________ 。
(2)排水法收集了三瓶氧气,如图是硫、木条、铁丝三种物质在氧气中的燃烧,回答问题:
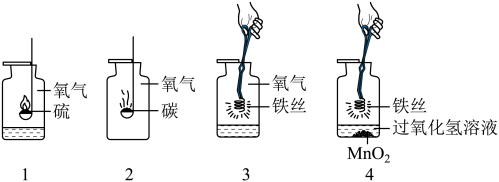
①.1号瓶底放水的作用是________ 。
②.在空气中点燃木炭后,再将其伸入2号瓶中,对比在空气与氧气中燃烧的剧烈程度不同,其原因是________ 。
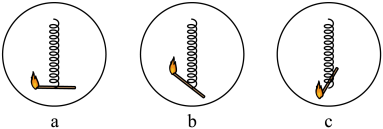
③.如图是进行3号瓶实验时的几种操作,更能提高实验成功率的方式是________ ;(填编号)3号瓶中反应的符号表达式是________ 。
(3)某研究小组以过氧化氢溶液为原料,探究制取氧气的适宜催化剂。实验方案如下:在试管中加入20mL5%H2O2溶液,分别取等质量的重铬酸钾(K2C2O7)、CuO、Fe2O3三种物质放在锥形瓶中,采用如图实验装置进行实验,并记录锥形瓶内压强随时间变化的曲线图。

①为了证明CuO是催化剂,除了上述实验,还需要设计实验证明:________ 。
②根据实验结果,小明认为在实验室用过氧化氢溶液制取氧气实验中,应选择重铬酸钾作为催化剂。你是否同意他的观点,并说明理由________ 。

(1)实验室过氧化氢溶液和二氧化锰混合制氧气发生反应的符号表达式是:
(2)排水法收集了三瓶氧气,如图是硫、木条、铁丝三种物质在氧气中的燃烧,回答问题:

①.1号瓶底放水的作用是
②.在空气中点燃木炭后,再将其伸入2号瓶中,对比在空气与氧气中燃烧的剧烈程度不同,其原因是
③.如图是进行3号瓶实验时的几种操作,更能提高实验成功率的方式是

(3)某研究小组以过氧化氢溶液为原料,探究制取氧气的适宜催化剂。实验方案如下:在试管中加入20mL5%H2O2溶液,分别取等质量的重铬酸钾(K2C2O7)、CuO、Fe2O3三种物质放在锥形瓶中,采用如图实验装置进行实验,并记录锥形瓶内压强随时间变化的曲线图。

①为了证明CuO是催化剂,除了上述实验,还需要设计实验证明:
②根据实验结果,小明认为在实验室用过氧化氢溶液制取氧气实验中,应选择重铬酸钾作为催化剂。你是否同意他的观点,并说明理由
您最近一年使用:0次
实验题
|
适中
(0.65)
名校
【推荐2】实验室开放日,化学兴趣小组的同学自拟研究主题,对过氧化氢分解反应及催化剂做研究:
(1)小红的实验方案为:
她要探究的问题是 _______________ 。
通过实验,她得出结论的依据是________ 。
(2)小明的实验报告如图所示
小明通过分析数据,得出的结论是 ___________ 。
(3)小刚的探究过程如下:
①[问题]问题氧化镁能不能作过氧化氢分解的催化剂呢?
②[猜想]氧化镁能作过氧化氢分解的催化剂.
③[实验验证]请填写好实验中的空格
(4)[结论]氧化镁能加快过氧化氢的分解速率,故氧化镁能作过氧化氢分解的催化剂。
实验结束后,小组同学进行了交流讨论,认为小刚的猜想还不能得到证实,理由是____________ 。
(1)小红的实验方案为:
| 催化剂 反应时间/s 过氧化氢 | 3g氧化铜 | 3g氧化铁 | 3g二氧化锰 | 3g氧化铝 |
| 10%过氧化氢溶液10mL | t1 | t2 | t3 | t4 |
通过实验,她得出结论的依据是
(2)小明的实验报告如图所示
| 浓度用量 反应时间(min) 条件 | 30%H2O210mL | 15%H2O210mL | 5%H2O210mL |
| 加入agMnO2 | 0.2 | 0.7 | 2.0 |
(3)小刚的探究过程如下:
①[问题]问题氧化镁能不能作过氧化氢分解的催化剂呢?
②[猜想]氧化镁能作过氧化氢分解的催化剂.
③[实验验证]请填写好实验中的空格
| 验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 溶液中有少量气泡,木条不复燃 | 常温下过氧化氢溶液不分解 | |
| 实验二 | 在装10ml15%H2O2溶液的试管中加入少量氧化镁,然后将带火星的木条伸入试管中 | 溶液中产生大量气泡,木条复燃 | 氧化镁能加快过氧化氢的分解速率 |
实验结束后,小组同学进行了交流讨论,认为小刚的猜想还不能得到证实,理由是
您最近一年使用:0次
实验题
|
适中
(0.65)
真题
解题方法
【推荐3】CuSO4是化学实验中常见试剂。
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的CuSO4溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有CuSO4溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为m1。
步骤2:将铁钉浸入到CuSO4溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有CuSO4溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为m2
①用砂纸将铁钉打磨干净的作用是_______ 。
②步骤2中可观察到明显的实验现象是_______ 。该变化可说明Fe和Cu的金属活动性由强到弱的顺序是_______ 。
③若m1=m2,可证明参加反应的Fe和CuSO4的质量总和等于_______ 。
(2)探究CuSO4溶液对H2O2分解具有催化作用。
①若要证明CuSO4溶液对H2O2分解具有催化作用,除需证明CuSO4在反应前后化学性质和质量不发生改变外,还需证明的是_______ 。
②为探究CuSO4在反应前后质量是否发生改变,某同学设计如下实验:
向H2O2溶液中滴入10ga%的CuSO4溶液,待反应完全后,向试管中加入足量的BaCl2溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为bg。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物bg计算出溶液中CuSO4的质量_______ 0.1ag。(填“大于”或“小于”或“等于”)
(3)将16.0gCuSO4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
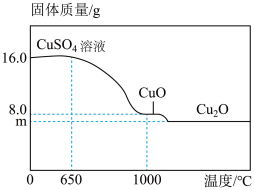 ①650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为
①650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为_______ 。
②1000℃时,CuO开始发生分解反应,生成Cu2O和O2.计算图中m的值____ 。(写出计算过程)
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的CuSO4溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有CuSO4溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为m1。
步骤2:将铁钉浸入到CuSO4溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有CuSO4溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为m2
①用砂纸将铁钉打磨干净的作用是
②步骤2中可观察到明显的实验现象是
③若m1=m2,可证明参加反应的Fe和CuSO4的质量总和等于
(2)探究CuSO4溶液对H2O2分解具有催化作用。
①若要证明CuSO4溶液对H2O2分解具有催化作用,除需证明CuSO4在反应前后化学性质和质量不发生改变外,还需证明的是
②为探究CuSO4在反应前后质量是否发生改变,某同学设计如下实验:
向H2O2溶液中滴入10ga%的CuSO4溶液,待反应完全后,向试管中加入足量的BaCl2溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为bg。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物bg计算出溶液中CuSO4的质量
(3)将16.0gCuSO4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
 ①650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为
①650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为②1000℃时,CuO开始发生分解反应,生成Cu2O和O2.计算图中m的值
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐1】如图是实验室制取气体的常用装置。
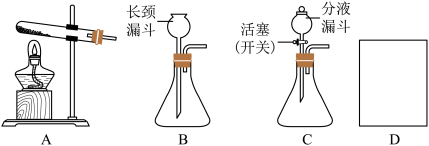
(1)写出用B装置制取O2的符号表达式___ 。
(2)B和C装置均可制取O2,与B相比较,C的主要优点是什么___ ?
(3)用试管采用排空气法收集H2,请在D处方框中画出装置图(只画试管和导气管)

(1)写出用B装置制取O2的符号表达式
(2)B和C装置均可制取O2,与B相比较,C的主要优点是什么
(3)用试管采用排空气法收集H2,请在D处方框中画出装置图(只画试管和导气管)
您最近一年使用:0次
实验题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室常用下列装置制取气体,请你根据所学知识回答下列问题:
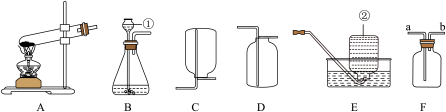
(1)请写出标号仪器的名称:①_________ ②_________ 。
(2)如果在实验室中用氯酸钾和二氧化锰制取并收集比较纯净的氧气,可选择上述_________ (填字母)装置组合进行,你选择的发生装置需要进行改正的是_________ ,请写出该反应的文字或符号表达式_________ 。
(3)如果选用B装置制取氧气,则用到的药品有_________ ,若用F装置进行收集时,氧气应从_________ 端通入(填字母编号)。
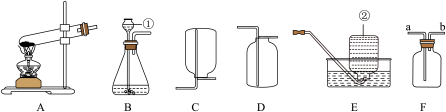
(1)请写出标号仪器的名称:①
(2)如果在实验室中用氯酸钾和二氧化锰制取并收集比较纯净的氧气,可选择上述
(3)如果选用B装置制取氧气,则用到的药品有
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐1】下面是实验室制取气体的几种发生装置和收集装置。请回答下列问题:
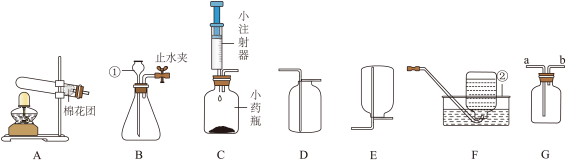
(1)仪器名称①_______ ②_______ 。
(2)实验室用双氧水和二氧化锰制取并收集较纯净的氧气时,应选用的装置是______ (填字母);
(3)某同学利用生活中的物品设计图C装置,该装置与B相比其优点是_______ 。
(4)利用G装置收集氧气,验满时将带火星的木条放在_______ (填“a”或“b”)处。
(5)实验室常用醋酸钠固体和碱石灰固体混合加热制备甲烷(CH4)气体,发生装置应选用____ 。

(1)仪器名称①
(2)实验室用双氧水和二氧化锰制取并收集较纯净的氧气时,应选用的装置是
(3)某同学利用生活中的物品设计图C装置,该装置与B相比其优点是
(4)利用G装置收集氧气,验满时将带火星的木条放在
(5)实验室常用醋酸钠固体和碱石灰固体混合加热制备甲烷(CH4)气体,发生装置应选用
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐2】下图是实验室制取气体的常用装置,请回答下列问题
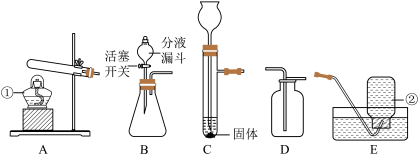
(1)写出仪器的名称:①______ ;②______ ;
(2)实验室用高锰酸钾制取氧气时选择A装置,需如何改进装置________________________ ;写出该反应的文字或符号表达式__________________ ;加热高锰酸钾时试管口略向下倾斜的原因是_________ ;
(3)若选用过氧化氢溶液制取氧气,实验过程要控制反应速率,请选择一套实验装置______ (填序号);写出反应的文字或符号表达式________________________ ;若用E装置收集氧气,当观察到________________ 时,就可以开始收集了。
(4)计算:15.8g高锰酸钾中氧元素的质量。

(1)写出仪器的名称:①
(2)实验室用高锰酸钾制取氧气时选择A装置,需如何改进装置
(3)若选用过氧化氢溶液制取氧气,实验过程要控制反应速率,请选择一套实验装置
(4)计算:15.8g高锰酸钾中氧元素的质量。
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐3】根据图示回答下列问题。
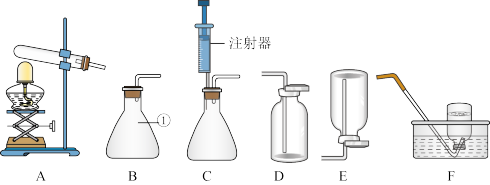
(1)仪器①的名称是_________ ;
(2)实验室用A装置制取氧气的化学反应符号表达式为_______________________ ;
(3)实验室常温下用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学反应符号表达式为_________ ;为能得到平稳的氧气流,且收集到纯净的氧气,应选择的发生装置和收集装置是_____ 。
(4)已知甲烷(CH4)是一种无色无味、密度比空气小、难溶于水的气体,实验室常用加热无水硫酸铜与碱石灰的混合物来制取,则实验室制取甲烷的发生装置为_________ 。

(1)仪器①的名称是
(2)实验室用A装置制取氧气的化学反应符号表达式为
(3)实验室常温下用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学反应符号表达式为
(4)已知甲烷(CH4)是一种无色无味、密度比空气小、难溶于水的气体,实验室常用加热无水硫酸铜与碱石灰的混合物来制取,则实验室制取甲烷的发生装置为
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐1】通过学习,我们已经掌握了实验室制取气体的方法,请根据下图回答问题:
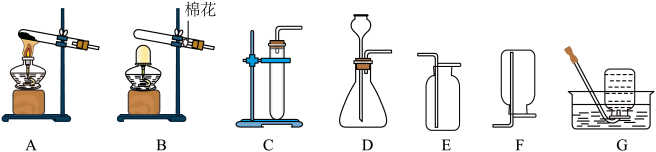
(1)实验室用氯酸钾制氧气,发生装置可选择______ (填标号,下同);反应方程式为:______ ,用过氧化氢制取氧气,发生装置可选择______ ,发生反应的化学方程式为______ ;用高锰酸钾制氧气,制取装置的连接顺序为______ 。
(2)实验室制取二氧化碳装置的连接顺序为______ ,检验二氧化碳是否收集满的方法是______ 。
(3)在实验室可以用锌粒和稀硫酸来制取氢气,装置的连接顺序为______ ,反应的化学方程式为______ 。
(4)已知:相同条件下,氨气(NH3)的密度比空气小,且极易溶于水。加热氯化铵(NH4Cl)和氢氧化钙固体混合物可制得氨气,同时得到氯化钙和水。则制取氨气的装置连接顺序是______ (填序号)

(1)实验室用氯酸钾制氧气,发生装置可选择
(2)实验室制取二氧化碳装置的连接顺序为
(3)在实验室可以用锌粒和稀硫酸来制取氢气,装置的连接顺序为
(4)已知:相同条件下,氨气(NH3)的密度比空气小,且极易溶于水。加热氯化铵(NH4Cl)和氢氧化钙固体混合物可制得氨气,同时得到氯化钙和水。则制取氨气的装置连接顺序是
您最近一年使用:0次
实验题
|
适中
(0.65)
名校
【推荐2】根据下列实验装置图,回答问题:
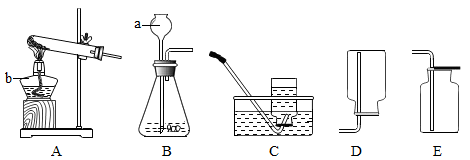
(1)实验仪器的名称:a、_____ 、b_____ 。
(2)实验室用分解过氧化氢溶液来制取氧气的发生装置是_____ (填序号),反应的文字表达式是_____ ,如果用E装置收集氧气,检验氧气收集满的方法是_____ 。
(3)实验室用分解高锰酸钾来制取氧气的发生装置是_____ (填序号),反应的文字表达式是_____ ,还可以用C装置来收集氧气,其原因是_____ 。

(1)实验仪器的名称:a、
(2)实验室用分解过氧化氢溶液来制取氧气的发生装置是
(3)实验室用分解高锰酸钾来制取氧气的发生装置是
您最近一年使用:0次