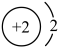海洋是人类的母亲,是人类千万年来取之不尽、用之不竭的巨大资源宝库。海洋资源开发前景十分广阔。
(1)镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。下图为从海水或卤水中制取单质镁的转化过程,试回答下列问题:_______ (填化学式)。
②流程图中发生分解反应的化学方程式为_______ 。
(2)海水“制碱”是以食盐、二氧化碳为原料,以氨为媒介,采用氨碱法制得的。我国化学家侯德榜先生在氨碱法的基础上,创立了更为先进的侯氏制碱法,促进了世界制碱技术的发展。其生产过程中有下列反应:_______ (填化学式)。
②工业生产过程中,在第②步生成碳酸氢钠和氯化铵,为什么碳酸氢钠先从溶液中析出_______ 。
③从酸碱反应的角度分析,下列选项中最易吸收二氧化碳的是_______ (填字母序号)。
A.水 B.氨盐水 C.稀盐酸
(3)现有Na2CO3和NaCl的固体混合物15g,将其放入一只干净的烧杯中,加入足量的水使其完全溶解。再向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,反应过程中产生气体的质量与滴入稀盐酸的质量关系如图所示。试回答:______ (写化学式)。
②当滴入上述稀盐酸至图中B点时恰好反应,试通过计算此时所得不饱和溶液中溶质的质量______ (计算结果精确至0.1g)。
(1)镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。下图为从海水或卤水中制取单质镁的转化过程,试回答下列问题:
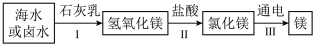
②流程图中发生分解反应的化学方程式为
(2)海水“制碱”是以食盐、二氧化碳为原料,以氨为媒介,采用氨碱法制得的。我国化学家侯德榜先生在氨碱法的基础上,创立了更为先进的侯氏制碱法,促进了世界制碱技术的发展。其生产过程中有下列反应:

②工业生产过程中,在第②步生成碳酸氢钠和氯化铵,为什么碳酸氢钠先从溶液中析出
③从酸碱反应的角度分析,下列选项中最易吸收二氧化碳的是
A.水 B.氨盐水 C.稀盐酸
(3)现有Na2CO3和NaCl的固体混合物15g,将其放入一只干净的烧杯中,加入足量的水使其完全溶解。再向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,反应过程中产生气体的质量与滴入稀盐酸的质量关系如图所示。试回答:
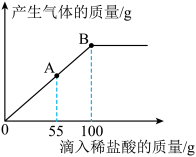
②当滴入上述稀盐酸至图中B点时恰好反应,试通过计算此时所得不饱和溶液中溶质的质量
更新时间:2024-04-12 11:39:50
|
相似题推荐
填空与简答-填空题
|
适中
(0.65)
名校
解题方法
【推荐1】随着经济的发展,能源与环境成为人们日益关注的问题。
(1)煤、石油、_______ 常称为化石燃料。
(2)燃煤发电时,将煤块粉碎成煤粉,其目的是_______ 。
(3)化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体。为减少它的排放,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷。该反应的化学方程式为_______ 。
(4)“绿色化学”的特点之一是“零排放”。一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物。其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,这种产物是 (填字母序号)。
(5)一氧化碳和二氧化碳的混合气体3.2g通过足量灼热氧化铜粉末,充分反应,将所得的气体全部通入足量的氢氧化钙溶液中,气体全部被吸收,生成白色碳酸钙沉淀,溶液质量减少5.6g。则原混合气体中碳、氧元素的质量比为_______ (填最简比)。
(1)煤、石油、
(2)燃煤发电时,将煤块粉碎成煤粉,其目的是
(3)化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体。为减少它的排放,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷。该反应的化学方程式为
(4)“绿色化学”的特点之一是“零排放”。一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物。其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,这种产物是 (填字母序号)。
| A.甲醇CH4O | B.甲酸CH2O2 |
| C.乙醇C2H6O | D.乙酸C2H4O2 |
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
解题方法
【推荐2】碳酸锶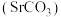 是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90%
是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90%  ,少量
,少量 、
、 、
、 等)制备高纯碳酸锶的工艺流程如图:
等)制备高纯碳酸锶的工艺流程如图:
①不溶性碳酸盐高温下可以分解,生成金属氧化物和 气体。可溶性碳酸盐高温不分解。
气体。可溶性碳酸盐高温不分解。
②可溶性碱(如:NaOH)中金属元素(Na)形成的氧化物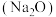 才能与水反应生成对应的碱(NaOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
才能与水反应生成对应的碱(NaOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表 :
请回答以下问题:
(1)氢氧化锶的化学式为______ 。
(2)菱锶矿、焦炭混合后,为使得反应速率加快可行的方法是______ 。
(3)滤渣1含有焦炭、Cu(OH)2和______ 。
(4)“结晶”采用的是______ 结晶法,“沉锶”反应中氢氧化锶和 发生反应,产物除了碳酸锶外 ,还有水和一水合氨,该反应温度控制在65~80℃,其不低于65℃且不高于80℃的原因是
发生反应,产物除了碳酸锶外 ,还有水和一水合氨,该反应温度控制在65~80℃,其不低于65℃且不高于80℃的原因是______ 。
(5)锶铁氧体是由锶和铁的氧化物组成的符合磁性材料。要制备某种锶铁氧体(化学式为SrO·6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失理论上至少需要含 80%的菱锶矿石多少
80%的菱锶矿石多少______ t?
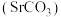 是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90%
是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90%  ,少量
,少量 、
、 、
、 等)制备高纯碳酸锶的工艺流程如图:
等)制备高纯碳酸锶的工艺流程如图: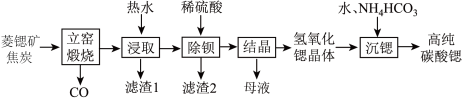
①不溶性碳酸盐高温下可以分解,生成金属氧化物和
 气体。可溶性碳酸盐高温不分解。
气体。可溶性碳酸盐高温不分解。②可溶性碱(如:NaOH)中金属元素(Na)形成的氧化物
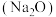 才能与水反应生成对应的碱(NaOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
才能与水反应生成对应的碱(NaOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表 :
| 温度/℃ | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度/(g/100g) | 12.5 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)氢氧化锶的化学式为
(2)菱锶矿、焦炭混合后,为使得反应速率加快可行的方法是
(3)滤渣1含有焦炭、Cu(OH)2和
(4)“结晶”采用的是
 发生反应,产物除了碳酸锶外 ,还有水和一水合氨,该反应温度控制在65~80℃,其不低于65℃且不高于80℃的原因是
发生反应,产物除了碳酸锶外 ,还有水和一水合氨,该反应温度控制在65~80℃,其不低于65℃且不高于80℃的原因是(5)锶铁氧体是由锶和铁的氧化物组成的符合磁性材料。要制备某种锶铁氧体(化学式为SrO·6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失理论上至少需要含
 80%的菱锶矿石多少
80%的菱锶矿石多少
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
解题方法
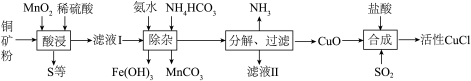
【推荐3】CuCl常用作有机合成催化剂,实验室以初级铜矿粉【主要成分为硫化亚铜(Cu2S)及少量Fe2O3等】为原料制备活性CuCl,实验过程如下:
【资料】
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有_____ (任写一点);“酸浸”过程中发生的化学反应有: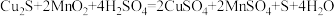 ;
;_____ (写化学反应方程式)。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因_____ 。
(2)除杂过程中加足量氨水的作用有:①_____ ;②_____ ;③_____ 。
(3)①“分解”实验条件及现象如下表所示:
则“分解”实验条件应选_____ (填字母)。
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,图中倒置漏斗的作用是_____ 。

(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、 (填字母)。
(5)若要制得99.5gCuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克?(请写出计算过程,结果保留到小数点后一位)

【资料】
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有
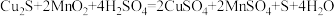 ;
;(2)除杂过程中加足量氨水的作用有:①
(3)①“分解”实验条件及现象如下表所示:
| 温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
| A | 110 | 101.3 | 60 | 浅蓝色 |
| B | 100 | 74.6 | 40 | 很浅 |
| C | 90 | 60.0 | 30 | 无色透明 |
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,图中倒置漏斗的作用是

(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、 (填字母)。
| A.真空干燥 | B.在氩气中干燥 | C.在空气中烘干 |
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
解题方法
【推荐1】喷泉是一种常见的自然现象,在化学实验中也经常可以形成美丽的喷泉。
(1)在图1的装置中,倒置于铁架台的圆底烧瓶中充满干燥的氨气,连接在瓶塞上的导管伸入到装有稀硫酸的烧杯中,用胶头滴管向烧瓶内加入少量水后,打开止水夹,可以观察到烧瓶内形成喷泉。请写出烧瓶内发生的中和反应_________ 。
(2)利用图1装置实验,下列组合中可以形成喷泉的有________ 。
aHCl气体和NaOH溶液 bO2和NaOH溶液
cCO2和 Ca(OH)2溶液 dCO2和NaOH溶液
(3)利用图2装置实验,也能成功引发喷泉。则玻璃套管中的固体是____________ 。
a氢氧化钙 b氯化钠 c活性炭 d氧化铜

(1)在图1的装置中,倒置于铁架台的圆底烧瓶中充满干燥的氨气,连接在瓶塞上的导管伸入到装有稀硫酸的烧杯中,用胶头滴管向烧瓶内加入少量水后,打开止水夹,可以观察到烧瓶内形成喷泉。请写出烧瓶内发生的中和反应
(2)利用图1装置实验,下列组合中可以形成喷泉的有
aHCl气体和NaOH溶液 bO2和NaOH溶液
cCO2和 Ca(OH)2溶液 dCO2和NaOH溶液
(3)利用图2装置实验,也能成功引发喷泉。则玻璃套管中的固体是
a氢氧化钙 b氯化钠 c活性炭 d氧化铜
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
解题方法
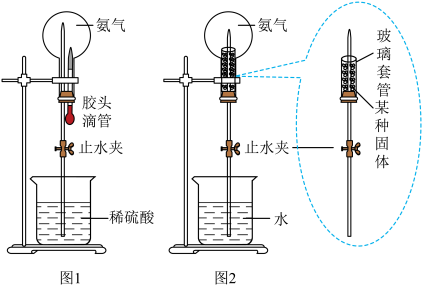
【推荐2】从微观视角认识物质世界是学习化学的重要思维方式。
(1)分子总是在不断运动。图1实验中可观察到的现象是______________ 。
(2)金属钠与氯气反应生成氯化钠,反应的微观示意图如图2所示。据此可知,氯化钠是由______ (填“分子”“原子”或“离子”)构成的物质;原子的__________ 与元素的化学性质关系最密切。
(3)复分解反应的微观实质是离子之间相互作用生成沉淀、气体或水。图3是氢氧化钠溶液与稀盐酸反应的微观示意图,该反应的微观实质是_________ ;据此分析,下列各组物质能在同一个反应中生成的是_______ 。
A、 、
、 B、
B、 、
、
C、 、
、 D、
D、 、
、

(1)分子总是在不断运动。图1实验中可观察到的现象是
(2)金属钠与氯气反应生成氯化钠,反应的微观示意图如图2所示。据此可知,氯化钠是由
(3)复分解反应的微观实质是离子之间相互作用生成沉淀、气体或水。图3是氢氧化钠溶液与稀盐酸反应的微观示意图,该反应的微观实质是
A、
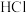 、
、 B、
B、 、
、
C、
 、
、 D、
D、 、
、
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
解题方法
【推荐1】用符合要求物质的序号填空。
①氯化钠 ②小苏打 ③干冰 ④聚乙烯
(1)可用于治疗胃酸过多的是_________ 。
(2)用于包装食品的合成材料的是_________ 。
(3)可用于配制生理盐水的是__________ 。
(4)可用于人工降雨的是__________ 。
①氯化钠 ②小苏打 ③干冰 ④聚乙烯
(1)可用于治疗胃酸过多的是
(2)用于包装食品的合成材料的是
(3)可用于配制生理盐水的是
(4)可用于人工降雨的是
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
真题
解题方法
【推荐2】物质的性质决定用途。请从①金刚石 ②铜 ③氢氧化钙 ④干冰 ⑤小苏打⑥氯化钠中选择适当物质填空(填序号)。
(1)用作导线的是_____ 。
(2)用于治疗胃酸过多症的是_____ 。
(3)用作制冷剂的是_____ 。
(4)用作改良酸性土壤的是_____ 。
(5)用作地质勘探钻头的是_____ 。
(1)用作导线的是
(2)用于治疗胃酸过多症的是
(3)用作制冷剂的是
(4)用作改良酸性土壤的是
(5)用作地质勘探钻头的是
您最近一年使用:0次
填空与简答-推断题
|
适中
(0.65)
解题方法
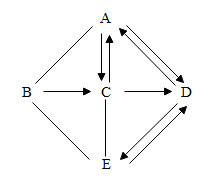
【推荐3】“你好,冬奥会”主题班会课上,小晴同学设计了下图所示的“奥运五环”图案。图中A~E为初中化学常见的物质,其中相交两环中的物质能相互反应(题中所涉及反应均为初中常见的化学反应)。已知B、C、D、E分别属于不同类别的化合物,C浓溶液具有吸水性,B和C反应可得到蓝色溶液,E俗称纯碱。

(1)E的化学式为__________ 。
(2)D属于物质类别中的__________ (选填“酸”、“碱”、“盐”或“氧化物”)。
(3)B与C发生反应的化学方程式为_________ 。
(4)若A~E分别通过一步反应能直接转化为X(X与冰的化学性质相同),则“奥运五环”可破冰而出,物质A可能是__________ (填序号、双选)。
①氢气 ②碳 ③盐酸 ④铁

(1)E的化学式为
(2)D属于物质类别中的
(3)B与C发生反应的化学方程式为
(4)若A~E分别通过一步反应能直接转化为X(X与冰的化学性质相同),则“奥运五环”可破冰而出,物质A可能是
①氢气 ②碳 ③盐酸 ④铁
您最近一年使用:0次
填空与简答-推断题
|
适中
(0.65)
解题方法
【推荐1】如图所示,A为一种混合气体 (两种物质组成的),经分析只含2种元素,根据图中转化关系完成下列空白 (假设每步反应均完全)
(1)写出下列物质的化学式:该混合气体A是由_____ 和 _____ 组成的
(2)写出下列转化的学方程式:C→D_____ ,E→B _____ 。

(1)写出下列物质的化学式:该混合气体A是由
(2)写出下列转化的学方程式:C→D
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
解题方法
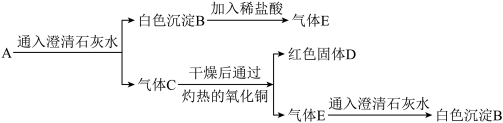
【推荐2】已知某粗盐样品中含有氯化钙、硫酸镁等杂质。为制得纯净的氯化钠,进行如下操作:
(1)若X溶液中只有一种溶质,请写出加入X溶液时反应的化学方程式_____ 。
(2)该方案仍有不完善之处,请补充____ 。

(1)若X溶液中只有一种溶质,请写出加入X溶液时反应的化学方程式
(2)该方案仍有不完善之处,请补充
您最近一年使用:0次
【推荐3】宏观和微观相结合是认识物质结构与性质的重要方法。
(1)下表列出了四种粒子结构示意图:
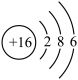
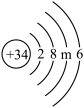
①氦原子剥去电子留下的氦核称为α粒子,α粒子的化学符号为_________________ 。
②上表中化学性质相似的粒子有__________ (填编号)。
③硒原子结构示意图中m =______ 。硒与镁形成的化合物的化学式为_____________ 。
(2)如图是碳酸钠与硫酸氢钾两种溶液的反应微观示意图,该反应中实际参加反应的粒子是___________________ 。___________ 。
②写出物质Z通过中和反应生成K2S的化学方程式:_____________ 。
(1)下表列出了四种粒子结构示意图:
| 编号 | A | B | C | D |
| 元素种类 | 氦 | 镁 | 硫 | 硒(Se) |
| 结构示意图 |
|
|
|
|
②上表中化学性质相似的粒子有
③硒原子结构示意图中m =
(2)如图是碳酸钠与硫酸氢钾两种溶液的反应微观示意图,该反应中实际参加反应的粒子是
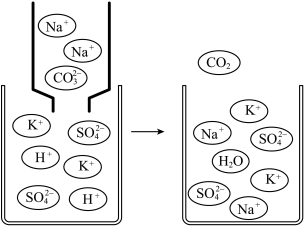
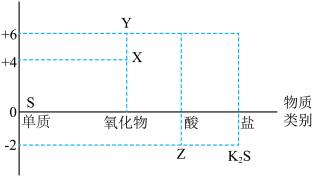
②写出物质Z通过中和反应生成K2S的化学方程式:
您最近一年使用:0次