在学完氧气的实验室制法后,老师给小明同学布置任务:通过实验证明“二氧化锰是过氧化氢分解的催化剂”。小明设计并完成下表所示的探究实验:
(1)请你帮小明同学填写上表中未填完的空格。
(2)老师认为仅由上述实验还不能完全得出表内的“总结”,他建议小明同学补充设计了两个方面的探究实验,最终证明了“二氧化锰是过氧化氢的催化剂”。
①第一方面的实验操作中包含了两次固体的称量,其目的是____________________________ ;
②第二方面的实验目的是_______________________________________ 。
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 结论 | 总结 | |||
| 实验一 | 取5 mL、5%的过氧化氢溶液于试管中,并伸入带火星的木条 | 有细小的气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是反应速率很慢 | 氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向上述实验一的试管中加入 | |||
(1)请你帮小明同学填写上表中未填完的空格。
(2)老师认为仅由上述实验还不能完全得出表内的“总结”,他建议小明同学补充设计了两个方面的探究实验,最终证明了“二氧化锰是过氧化氢的催化剂”。
①第一方面的实验操作中包含了两次固体的称量,其目的是
②第二方面的实验目的是
更新时间:2017-08-29 19:03:31
|
相似题推荐
科学探究题
|
适中
(0.65)
【推荐1】请从下列仪器中选用适当仪器用过氧化氢溶液与二氧化锰制取并收集氧气。
(1)仪器e的名称是______ ;
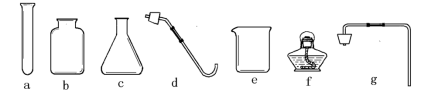
(2)若用排空气法收集O2,产生并收集气体应该选用的仪器有(填代号)______ ;装入药品前必须进行的一步操作是______ ;
(3)反应的符号表达式为______ ;
(4)检验氧气是否已经集满的方法是______ ;
(5)提出问题:小明同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥地板上,发现有大量气泡产生。小明联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡、冲洗、干燥,并进行以下探究。
猜想:水泥块能作过氧化氢分解的催化剂。
实验验证:
结论:水泥块能加快过氧化氢的分解速率,故水泥块能作过氧化氢分解的催化剂。
讨论与反思:小莉认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:
(6)实验步骤:
①准确称量水泥块的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,______ ,______ ;
④对比反应前后水泥块质量。
分析:如果水泥块反应前后质量不变,则说明水泥块可作过氧化氢分解的催化剂
(7)但小华认为,要证明小明的猜想,小莉的补充实验还是不足够,还需要再补充一个探究实验:探究水泥块的______ 在化学反应前后是否改变。
(1)仪器e的名称是

(2)若用排空气法收集O2,产生并收集气体应该选用的仪器有(填代号)
(3)反应的符号表达式为
(4)检验氧气是否已经集满的方法是
(5)提出问题:小明同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥地板上,发现有大量气泡产生。小明联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡、冲洗、干燥,并进行以下探究。
猜想:水泥块能作过氧化氢分解的催化剂。
实验验证:
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 木条不复燃 | 常温下过氧化氢溶液不分解 | |
实验二 | 在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 | 木条复燃 |
结论:水泥块能加快过氧化氢的分解速率,故水泥块能作过氧化氢分解的催化剂。
讨论与反思:小莉认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:
(6)实验步骤:
①准确称量水泥块的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,
④对比反应前后水泥块质量。
分析:如果水泥块反应前后质量不变,则说明水泥块可作过氧化氢分解的催化剂
(7)但小华认为,要证明小明的猜想,小莉的补充实验还是不足够,还需要再补充一个探究实验:探究水泥块的
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
(1)上述实验应测量的“待测数据”是_____ ;
(2)若实验②比实验①的“待测数据”更_____ (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率;
(3)将实验②反应后的剩余固体,进行一些实验操作,得到氧化铜,质量为0.5g,
再将黑色粉末放入试管中,加入_____ (填药品质量和名称),加热,测定实验数据,发现数据与实验②相同。
【结论】氧化铜还能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是_____ 。
(4)下列关于催化剂的说法正确的是_____ (填序号)。
a.催化剂必定加快反应速率
b.同一个化学反应的催化剂可以有多种
c.在酿造工业和制药工业,一般都要用酶做催化剂
d.在过氧化氢制氧气时,只有加入催化剂,过氧化氢才反应产生氧气
【提出问题】氧化铜是否能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
| 实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | 无 | ﹣﹣ |
| ② | 1.2g | 氧化铜0.5g | ﹣﹣ |
| ③ | 1.2g | 二氧化锰0.5g | ﹣﹣ |
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
(1)上述实验应测量的“待测数据”是
(2)若实验②比实验①的“待测数据”更
(3)将实验②反应后的剩余固体,进行一些实验操作,得到氧化铜,质量为0.5g,
再将黑色粉末放入试管中,加入
【结论】氧化铜还能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是
(4)下列关于催化剂的说法正确的是
a.催化剂必定加快反应速率
b.同一个化学反应的催化剂可以有多种
c.在酿造工业和制药工业,一般都要用酶做催化剂
d.在过氧化氢制氧气时,只有加入催化剂,过氧化氢才反应产生氧气
您最近一年使用:0次
【推荐3】学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,还想探究其他一些物质如氧化铝(Al2O3)是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
【提出问题】A12O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】A12O3能作过氧化氢分解的催化剂。
【实验验证】
实验一,_____________ ,木条不复燃;结论,常温下过氧化氢溶液分解缓慢。
实验二,在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中,_____________ ,说明Al2O3,加快了过氧化氢的分解速率。
【实验结论】Al2O3能加快过氧化氢的分解速率,故A12O3能作过氧化氢分解的催化剂。
【讨论与反思】经过讨论,有的同学认为根据上述两个实验,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:探究____________
【实验步骤】
①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,_________ ,称量;
④对比反应前后Al2O3的质量。
【讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验探究____________ 。
【拓展反思1】影响化学反应的因素除催化剂外,还有哪些呢?在空气中加热铁丝,铁丝只能发生红热现象,不能燃烧:但在氧气里点燃细铁丝可发生____________ ,火星四射;带火星的木条在空气中不能燃烧,但在氧气里复燃。这说明反应物____________ 越大,反应速度越快。
【拓展反思2】碳在常温下不与氧气反应,点燃时能与氧气反应,这说明反应物 越高,反应速度越快。
【提出问题】A12O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】A12O3能作过氧化氢分解的催化剂。
【实验验证】
实验一,
实验二,在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中,
【实验结论】Al2O3能加快过氧化氢的分解速率,故A12O3能作过氧化氢分解的催化剂。
【讨论与反思】经过讨论,有的同学认为根据上述两个实验,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:探究
【实验步骤】
①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,
④对比反应前后Al2O3的质量。
【讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验探究
【拓展反思1】影响化学反应的因素除催化剂外,还有哪些呢?在空气中加热铁丝,铁丝只能发生红热现象,不能燃烧:但在氧气里点燃细铁丝可发生
【拓展反思2】碳在常温下不与氧气反应,点燃时能与氧气反应,这说明反应物 越高,反应速度越快。
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化锰粉末能催化双氧水的分解,那其他的金属氧化物是否也具有一定的催化作用?催化效果哪个更好呢?小金进行了实验探究,查阅资料得:氧化铜是一种黑色的难溶性粉末,微热时可与稀硫酸发生反应,化学方程式:CuO+H2SO4 CuSO4+H2O,生成的硫酸铜溶液呈蓝色,实验步骤:
CuSO4+H2O,生成的硫酸铜溶液呈蓝色,实验步骤:
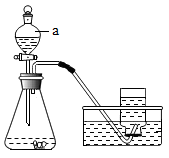
①如图连接装置,向锥形瓶中加入二氧化锰粉末,加入10%的双氧水,观察现象并记录相关数据如表。
②清洗并干燥装置,换用氧化铜粉末重复步骤①,相关数据记录表中,据此分析:
(1)步骤②中所加氧化铜的质量是___________ ;
(2)可得出的结论是___________ ;
(3)小徐同学分析了小金的实验过程后,认为还需要补做几个实验步骤,才能证明氧化铜在该反应中是催化剂。步骤继续设计如下:
③将反应结束后剩余氧化铜固体进行过滤、洗涤、干燥并___________ (填写操作名称),证明氧化铜在反应前后质量未发生变化;
④向上一步所得固体中加入稀硫酸并微热,观察溶液颜色,证明氧化铜在反应前后___________ 未发生变化。
 CuSO4+H2O,生成的硫酸铜溶液呈蓝色,实验步骤:
CuSO4+H2O,生成的硫酸铜溶液呈蓝色,实验步骤:
①如图连接装置,向锥形瓶中加入二氧化锰粉末,加入10%的双氧水,观察现象并记录相关数据如表。
②清洗并干燥装置,换用氧化铜粉末重复步骤①,相关数据记录表中,据此分析:
| 物质 | 质量/g | 10%双氧水体积/mL | 集满一瓶氧气所用时间/s |
| 二氧化锰 | 0.5 | 20 | 25 |
| 氧化铜 | | 20 | 38 |
(1)步骤②中所加氧化铜的质量是
(2)可得出的结论是
(3)小徐同学分析了小金的实验过程后,认为还需要补做几个实验步骤,才能证明氧化铜在该反应中是催化剂。步骤继续设计如下:
③将反应结束后剩余氧化铜固体进行过滤、洗涤、干燥并
④向上一步所得固体中加入稀硫酸并微热,观察溶液颜色,证明氧化铜在反应前后
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】某小组在做双氧水制氧气的实验时不小心把双氧水洒到了水泥地上,意外地发现地上立即产生大量的气泡,于是她对这一现象产生了探究兴趣。
(提出问题)除二氧化锰外,水泥是否也能作双氧水分解的催化剂?它的催化效果比二氧化锰是否更弱?
(设计实验)小雨以收集等体积氧气所需时间为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
(1)加入水泥块的质量为___________ g。
(2)对比实验②和实验①,得到的结论是______________________ 。
(3)为进一步探究水泥块是否可以作为过氧化氢的催化剂,将实验②反应后的固体加水溶解、过滤、洗涤、干燥、称量,这样做的目的是______________________ ;同时还需验证______________________ ,说明水泥块是此实验的催化剂。
(4)(评价设计)你认为小雨设计实验②和实验③对比的目的是______________________ 。
(提出问题)除二氧化锰外,水泥是否也能作双氧水分解的催化剂?它的催化效果比二氧化锰是否更弱?
(设计实验)小雨以收集等体积氧气所需时间为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
| 实验序号 | 双氧水溶液体积 | 其他物质质量 | 收集时间/s |
| ① | 40mL | / | 200 |
| ② | 40mL | 水泥块 | 100 |
| ③ | 40mL | MnO2:0.5g | 67 |
(2)对比实验②和实验①,得到的结论是
(3)为进一步探究水泥块是否可以作为过氧化氢的催化剂,将实验②反应后的固体加水溶解、过滤、洗涤、干燥、称量,这样做的目的是
(4)(评价设计)你认为小雨设计实验②和实验③对比的目的是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】消毒液、H2O2溶液都是常用消毒剂,兴趣小组对两种消毒剂进行了如下探究活动。
[查阅资料]84消毒液的有效成分是次氯酸钠(化学式为NaClO)。
[实验1]取少量84消毒液于试管中,滴加过氧化氢溶液,发现有大量气泡产生:然后____ (填写实验操作和现象),证明产生的气体是氧气。
[提出问题]在上述反应中,次氯酸钠的作用是什么?
[作出猜想]猜想-:作反应物,次氯酸钠与过氧化氢溶液发生化学反应。
猜想二:作催化剂,类似分解过氧化氢溶液制氧气时MnO2的作用。
[实验2]①按上图所示组装实验装置,并检查装置的气密性。

②向锥形瓶中加入40ml84消毒液,注射器中吸入40ml过氧化氢溶液。
③将注射器中的过氧化氢溶液平均分5次推入锥形瓶中:每次推入过氧化氢溶液,待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测最结果造成的影响)见下表:
(1)表中的数据x=_____
(2)分析表中数据得出“猜想一正确”,其依据是____
【分析讨论】次氯酸钠与过氧化氢溶液溶液反应除生成氧气外,还生成氯化钠和水。该反应的化方程式为____
【拓展反思】生活中常用消毒剂除84消毒液、过氧化氢溶液外,还有75%酒精、过氧乙酸等。在使用各种消毒剂时,要考虑它们的性质。切记:科学使用,注意安全!
生活中下列使用消毒剂的做法正确的是_____
A 不同的消毒剂可随意混合使用 B 使用84消毒液的浓度越高越好
C 使用75%酒精消毒应远离明火,防止火灾 D 84消毒液、75%酒精等消毒剂均应密封保存
[查阅资料]84消毒液的有效成分是次氯酸钠(化学式为NaClO)。
[实验1]取少量84消毒液于试管中,滴加过氧化氢溶液,发现有大量气泡产生:然后
[提出问题]在上述反应中,次氯酸钠的作用是什么?
[作出猜想]猜想-:作反应物,次氯酸钠与过氧化氢溶液发生化学反应。
猜想二:作催化剂,类似分解过氧化氢溶液制氧气时MnO2的作用。
[实验2]①按上图所示组装实验装置,并检查装置的气密性。

②向锥形瓶中加入40ml84消毒液,注射器中吸入40ml过氧化氢溶液。
③将注射器中的过氧化氢溶液平均分5次推入锥形瓶中:每次推入过氧化氢溶液,待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测最结果造成的影响)见下表:
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 收集气体的总体积/ml | 148 | 296 | 374 | x | 390 |
(2)分析表中数据得出“猜想一正确”,其依据是
【分析讨论】次氯酸钠与过氧化氢溶液溶液反应除生成氧气外,还生成氯化钠和水。该反应的化方程式为
【拓展反思】生活中常用消毒剂除84消毒液、过氧化氢溶液外,还有75%酒精、过氧乙酸等。在使用各种消毒剂时,要考虑它们的性质。切记:科学使用,注意安全!
生活中下列使用消毒剂的做法正确的是
A 不同的消毒剂可随意混合使用 B 使用84消毒液的浓度越高越好
C 使用75%酒精消毒应远离明火,防止火灾 D 84消毒液、75%酒精等消毒剂均应密封保存
您最近一年使用:0次



