物质的组成与结构
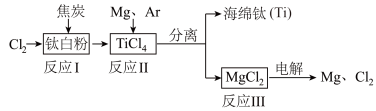
课堂上。老师做了一个有趣的实验:取一小块金属钠,放在石棉网上加热,金属钠熔化成小球,一段时间,金属钠燃烧起来发出黄色火焰。小英同学查阅资料得知:金属钠在常温下可与氧气反应生成氧化钠,在点燃的条件下与氧气反应生成过氧化钠。为了研究钠与氧气的反应,她还从课本中找到了氧和钠的原子结构示意图(如下图所示)。请回答下列问题:
(1)氧元素在化合物中的化合价一般是_______ ,你判断的理由是 ________________ 。
(2)氧化钠和过氧化钠都是由离子构成的物质。过氧化钠由钠离子和阴离子(O22-)构成,则过氧化钠的化学式为____________ 。
(3)根据以上信息,请你帮小英将相关内容填写完整。
(4)学习了原子结构的相关知识后,小英幻想自己变成能进入了原子中的微粒,写了如下短文:进入钠原子,我发现:a.钠原子是由原子核和核外电子构成的;b.和原子相比,原子核的体积竟然那么小;c.电子在核外不同的区域高速运动,能量越高的电子离核越远;d.我数了数,质子和电子的数目居然是一样的;e.我试着去搬动它们,发现质子、中子、电子的质量都差不多;f.金属钠在空气中燃烧时,钠原子的原子核没有发生变化。
小英对原子结构的认识有些是错误的,指出文中有错误的一句是_______ (填序号),正确的说法是 ____ 。
(5)19世纪以前,人们一直以为原子是不可分的,一百多年来,科学家通过实验与推理不断纠正错误认识,逐步揭开原子的构成。
①1897年,__________ 通过实验发现了带负电的电子,他推测原子中还有带正电的物质,他推测的依据是 _____________ 。
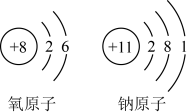
②1911年著名物理学家为探索原子的内部结构进行了著名的α粒子散射实验(图1),实验现象如图2所示。
由实验现象可以推理得出的结论有______________ (填编号)
A.原子核带正电 B.原子核很小,但集中了原子的大部分质量
C.原子核由质子和中子构成 D.原子内部有很大的空间
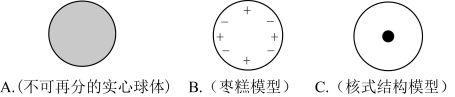
③符合卢瑟福实验结论的原子结构模型是____________ (填编号)。
课堂上。老师做了一个有趣的实验:取一小块金属钠,放在石棉网上加热,金属钠熔化成小球,一段时间,金属钠燃烧起来发出黄色火焰。小英同学查阅资料得知:金属钠在常温下可与氧气反应生成氧化钠,在点燃的条件下与氧气反应生成过氧化钠。为了研究钠与氧气的反应,她还从课本中找到了氧和钠的原子结构示意图(如下图所示)。请回答下列问题:

(1)氧元素在化合物中的化合价一般是
(2)氧化钠和过氧化钠都是由离子构成的物质。过氧化钠由钠离子和阴离子(O22-)构成,则过氧化钠的化学式为
(3)根据以上信息,请你帮小英将相关内容填写完整。
物质名称 | 组成物质的元素 (用符号表示) | 物质组成 (用化学式表示) | 构成物质的微粒 (用符号表示) | 物质类别 (单质、化合物) |
钠 | ||||
氧气 | ||||
氧化钠 |
小英对原子结构的认识有些是错误的,指出文中有错误的一句是
(5)19世纪以前,人们一直以为原子是不可分的,一百多年来,科学家通过实验与推理不断纠正错误认识,逐步揭开原子的构成。
①1897年,
②1911年著名物理学家为探索原子的内部结构进行了著名的α粒子散射实验(图1),实验现象如图2所示。

由实验现象可以推理得出的结论有
A.原子核带正电 B.原子核很小,但集中了原子的大部分质量
C.原子核由质子和中子构成 D.原子内部有很大的空间
③符合卢瑟福实验结论的原子结构模型是

更新时间:2018-02-06 20:35:51
|
相似题推荐
综合应用题
|
适中
(0.65)
名校
解题方法
【推荐1】扎实做好“碳达峰”“碳中和”各项工作是减缓温室效应的有力举措,体现了我国的大国担当,需要全人类的共同努力。
(1)我国承诺在2060年前实现“碳中和”,“碳中和”中的“碳”是指___________ (填化学式)。
(2)减少化石燃料的使用,开发使用新能源是实现“碳”减排的有效途径。请写出一种可用于替代化石燃料的新能源:___________ 。
(3)核能的探索和利用,有助于实现“碳中和”。热核聚变,即氘原子(含一个中子的氢原子)结合成氨原子,会释放巨大能量。氢原子与氦原子的本质区别是___________ 。
(4)CO2捕获和转化可减少CO2排放并实现资源利用。一种捕集烟气中CO2并转化利用的流程如图:___________ 。
②转化器中的反应需要在催化剂作用下实现,反应的化学方程式是___________ 。
③理论上只需不断加入___________ (填化学式)便可持续实现捕集烟气中CO2并转化。
(1)我国承诺在2060年前实现“碳中和”,“碳中和”中的“碳”是指
(2)减少化石燃料的使用,开发使用新能源是实现“碳”减排的有效途径。请写出一种可用于替代化石燃料的新能源:
(3)核能的探索和利用,有助于实现“碳中和”。热核聚变,即氘原子(含一个中子的氢原子)结合成氨原子,会释放巨大能量。氢原子与氦原子的本质区别是
(4)CO2捕获和转化可减少CO2排放并实现资源利用。一种捕集烟气中CO2并转化利用的流程如图:
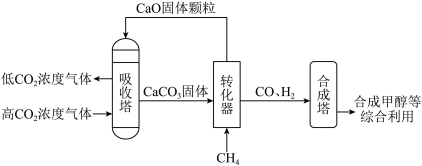
②转化器中的反应需要在催化剂作用下实现,反应的化学方程式是
③理论上只需不断加入
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】填空。
Ⅰ.阅读下列内容,完成问题。
英国科学家汤姆生在1897年发现阴极射线就是来自原子内部的“电”,所有原子中都含这种带电微粒,而这种带电微粒就是“电子”,并确认所有原子都含有带负电的电子( )。1903年,汤姆生提出了原子结构的“葡萄干蛋糕”模型,他认为:原子是一个实心球体,正电荷像蛋糕一样松软,电子像蛋糕里的葡萄干一样均匀分布在球内。
)。1903年,汤姆生提出了原子结构的“葡萄干蛋糕”模型,他认为:原子是一个实心球体,正电荷像蛋糕一样松软,电子像蛋糕里的葡萄干一样均匀分布在球内。
汤姆生的学生卢瑟福认为:从原子内部结构获取信息的最有力的方法之一,在于研究高速粒子穿过物质的散射。通过对这种散射的具体分析,有助于探明原子内部的构造。1911年卢瑟福等人为探究原子内部结构进行了下列实验:用一束带正电的、质量比电子大得多的高速运动的 粒子轰击金箔(厚度约为0.00004cm的金箔)
粒子轰击金箔(厚度约为0.00004cm的金箔)
资料:
① 粒子质量是电子的七千多倍,射出速度
粒子质量是电子的七千多倍,射出速度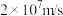 ,电子对它运动的影响极小。
,电子对它运动的影响极小。
② 粒子带2个单位正电荷,穿过原子时,均匀分布的正电荷对它的斥力很小。
粒子带2个单位正电荷,穿过原子时,均匀分布的正电荷对它的斥力很小。
卢瑟福的实验结果发现:
①大多数 粒子能穿透金箔而不改变原来的运动方向;
粒子能穿透金箔而不改变原来的运动方向;
②一小部分 粒子改变了原来的运动方向;
粒子改变了原来的运动方向;
③有极少数 粒子(占1/8000)被弹了回来。
粒子(占1/8000)被弹了回来。
(1)请综合两位科学家的观点思考:由发现①能得到的结论是:______ ;由发现②和③能得到的结论是:______ ;综合①、②、③的推论,最终可得出的结论是______ ;
Ⅱ.观看科普纪录片可以帮助我们了解更多的化学知识。
(2)请根据《门捷列夫很忙》第四集内容判断,下列内容说法中错误的是______ (单选)。
①小苏打碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,苏打水是生活中常见的饮料之一
②氯气有很强的毒性,金属钠在氯气中燃烧形成的化合物氯化钠也有较强的毒性
③金属铯熔点很低,它与水的反应比金属钠和钾更加剧烈。铯原子钟是目前世界上精度最高的钟
④铜被人们认为是一种完美的金属,中华文明对铜也情有独钟,后母戊鼎、四羊方尊、编钟等都是我国古代劳动人民留下来的精美铜器
⑤金和银都是不活泼的金属,金和银不仅拥有非常好的导电性,也拥有很好的延展性,因此金银可以做很多精美的首饰。同时,金银也作为古代的主要货币
Ⅲ.家庭小实验丰富有趣,请结合生活经验和我们曾经做过的家庭小实验,回答下列问题:
(3)正常情况下家中燃气灶点燃后火焰呈什么颜色?______ ;
(4)零食包装袋中可能会充装什么气体?______ ;
(5)取无色饮料瓶三只,各装入少量自来水、白醋、白酒,我们可以通过闻气味的方法加以鉴别,这说明分子具有什么性质?______ ;
(6)某同学在做电解水家庭小实验时,发现两支铅笔的末端气泡生成速率比较慢,你认为这可能的原因是什么?建议采取什么改进措施?______ ;
(7)分子模型在化学学习的过程中具有非常重要的作用,请结合你自己制作的模型,在下面的方框中,尝试画出电解水的微观过程______ 。
Ⅳ.“见著知微,见微知著”是化学重要的思维方法。完成下列填空。
(8)①保持氢气可燃性的最小粒子是______ (填符号)。
②构成氯化钠的微粒是______ (填符号)。
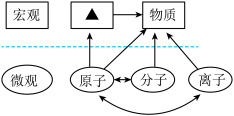
(9)思维导图有助于建构知识,下图是小金同学建立的有关物质宏观组成和微观构成的思维导图,其中方框“ ”处应填入的是
”处应填入的是______ 。
(10)已知某离子化合物由铝元素和氧元素组成,经过科学仪器精确测定,该化合物中铝元素和氧元素的质量比为9:8。
①请通过简要计算,求出该化合物的化学式(没有必要的计算过程不得分)______ 。
②请画出铝原子和氧原子的原子结构示意图______ ,从电子得失形成相对稳定结构的视角,描述该化合物的形成过程,并指出在该化合物中铝元素和氧元素的化合价,从而写出该化合物的化学式(没有必要的分析过程,直接写化学式不得分)______ 。
Ⅰ.阅读下列内容,完成问题。
英国科学家汤姆生在1897年发现阴极射线就是来自原子内部的“电”,所有原子中都含这种带电微粒,而这种带电微粒就是“电子”,并确认所有原子都含有带负电的电子(
 )。1903年,汤姆生提出了原子结构的“葡萄干蛋糕”模型,他认为:原子是一个实心球体,正电荷像蛋糕一样松软,电子像蛋糕里的葡萄干一样均匀分布在球内。
)。1903年,汤姆生提出了原子结构的“葡萄干蛋糕”模型,他认为:原子是一个实心球体,正电荷像蛋糕一样松软,电子像蛋糕里的葡萄干一样均匀分布在球内。汤姆生的学生卢瑟福认为:从原子内部结构获取信息的最有力的方法之一,在于研究高速粒子穿过物质的散射。通过对这种散射的具体分析,有助于探明原子内部的构造。1911年卢瑟福等人为探究原子内部结构进行了下列实验:用一束带正电的、质量比电子大得多的高速运动的
 粒子轰击金箔(厚度约为0.00004cm的金箔)
粒子轰击金箔(厚度约为0.00004cm的金箔)资料:
①
 粒子质量是电子的七千多倍,射出速度
粒子质量是电子的七千多倍,射出速度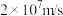 ,电子对它运动的影响极小。
,电子对它运动的影响极小。②
 粒子带2个单位正电荷,穿过原子时,均匀分布的正电荷对它的斥力很小。
粒子带2个单位正电荷,穿过原子时,均匀分布的正电荷对它的斥力很小。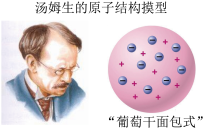 1897年,汤姆生发现原子中存在电子,并用实验方法测出电子的质量。 正电荷均匀地分布在原子之中,电子则散布在正电荷之中。 | 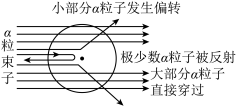 卢瑟福  粒子散射实验 粒子散射实验 |
①大多数
 粒子能穿透金箔而不改变原来的运动方向;
粒子能穿透金箔而不改变原来的运动方向;②一小部分
 粒子改变了原来的运动方向;
粒子改变了原来的运动方向;③有极少数
 粒子(占1/8000)被弹了回来。
粒子(占1/8000)被弹了回来。(1)请综合两位科学家的观点思考:由发现①能得到的结论是:
Ⅱ.观看科普纪录片可以帮助我们了解更多的化学知识。
(2)请根据《门捷列夫很忙》第四集内容判断,下列内容说法中错误的是
①小苏打碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,苏打水是生活中常见的饮料之一
②氯气有很强的毒性,金属钠在氯气中燃烧形成的化合物氯化钠也有较强的毒性
③金属铯熔点很低,它与水的反应比金属钠和钾更加剧烈。铯原子钟是目前世界上精度最高的钟
④铜被人们认为是一种完美的金属,中华文明对铜也情有独钟,后母戊鼎、四羊方尊、编钟等都是我国古代劳动人民留下来的精美铜器
⑤金和银都是不活泼的金属,金和银不仅拥有非常好的导电性,也拥有很好的延展性,因此金银可以做很多精美的首饰。同时,金银也作为古代的主要货币
Ⅲ.家庭小实验丰富有趣,请结合生活经验和我们曾经做过的家庭小实验,回答下列问题:
(3)正常情况下家中燃气灶点燃后火焰呈什么颜色?
(4)零食包装袋中可能会充装什么气体?
(5)取无色饮料瓶三只,各装入少量自来水、白醋、白酒,我们可以通过闻气味的方法加以鉴别,这说明分子具有什么性质?
(6)某同学在做电解水家庭小实验时,发现两支铅笔的末端气泡生成速率比较慢,你认为这可能的原因是什么?建议采取什么改进措施?
(7)分子模型在化学学习的过程中具有非常重要的作用,请结合你自己制作的模型,在下面的方框中,尝试画出电解水的微观过程
Ⅳ.“见著知微,见微知著”是化学重要的思维方法。完成下列填空。
(8)①保持氢气可燃性的最小粒子是
②构成氯化钠的微粒是
(9)思维导图有助于建构知识,下图是小金同学建立的有关物质宏观组成和微观构成的思维导图,其中方框“
 ”处应填入的是
”处应填入的是
(10)已知某离子化合物由铝元素和氧元素组成,经过科学仪器精确测定,该化合物中铝元素和氧元素的质量比为9:8。
①请通过简要计算,求出该化合物的化学式(没有必要的计算过程不得分)
②请画出铝原子和氧原子的原子结构示意图
您最近一年使用:0次
【推荐3】Ⅰ元素周期表是学习和研究化学的重要工具,它的内容十分丰富。如图是元素周期表的部分内容,请认真分析并回答后面的问题:
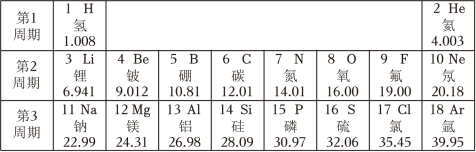
请根据相关信息与知识回答:
(1)1869年, (填字母)发现了元素周期律并编制了元素周期表。
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为______ 。
(3)元素周期表中同一族的元素,一般具有相似的化学性质,则下列各组元素具有相似化学性质的是 。
(4)张青莲教授主持测定了铟的相对原子质量的新值,被采用为国际新标准。铟元素的原子结构示意图如图1和在周期表中信息如图2所示。
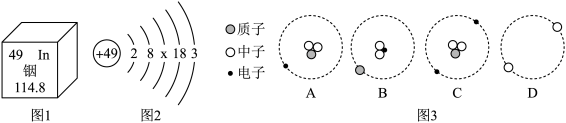
图中x=____ ,铟位于元素周期表中第 ______ 周期。
(5)氚(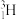 )是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是
)是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是______ (填字母)。
Ⅱ.A-H都是九年级化学中的常见物质,C、D在常温时均呈液态:B和C混合立即产生无色气体H,H能使带火星的木条复燃,它们之间有如下的转化关系,且B在反应①和③中前后质量和化学性质均不变。

(6)E物质的化学式为______ ;黑色固体I的名称为 ______ 。
(7)请写出反应①的符号表达式______ 。
(8)写出反应④所属的基本反应类型为______ 。

请根据相关信息与知识回答:
(1)1869年, (填字母)发现了元素周期律并编制了元素周期表。
| A.拉瓦锡 | B.张青莲 |
| C.门捷列夫 | D.道尔顿和阿伏加德罗 |
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为
(3)元素周期表中同一族的元素,一般具有相似的化学性质,则下列各组元素具有相似化学性质的是 。
| A.Na和Cl | B.O和S | C.B和Si | D.F和Cl |
(4)张青莲教授主持测定了铟的相对原子质量的新值,被采用为国际新标准。铟元素的原子结构示意图如图1和在周期表中信息如图2所示。

图中x=
(5)氚(
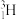 )是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是
)是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是Ⅱ.A-H都是九年级化学中的常见物质,C、D在常温时均呈液态:B和C混合立即产生无色气体H,H能使带火星的木条复燃,它们之间有如下的转化关系,且B在反应①和③中前后质量和化学性质均不变。

(6)E物质的化学式为
(7)请写出反应①的符号表达式
(8)写出反应④所属的基本反应类型为
您最近一年使用:0次
【推荐1】金属及其化合物在生产生活中应用广泛。
(一)某化学实验小组利用如图装置模拟铁的冶炼并测定某赤铁矿石中氧化铁的质量分数(假设赤铁矿中杂质不参与反应)。
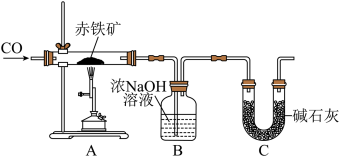
(1)实验开始时,先进行的操作是_______ (填字母)。
a.通入一氧化碳 b.加热
(2)实验过程中观察到装置A中玻璃管内发生反应的化学方程式_______ 。
(3)B装置的作用是_______ 。
(4)从环境保护的角度看此实验存在的缺陷是_______ 。
(5)实验前称量赤铁矿石的质量为20g,通入足量一氧化碳充分反应,测得B装置总质量增加13.2g。若不考虑实验过程中水分带出的影响,该赤铁矿石中氧化铁的质量分数_______ 。
(二)已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2。现利用如图1的实验装置进行实验,反应过程中管内的固体质量随温度的变化曲线如图2。

(6)查阅资料发现,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,仪器甲应选用的加热仪器是______ (填“酒精灯”或“酒精喷灯”)。
(7)图1中实验现象是______ 。
(8)利用图2显示的相关信息,回答如下问题。
①在0~400℃温度范围内,管内固体质量不变,其原因是______ 。
②图中x=_______ g。
③试根据图计算并推断A点固体的合理化学式_______ 。
(一)某化学实验小组利用如图装置模拟铁的冶炼并测定某赤铁矿石中氧化铁的质量分数(假设赤铁矿中杂质不参与反应)。

(1)实验开始时,先进行的操作是
a.通入一氧化碳 b.加热
(2)实验过程中观察到装置A中玻璃管内发生反应的化学方程式
(3)B装置的作用是
(4)从环境保护的角度看此实验存在的缺陷是
(5)实验前称量赤铁矿石的质量为20g,通入足量一氧化碳充分反应,测得B装置总质量增加13.2g。若不考虑实验过程中水分带出的影响,该赤铁矿石中氧化铁的质量分数
(二)已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2。现利用如图1的实验装置进行实验,反应过程中管内的固体质量随温度的变化曲线如图2。

(6)查阅资料发现,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,仪器甲应选用的加热仪器是
(7)图1中实验现象是
(8)利用图2显示的相关信息,回答如下问题。
①在0~400℃温度范围内,管内固体质量不变,其原因是
②图中x=
③试根据图计算并推断A点固体的合理化学式
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】用下列实验探究镁的性质。
实验一:将打磨后的镁条插入装有空气的集气瓶中做燃烧的实验时,生成的白色固体中有少许淡黄色固体。
(1)生成白色固体的反应符号表达式为______ 。
(2)针对淡黄色固体,提出猜想:镁能与N2反应生成淡黄色的氮化镁固体。
将1.44g镁在N2中充分燃烧,生成淡黄色固体2.00g。氮化镁的化学式为______ 。但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是______ 。
实验二:2.4g镁条与足量稀盐酸的反应,充分反应后,将所得溶液蒸发,实验装置如下图所示。
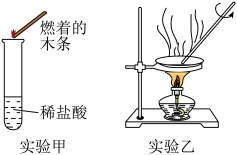
(3)实验甲中看见大量气泡迅速冒出,用燃着的木条检验听到尖锐的爆鸣声,则该气体为______ 。
(4)将实验甲得到的溶液进行实验乙,若得到固体为MgCl2,该固体质量是______ g,实验甲中反应的符号表达式为______ 。
(5)拓展延伸:在实验乙将溶液蒸干的过程中MgCl2会转变为MgO,蒸干后得到固体为MgCl2和MgO的混合物6.75g,该混合物中MgCl2和MgO的质量之比为______ 。
实验一:将打磨后的镁条插入装有空气的集气瓶中做燃烧的实验时,生成的白色固体中有少许淡黄色固体。
(1)生成白色固体的反应符号表达式为
(2)针对淡黄色固体,提出猜想:镁能与N2反应生成淡黄色的氮化镁固体。
将1.44g镁在N2中充分燃烧,生成淡黄色固体2.00g。氮化镁的化学式为
实验二:2.4g镁条与足量稀盐酸的反应,充分反应后,将所得溶液蒸发,实验装置如下图所示。

(3)实验甲中看见大量气泡迅速冒出,用燃着的木条检验听到尖锐的爆鸣声,则该气体为
(4)将实验甲得到的溶液进行实验乙,若得到固体为MgCl2,该固体质量是
(5)拓展延伸:在实验乙将溶液蒸干的过程中MgCl2会转变为MgO,蒸干后得到固体为MgCl2和MgO的混合物6.75g,该混合物中MgCl2和MgO的质量之比为
您最近一年使用:0次
【推荐3】Ⅰ元素周期表是学习和研究化学的重要工具,它的内容十分丰富。如图是元素周期表的部分内容,请认真分析并回答后面的问题:

请根据相关信息与知识回答:
(1)1869年, (填字母)发现了元素周期律并编制了元素周期表。
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为______ 。
(3)元素周期表中同一族的元素,一般具有相似的化学性质,则下列各组元素具有相似化学性质的是 。
(4)张青莲教授主持测定了铟的相对原子质量的新值,被采用为国际新标准。铟元素的原子结构示意图如图1和在周期表中信息如图2所示。

图中x=____ ,铟位于元素周期表中第 ______ 周期。
(5)氚(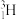 )是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是
)是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是______ (填字母)。
Ⅱ.A-H都是九年级化学中的常见物质,C、D在常温时均呈液态:B和C混合立即产生无色气体H,H能使带火星的木条复燃,它们之间有如下的转化关系,且B在反应①和③中前后质量和化学性质均不变。

(6)E物质的化学式为______ ;黑色固体I的名称为 ______ 。
(7)请写出反应①的符号表达式______ 。
(8)写出反应④所属的基本反应类型为______ 。

请根据相关信息与知识回答:
(1)1869年, (填字母)发现了元素周期律并编制了元素周期表。
| A.拉瓦锡 | B.张青莲 |
| C.门捷列夫 | D.道尔顿和阿伏加德罗 |
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为
(3)元素周期表中同一族的元素,一般具有相似的化学性质,则下列各组元素具有相似化学性质的是 。
| A.Na和Cl | B.O和S | C.B和Si | D.F和Cl |
(4)张青莲教授主持测定了铟的相对原子质量的新值,被采用为国际新标准。铟元素的原子结构示意图如图1和在周期表中信息如图2所示。

图中x=
(5)氚(
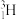 )是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是
)是核聚变的原料,它的质子数为1,中子数为2。图3中能正确表示氚原子结构的是Ⅱ.A-H都是九年级化学中的常见物质,C、D在常温时均呈液态:B和C混合立即产生无色气体H,H能使带火星的木条复燃,它们之间有如下的转化关系,且B在反应①和③中前后质量和化学性质均不变。

(6)E物质的化学式为
(7)请写出反应①的符号表达式
(8)写出反应④所属的基本反应类型为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐1】下表为元素周期表中部分元素的原子结构示意图,请利用表格信息回答相关问题。

(1)决定元素种类的是_______ (填字母,下同);与元素化学性质的关系最密切的是______ 。
A.原子核内的质子数B.原子核内的中子数
C.原子核外的最外层电子数D.元素的相对原子质量
(2)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、碱、盐的化学式各一个,并标出所写化学式中氮元素的化合价:单质_________ 、氧化物_______ 、酸_______ 、碱________ 、盐________
(3)铝在氧气中燃烧生成氧化铝。请利用化学方程式计算,27g铝完全燃烧,消耗氧气的质量是多少________ ?(在答题纸上写出完整计算过程)

(1)决定元素种类的是
A.原子核内的质子数B.原子核内的中子数
C.原子核外的最外层电子数D.元素的相对原子质量
(2)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、碱、盐的化学式各一个,并标出所写化学式中氮元素的化合价:单质
(3)铝在氧气中燃烧生成氧化铝。请利用化学方程式计算,27g铝完全燃烧,消耗氧气的质量是多少
您最近一年使用:0次
【推荐2】宏观和微观相结合是认识物质结构与性质的重要方法。
(1)下图为部分元素的原子结构示意图:________ (填“相似”或“不相似”)。
②钠原子在形成化合物时,易________ (填“失去”或“得到”)最外层的电子,形成的阳离子是________ (填离子符号)。
③硅(Si)元素原子的原子核内,x的值为________ 。
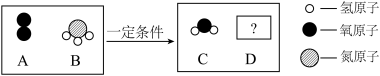
(2)下图是某反应的微观示意图,请根据图示回答:________________________________ ;
②若A、B化学计量数之比为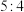 ,则D中含
,则D中含________ 元素。
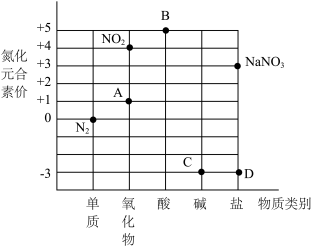
(3)氮及其化合物的“化合价——物质类别”关系如图所示。________ ,找出与图中的点对应物质不相符的化学式________ 。
②D点对应的铵盐可用来做氮肥,________ (填“能”或“不能”)和熟石灰混合施用。
(1)下图为部分元素的原子结构示意图:
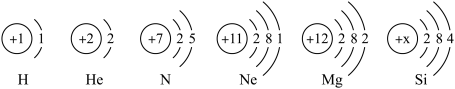
②钠原子在形成化合物时,易
③硅(Si)元素原子的原子核内,x的值为
(2)下图是某反应的微观示意图,请根据图示回答:
②若A、B化学计量数之比为
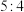 ,则D中含
,则D中含(3)氮及其化合物的“化合价——物质类别”关系如图所示。
②D点对应的铵盐可用来做氮肥,
您最近一年使用:0次