“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
(1)认识符号:NO3-名称是___________ ;
(2)写化学式:丙物质的化学式是_______________ ;
(3)物质分类:五种物质中,属于碱的是__________ (用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是____________ (用化学式表示)。
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是____________ ;步骤三的现象是_____________ ;步骤三中发生的任意一个化学反应的化学方程式是_________________ 。
(2)依据假设二的现象,原白色粉末可能的组成是_______________ ;(任写一种可能的组成,用化学式表示)
(3)依据假设三的现象,原白色粉末可能的组成有___________ 种。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
| 阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| K+ | 甲 | 乙 | 丙 | ||
| Ba2+ | 丁 | 戊 |
(1)认识符号:NO3-名称是
(2)写化学式:丙物质的化学式是
(3)物质分类:五种物质中,属于碱的是
(4)溶解能力:五种物质中,只有一种不溶于水,它是
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
| 步骤一 | 步骤二 | 步骤三 | |
| 假设一 | 有白色沉淀生成 | ||
| 假设二 | 无白色沉淀生成 | 溶液变红 | 溶液变为无色 |
| 假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是
(2)依据假设二的现象,原白色粉末可能的组成是
(3)依据假设三的现象,原白色粉末可能的组成有
更新时间:2018-02-10 18:18:39
|
相似题推荐
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验课上林浩同学在利用Zn与稀H2SO4制取H2的实验时,不小心将硫酸铜溶液加入反应容器,发现的反应速率加快了。林浩同学决定对此进行探究。
[提出问题]硫酸铜是否是反应的催化剂?硫酸铜溶液的用量对反应速率是否有影响?
[设计实验]室温下,林浩将过量的、颗粒大小相同的锌粒分别放在六支洁净的试管中,再依次加入20ml的稀硫酸,然后向其中分别加入饱和硫酸铜溶液和水,实验记录数据如下:
(1)实验中加入的饱和硫酸铜溶液和水总体积相等,目的是__________________ 。
(2)请写出锌与稀硫酸反应的化学方程式__________________ 。
(3)比较反应速率除测量“1分钟收集的气体体积”,还可采用的方法有__________________ 。
[实验现象]实验是除观察到产生气泡速率不同之外,还可看到锌片的表面有红色固体出现。
[实验结论]
(4)硫酸铜_____________ (填“是” 或“否”)反应的催化剂。
(5)硫酸铜溶液的用量太多反应速率反而下降,可能的原因是__________________ 。
[实验反思] (6) 影响锌与稀硫酸反应速率快慢的因素还有哪些?请列举一点。__________________ 。
[实验拓展]根据林浩同学的实验,陶黎同学认为是盐中金属离子影响了锌与稀硫酸反应的速率。为了探究不同的金属离子对速率的影响,陶黎设计了如下实验:取过量的、颗粒大小相同的锌粒分别放在五支洁净的试管中,加入20ml稀硫酸,再加入0. 5ml试剂,测量生成气体的速率,记录如下表(表中★越多,表示生成气体速率越快)。
(7)上述实验设计存在实验缺陷,该缺陷是__________________ 。你认为应该如何改进?你的改进方法是__________________ 。
(8)上表中,用水进行实验的目的是__________________ 。
(9)实验改进后,得到了相同的实验现象,你认为由该实验可得到的结论是(答一条即可)__________________ 。
[提出问题]硫酸铜是否是反应的催化剂?硫酸铜溶液的用量对反应速率是否有影响?
[设计实验]室温下,林浩将过量的、颗粒大小相同的锌粒分别放在六支洁净的试管中,再依次加入20ml的稀硫酸,然后向其中分别加入饱和硫酸铜溶液和水,实验记录数据如下:
| 试管编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 饱和硫酸铜溶液/ml | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
| 水/ml | 20 | 19.5 | 17.5 | 15 | 10 | 0 |
| 1分钟收集的气体体积/m1 | 12.0 | 14.0 | 16.8 | 17.9 | 11.1 | 9.8 |
(1)实验中加入的饱和硫酸铜溶液和水总体积相等,目的是
(2)请写出锌与稀硫酸反应的化学方程式
(3)比较反应速率除测量“1分钟收集的气体体积”,还可采用的方法有
[实验现象]实验是除观察到产生气泡速率不同之外,还可看到锌片的表面有红色固体出现。
[实验结论]
(4)硫酸铜
(5)硫酸铜溶液的用量太多反应速率反而下降,可能的原因是
[实验反思] (6) 影响锌与稀硫酸反应速率快慢的因素还有哪些?请列举一点。
[实验拓展]根据林浩同学的实验,陶黎同学认为是盐中金属离子影响了锌与稀硫酸反应的速率。为了探究不同的金属离子对速率的影响,陶黎设计了如下实验:取过量的、颗粒大小相同的锌粒分别放在五支洁净的试管中,加入20ml稀硫酸,再加入0. 5ml试剂,测量生成气体的速率,记录如下表(表中★越多,表示生成气体速率越快)。
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 加入试剂名称(0. 5ml) | 水 | 5%Na2SO4溶液 | 5%MgSO4溶液 | 5%FeCl2溶液 | 5%CuSO4溶液 |
| 生成气体速率 | ★ | ★ | ★ | ★★ | ★★★ |
(7)上述实验设计存在实验缺陷,该缺陷是
(8)上表中,用水进行实验的目的是
(9)实验改进后,得到了相同的实验现象,你认为由该实验可得到的结论是(答一条即可)
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某兴趣小组在学习碳的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO。于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】
(1)C还原CuO时产生的CO2与C进一步反应生成CO,则生成CO的化学方程式为______ 。
【查阅资料】1.CO不与NaOH、Ca(OH)2及H2SO4反应。
2.浓硫酸具有强吸水性,能吸收气流中水蒸气。
3.NaOH溶液能与CO2反应,吸收CO2气体。
【实验过程】取研细和干燥后的过量木炭和CuO混合均匀后,装入试管,连接装置,将反应后气体通入如图装置,检验气体中是否含有CO。

(2)装置B中澄清石灰水的作用_______ 。
(3)上述实验中确定CO存在的现象有:①装置D中粉末的颜色由黑色变成红色;②______ 。
(4)从环保和安全角度考虑可以在尾气部分加一个酒精灯,因为CO有______ 化学性质。
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,防止产生CO,应注意及时通风。
【猜想与假设】
(1)C还原CuO时产生的CO2与C进一步反应生成CO,则生成CO的化学方程式为
【查阅资料】1.CO不与NaOH、Ca(OH)2及H2SO4反应。
2.浓硫酸具有强吸水性,能吸收气流中水蒸气。
3.NaOH溶液能与CO2反应,吸收CO2气体。
【实验过程】取研细和干燥后的过量木炭和CuO混合均匀后,装入试管,连接装置,将反应后气体通入如图装置,检验气体中是否含有CO。

(2)装置B中澄清石灰水的作用
(3)上述实验中确定CO存在的现象有:①装置D中粉末的颜色由黑色变成红色;②
(4)从环保和安全角度考虑可以在尾气部分加一个酒精灯,因为CO有
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,防止产生CO,应注意及时通风。
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】小邱同学在医院输液时使用了“一次性输液加热棒”,它可以加温使进入人体的输液达到30℃左右,并能持续4小时以上。同学们对“一次性输液加热棒”进行探究。
【查阅资料】①“一次性输液加热棒”内主要成分是还原性铁粉、活性炭和氯化钠等物质;②钴粉、镍粉是能被磁铁吸引的黑色粉末;③Fe2+不能使硫氰化钾溶液变色,Fe3+能使硫氰化钾溶液变为血红色,Fe2+易被氧化:④氢氧化亚铁为白色不溶物,不稳定,易被氧化成红褐色的氢氧化铁:⑤ 。
。
【提出问题】该“一次性输液加热棒”内是否真的含有这几种物质呢?为什么能发热?
【实验探究】
探究一、加热棒内是否含有氯化钠
在该实验操作中,滴加适量的硝酸钡溶液和稀硝酸的作用是___________ 。小邱同学在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
探究二、加热棒内是否含有铁粉

(1)小邱用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。小邱通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是___________ (用化学方程式表示)。当观察到___________ 这一现象时,排除了四氧化三铁存在的可能性。
(2)小英查阅资料后发现还不能确定铁粉的存在。又进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液,然后滴加硫氰化钾溶液,溶液变为血红色。实验中,过氧化氢溶液的作用是___________ 。
结论:溶液中有Fe2+,加热棒中含有铁粉。
探究三、加热棒内是否含有活性炭粉
(3)点燃不能被吸引的黑色粉末,___________ (写出操作和现象),加热棒内含有活性炭粉。
综合上述实验,小明验证了加热棒内的主要成分。
【讨论交流】
(4)据初中化学知识及查阅资料可知,发热原理是“铁粉缓慢氧化”放出热量,其中氯化钠的作用是___________ ,原料中的活性炭粉能与铁粉形成许多微小的化学反应(原电池),还能吸附氧气和水,使反应更快地进行。
【实验拓展】同学们准备测定加热棒内铁粉、活性炭粉的质量比,自制发热包。他们取用上面实验剩下的黑色固体,进行实验。

(5)写出步骤③中白色沉淀变成红褐色沉淀的化学方程式___________ 。
(6)计算10.0g滤渣中活性炭粉的质量___________ 。(依据化学方程式计算,写出详细的计算过程)
【实验结论】该“一次性加热棒”中铁粉、活性炭粉质量比为___________ (不需化为最简整数比)。
【实验反思】若黑色粉末在探究过程中已部分锈蚀,则测定的铁粉、活性炭粉的质量比会___________ (填“偏大”、“不变”、“偏小”)。
【查阅资料】①“一次性输液加热棒”内主要成分是还原性铁粉、活性炭和氯化钠等物质;②钴粉、镍粉是能被磁铁吸引的黑色粉末;③Fe2+不能使硫氰化钾溶液变色,Fe3+能使硫氰化钾溶液变为血红色,Fe2+易被氧化:④氢氧化亚铁为白色不溶物,不稳定,易被氧化成红褐色的氢氧化铁:⑤
 。
。【提出问题】该“一次性输液加热棒”内是否真的含有这几种物质呢?为什么能发热?
【实验探究】
探究一、加热棒内是否含有氯化钠
| 操作 | 现象 | 结论 |
| 取少量黑色粉末加水溶解后过滤,取少量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,再 | 滤液中含有Cl- |
探究二、加热棒内是否含有铁粉

(1)小邱用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。小邱通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是
(2)小英查阅资料后发现还不能确定铁粉的存在。又进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液,然后滴加硫氰化钾溶液,溶液变为血红色。实验中,过氧化氢溶液的作用是
结论:溶液中有Fe2+,加热棒中含有铁粉。
探究三、加热棒内是否含有活性炭粉
(3)点燃不能被吸引的黑色粉末,
综合上述实验,小明验证了加热棒内的主要成分。
【讨论交流】
(4)据初中化学知识及查阅资料可知,发热原理是“铁粉缓慢氧化”放出热量,其中氯化钠的作用是
【实验拓展】同学们准备测定加热棒内铁粉、活性炭粉的质量比,自制发热包。他们取用上面实验剩下的黑色固体,进行实验。

(5)写出步骤③中白色沉淀变成红褐色沉淀的化学方程式
(6)计算10.0g滤渣中活性炭粉的质量
【实验结论】该“一次性加热棒”中铁粉、活性炭粉质量比为
【实验反思】若黑色粉末在探究过程中已部分锈蚀,则测定的铁粉、活性炭粉的质量比会
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】小明发现生物老师将一勺白色粉末加入鱼缸后,水中有气泡产生,奄奄一息的鱼很快就活蹦乱跳,于是对这种“白色粉末”产生兴趣,与小刚一起进行了相关探究。
(1)实验准备
①查阅资料:白色粉末的主要成分是过碳酸钠(Na2CO4),常温下与水反应生成氧气。
②用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
表中的现象Ⅰ为___________ ,现象Ⅱ对应的化学反应方程式为___________ 。
(2)实验过程
实验1:检验气体
小明用白色粉末和水反应制取并收集产生的气体时,应选用的装置是___________ (填序号)。
经检验该气体是氧气,该装置中检验氧气是否已经收集满的方法及现象为___________ 。

实验2:检验反应后溶液中的溶质成分
【猜想假设】小明猜想:Na2CO3;小刚猜想:Na2CO3和NaOH
【进行实验】小明取实验1反应后的溶液于试管中,滴加1%的CaCl2溶液,观察到有白色沉淀生成,认为自己的猜想正确。
【表达交流】
① 小刚对小明的实验方案提出质疑,他的理由是___________ 。
②为了证明小明的猜想是否正确,你的实验方案是___________ 。(请写出实验步骤、现象及结论)
(3)反思拓展
根据上述探究可知,保存该白色粉末时应注意___________ 。
(1)实验准备
①查阅资料:白色粉末的主要成分是过碳酸钠(Na2CO4),常温下与水反应生成氧气。
②用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
| NaOH溶液 | Na2CO3溶液 | |
| 滴加酚酞溶液 | 溶液变红色 | 溶液变红色 |
| 加入稀盐酸 | 无明显现象 | 现象Ⅰ |
| 加入澄清石灰水 | 无明显现象 | 现象Ⅱ |
| 加入1%的CaCl2溶液 | 溶液变浑浊 | 溶液变浑浊 |
| 加入0.1%的CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
(2)实验过程
实验1:检验气体
小明用白色粉末和水反应制取并收集产生的气体时,应选用的装置是
经检验该气体是氧气,该装置中检验氧气是否已经收集满的方法及现象为

实验2:检验反应后溶液中的溶质成分
【猜想假设】小明猜想:Na2CO3;小刚猜想:Na2CO3和NaOH
【进行实验】小明取实验1反应后的溶液于试管中,滴加1%的CaCl2溶液,观察到有白色沉淀生成,认为自己的猜想正确。
【表达交流】
① 小刚对小明的实验方案提出质疑,他的理由是
②为了证明小明的猜想是否正确,你的实验方案是
(3)反思拓展
根据上述探究可知,保存该白色粉末时应注意
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红。碱溶液可以使酚酞试液变红,是因为碱在水中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞试液变红呢?他们设计了如图三个实验,请你和他们一起探究并完成下列问题:

(1)实验Ⅰ是为了__________ ;
(2)实验Ⅱ加入蒸馏水的目的是探究水分子是否能使酚酞试液变红,小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是_______________________________ ;
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到生成__________ ,反应的化学方程式 ______________________________ 。由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞试液变红;
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-”。你认为Na2CO3溶液中存在OH-的原因是________________________ 。

(1)实验Ⅰ是为了
(2)实验Ⅱ加入蒸馏水的目的是探究水分子是否能使酚酞试液变红,小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到生成
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-”。你认为Na2CO3溶液中存在OH-的原因是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐3】小妮同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损(如图所示)。老师告诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸镁溶液中的一种。小妮同学通过查阅资料得知,常温下这三种物质的溶解度如下表:

(1)小妮同学根据上述信息。分析认为此溶液一定不是______ 溶液。
为确定其成分,该同学对此溶液进行如下实验探究:
【提出假设】
(2)该溶液可能是______ 。
【实验验证】
(3)

| 物质 | H2SO4 | Na2SO4 | MgSO4 |
| 溶解度/g | 与水任意比互溶 | 19.0 | 39.0 |
(1)小妮同学根据上述信息。分析认为此溶液一定不是
为确定其成分,该同学对此溶液进行如下实验探究:
【提出假设】
(2)该溶液可能是
【实验验证】
(3)
| 实验步骤 | 实验现象 | 实验结论 |
您最近一年使用:0次
【推荐1】在清理实验室的药品时,同学们发现一瓶氢氧化钠溶液忘记了盖瓶塞。对于该溶液是否变质,同学们提出了如下猜想:
①甲组同学的猜想是:该溶液没有变质。
②乙组同学的猜想是:该溶液部分变质。
③丙组同学的猜想是:该溶液全部变质。
三个小组的同学们根据各自猜想,分别进行如下实验:
【实验报告】
(1)请完善下面的表格。
【解释与结论】
(2)甲组的实验中,能证明该溶液已经变质的化学方程式为______ 。
(3)丙组的同学们发现乙组的实验结论错误。他们的理由是_________ 。
【反思与评价】
①在不改变被检验物质成分的情况下,排除干扰,能帮助我们得出正确结论。
②“失之毫厘,差之千里。“科学探究要有严谨的科学态度。
【拓展与延伸】
(4)经过以上探究活动,同学们认为取用药品后,应及时_______ 瓶塞,防止药品变质。
【实践与应用】
(5)对于同学们发现的这瓶溶液,下列处理方法中正确的是_____。
①甲组同学的猜想是:该溶液没有变质。
②乙组同学的猜想是:该溶液部分变质。
③丙组同学的猜想是:该溶液全部变质。
三个小组的同学们根据各自猜想,分别进行如下实验:
【实验报告】
(1)请完善下面的表格。
| 小组名称 | 甲组 | 乙组 | 丙组 |
| 药品种类 | 酸 | 碱 | 盐 |
| 实验操作 |  | 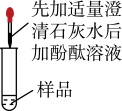 |  |
| 实验现象 | 有 | 有白色沉淀生成溶液颜色变红 | 有白色沉淀生成溶液颜色不变色 |
| 实验结论 | 该溶液已经变质 | 该溶液部分变质 | 该溶液 |
【解释与结论】
(2)甲组的实验中,能证明该溶液已经变质的化学方程式为
(3)丙组的同学们发现乙组的实验结论错误。他们的理由是
【反思与评价】
①在不改变被检验物质成分的情况下,排除干扰,能帮助我们得出正确结论。
②“失之毫厘,差之千里。“科学探究要有严谨的科学态度。
【拓展与延伸】
(4)经过以上探究活动,同学们认为取用药品后,应及时
【实践与应用】
(5)对于同学们发现的这瓶溶液,下列处理方法中正确的是_____。
| A.直接倒入下水管道 | B.检验某氯化钠溶液中是否含有氯化钙 |
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
查阅资料:
【得出结论1】三种溶液的碱性由强到弱的顺序为______ 。
【实验探究2】甲同学在烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由______ 色变为______ 色。向其中加入稀盐酸,该反应的化学方程式为______ 。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。a点表示的意义是:______ 。
【得出结论2】从微观角度分析,该反应的实质是______ 。
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。

查阅资料:碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:
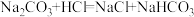 ;
;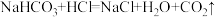
【交流与反思】(1)b点溶液中的溶质为______ (写化学式);
(2)将图2和图3的阴影部分进行叠加,发现两者基本重合,则分析资料及图2和图3可知;向Na2CO3溶液中滴加稀盐酸时,刚开始是否有气泡产生?______ (填“是”或“否”)。c点溶液中的溶质为______ (写化学式)。
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
| 液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
| 紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
| pH | 7.5~9 | 10~11.9 | 12~14 |
| 紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
【实验探究2】甲同学在烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由
【得出结论2】从微观角度分析,该反应的实质是
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。

查阅资料:碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:
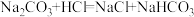 ;
;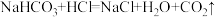
【交流与反思】(1)b点溶液中的溶质为
(2)将图2和图3的阴影部分进行叠加,发现两者基本重合,则分析资料及图2和图3可知;向Na2CO3溶液中滴加稀盐酸时,刚开始是否有气泡产生?
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程。
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱(Na2CO3)。某化学兴趣小组对纯碱的一些性质及用途开展了以下探究。
【初步探究】“侯氏制碱法”原理中,饱和氯化钠溶液吸收的两种气体是______ (写化学式),写出碳酸氢钠受热分解的化学方程式:______ 。
【继续探究】为了进一步了解Na2CO3溶液呈碱性的原因,小组同学进行了以下实验。
【查阅资料】①Na2CO3溶液呈碱性,是因为溶液中存在较多的OH-。
②Na2CO3在水中全部解离出Na+和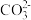 。
。
③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
④碳酸氢钠溶液显碱性。
【猜想假设】猜想一:______ 。
猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性。
猜想三: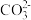 和H2O作用,产生较多的OH-,使溶液呈碱性。
和H2O作用,产生较多的OH-,使溶液呈碱性。
【实验探究】
【结论与拓展】结合以上探究,运用所学知识,并在老师的指导下,小组同学得知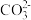 和H2O作用,除了产生较多的OH-,还应该产生另一种阴离子,请写出该阴离子的符号:
和H2O作用,除了产生较多的OH-,还应该产生另一种阴离子,请写出该阴离子的符号:______ 。
【深入探究】探究纯碱的用途
【查阅资料】Na2CO3可用于生产洗涤剂,广泛用于生活洗涤、酸类中和以及食品加工等。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
【实验结论】
(1)实验①④⑦对比,可得出的结论是______ 。
(2)要证明温度对Na2CO3溶液的碱性的影响,可选择的3个实验的编号是______ 。
【拓展应用】
(3)下列物质可用于去油污的是______ 。(填字母序号)
A.NaCl B.NaOH C.CaCl2 D.K2CO3 E.CaCO3 F.NaHCO3
【初步探究】“侯氏制碱法”原理中,饱和氯化钠溶液吸收的两种气体是
【继续探究】为了进一步了解Na2CO3溶液呈碱性的原因,小组同学进行了以下实验。
【查阅资料】①Na2CO3溶液呈碱性,是因为溶液中存在较多的OH-。
②Na2CO3在水中全部解离出Na+和
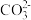 。
。③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
④碳酸氢钠溶液显碱性。
【猜想假设】猜想一:
猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性。
猜想三:
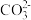 和H2O作用,产生较多的OH-,使溶液呈碱性。
和H2O作用,产生较多的OH-,使溶液呈碱性。【实验探究】
实验操作 | 实验现象 | 实验结论 |
a.向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 | 溶液无明显变化猜 | 猜想一不成立 |
b. | 溶液无明显变化 | 猜想二不成立 |
c.①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液。 ②往①所得溶液中逐滴加入CaCl2溶液至过量 | ①溶液由无色变红色 ② | 猜想三成立 |
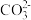 和H2O作用,除了产生较多的OH-,还应该产生另一种阴离子,请写出该阴离子的符号:
和H2O作用,除了产生较多的OH-,还应该产生另一种阴离子,请写出该阴离子的符号:【深入探究】探究纯碱的用途
【查阅资料】Na2CO3可用于生产洗涤剂,广泛用于生活洗涤、酸类中和以及食品加工等。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
溶液温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
(1)实验①④⑦对比,可得出的结论是
(2)要证明温度对Na2CO3溶液的碱性的影响,可选择的3个实验的编号是
【拓展应用】
(3)下列物质可用于去油污的是
A.NaCl B.NaOH C.CaCl2 D.K2CO3 E.CaCO3 F.NaHCO3
您最近一年使用:0次
【推荐1】同学们在实验室用生石灰做实验时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,某化学兴趣小组的同学在老师的指导下,对该生石灰样品开展了以下探究活动。
【查阅资料】20°C时氢氧化钙的溶解度为0.16g。
【提出问题】该生石灰样品的成分是什么?
【作出猜想】该生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
【实验探究】小华同学设计如下实验进行探究。
【交流讨论】
(1)同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2,理由是_______ 。
(2)小明同学提出实验③结论也不正确。他改进了实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进的实验③的操作内容是_______ 。
(3)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。
【查阅资料】20°C时氢氧化钙的溶解度为0.16g。
【提出问题】该生石灰样品的成分是什么?
【作出猜想】该生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
【实验探究】小华同学设计如下实验进行探究。
| 实验 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取样品20g于烧杯中,加水20mL搅拌溶解,用手触摸烧杯外壁。 | 烧杯外壁发热 | |
| ② | 将①中液体过滤,取少量滤液于试管中,向其中滴入 | 溶液变红 | 有Ca(OH)2 |
| ③ | 取②中过滤后的滤渣10g于试管中,向其中滴入两滴稀盐酸。 | 无CaCO3 |
【交流讨论】
(1)同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2,理由是
(2)小明同学提出实验③结论也不正确。他改进了实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进的实验③的操作内容是
(3)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】某化学小组同学收集到一些铝制易拉罐,将其剪成条状并打磨,与铝片进行相互刻
画,发现纯铝片表面有划痕。
【提出问题】通过分析上述现象,同学们认为该易拉罐不是纯铝制作的,因为合金的硬度比组成它的纯金属硬度更____ 。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】①铝制易拉罐中的主要成分是铝,可能还含有铁、铜等。
②常温下铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铁和铜都不能与氢氧化钠溶液反应。
【作出猜想】该易拉罐的金属组成除铝外,可能还含有铁和铜中的一种或两种。
【实验探究】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
【实验结论】该易拉罐组成金属包括铝、铁和铜。
【拓展应用】铝制品被大量使用,其中一个重要原因是铝具有良好的抗腐蚀性能,铝具有良好的抗腐蚀性能的原因是:________ 。
画,发现纯铝片表面有划痕。
【提出问题】通过分析上述现象,同学们认为该易拉罐不是纯铝制作的,因为合金的硬度比组成它的纯金属硬度更
【查阅资料】①铝制易拉罐中的主要成分是铝,可能还含有铁、铜等。
②常温下铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铁和铜都不能与氢氧化钠溶液反应。
【作出猜想】该易拉罐的金属组成除铝外,可能还含有铁和铜中的一种或两种。
【实验探究】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
| 实验步骤 | 实验现象 | 解释与结论 |
| (1)取一定量的样品于烧杯中,加入氢氧化钠溶液。 | 样品中含铝 | |
| (2)另取一定量的样品于烧杯中,加入足量的稀硫酸。 | 样品逐渐溶解,表面有大量气泡生成,溶液变成 | 样品中含铁 |
| (3)将(2)中得到的不溶物洗涤、干燥,向其中加入AgNO3溶液。 | 溶液由无色变成浅蓝色。 | 样品中含铜,反应的化学方程式为: |
【实验结论】该易拉罐组成金属包括铝、铁和铜。
【拓展应用】铝制品被大量使用,其中一个重要原因是铝具有良好的抗腐蚀性能,铝具有良好的抗腐蚀性能的原因是:
您最近一年使用:0次
科学探究题
|
适中
(0.65)
【推荐3】某校2019年实验操作模拟考试的一个考题是:用碳酸钠溶液鉴别稀盐酸、食盐水和澄清石灰水。
【进行实验】
写出a试管中发生反应的化学方程式_____ 。把c试管反应后的物质进行过滤,得到滤液。
【提出问题】滤液中溶质的成分是什么?
猜想一:Na2CO3和NaOH;猜想二:NaOH;猜想三:_____ 。
提示:Ca(OH)2微溶于水。
【实验过程】为证明猜想一是否正确,进行了如下实验:
同学们还对a试管反应后废液的酸碱性感兴趣,决定用pH试纸测定其pH值
【反思与交流】a试管中的废液显酸性,从环保、经济、操作简便等方面考虑,应向废液加入(写化学式)_____ 后再排放。
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 分别用a、b、c三支试管取样,各加入一定量碳酸钠溶液 | a中有气泡产生 | a中物质是稀盐酸 |
| b中无明显现象 | b中物质是食盐水 | |
| c中 | c中物质是澄清石灰水 |
写出a试管中发生反应的化学方程式
【提出问题】滤液中溶质的成分是什么?
猜想一:Na2CO3和NaOH;猜想二:NaOH;猜想三:
提示:Ca(OH)2微溶于水。
【实验过程】为证明猜想一是否正确,进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取一定量滤液于试管中,加入一种盐溶液 (写溶质化学式) | 有白色沉淀 | 猜想一正确 |
同学们还对a试管反应后废液的酸碱性感兴趣,决定用pH试纸测定其pH值
| 用pH试纸测定a试管反应后废液酸碱性的过程 | 测定结果 |
| 在白瓷板上放一小片pH试纸,用玻璃棒蘸取 | pH<7(废液显酸性) |
【反思与交流】a试管中的废液显酸性,从环保、经济、操作简便等方面考虑,应向废液加入(写化学式)
您最近一年使用:0次



