小明在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了探究.
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe Fe2(SO4)3+6H2O+3SO2↑
Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
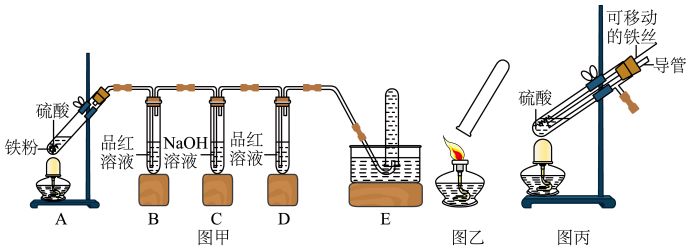
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
(1)请帮助小明完成下表:
【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫.
(2)【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式________ ,写出实验二中发生爆鸣反应的化学方程式________ .
(2)实验一中C装置的作用是________ .
【拓展延伸】小明又将A装置进行了如图所示的改进,试分析:增加的导管下端伸入液面以下原因________ ,该导管所起的作用是_________ .

【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe
 Fe2(SO4)3+6H2O+3SO2↑
Fe2(SO4)3+6H2O+3SO2↑(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
(1)请帮助小明完成下表:
| 实验现象 | A中生成气体成分 | ||||
| B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
| 实验一 | 98% | 不褪色 | 无爆鸣声 | 只有SO2 | |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | |
| 实验三 | 25% | 不褪色 | 只有H2 | ||
(2)【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式
(2)实验一中C装置的作用是
【拓展延伸】小明又将A装置进行了如图所示的改进,试分析:增加的导管下端伸入液面以下原因
更新时间:2018-05-01 08:19:30
|
相似题推荐
科学探究题
|
较难
(0.4)
名校
【推荐1】在学习了酸碱盐的性质后,同学们进行了如下探究:
(1)甲组同学探究“稀盐酸与氢氧化钙溶液能否反应”,做了如图所示的实验:
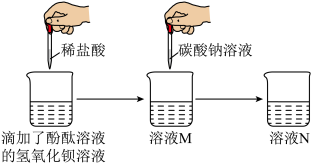
①同学们在烧杯中加入10mL氢氧化钙溶液,然后滴加无色酚酞溶液,再向烧杯中滴加稀盐酸,边滴边搅拌,当观察到_______ ,得出稀盐酸与氢氧化钙溶液能发生反应的结论,写出反应的化学方程式__________ 。
②同学们继续向溶液M中滴加碳酸钠溶液,发现只产生白色沉淀,无其它实验现象。由此可知,溶液M中除了含有酚酞外,还含有的溶质是__________ (填化学式)。
(2)乙组同学探究“甲组最终所得溶液N的溶质成分是什么(不考虑酚酞)”。
【猜想与假设】猜想一:NaCl、CaCl2
猜想二:NaCl
猜想三:NaCl、Na2CO3
【分析与交流】上述猜想中不合理的是猜想_________ 。三个猜想中都含有NaC1的依据是:__________ (用化学方程式表示)。
【活动与探究】同学们取少量溶液N,向其中滴加__________ ,观察到___________ ,即可确定猜想二正确。
【总结与提升】通过上述探究可知:一般我们都是从生成物和反应物两个角度对反应后溶液中的溶质成分做出猜想,并结合实验现象排除不合理猜想,然后再设计实验验证猜想。
(3)丙组同学探究“甲组所用盐酸的溶质质量分数”,设计如下方案:.称取12g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为107.6g(气体的溶解忽略不计)。请计算该稀盐酸的溶质质量分数。(写出计算过程)
(1)甲组同学探究“稀盐酸与氢氧化钙溶液能否反应”,做了如图所示的实验:

①同学们在烧杯中加入10mL氢氧化钙溶液,然后滴加无色酚酞溶液,再向烧杯中滴加稀盐酸,边滴边搅拌,当观察到
②同学们继续向溶液M中滴加碳酸钠溶液,发现只产生白色沉淀,无其它实验现象。由此可知,溶液M中除了含有酚酞外,还含有的溶质是
(2)乙组同学探究“甲组最终所得溶液N的溶质成分是什么(不考虑酚酞)”。
【猜想与假设】猜想一:NaCl、CaCl2
猜想二:NaCl
猜想三:NaCl、Na2CO3
【分析与交流】上述猜想中不合理的是猜想
【活动与探究】同学们取少量溶液N,向其中滴加
【总结与提升】通过上述探究可知:一般我们都是从生成物和反应物两个角度对反应后溶液中的溶质成分做出猜想,并结合实验现象排除不合理猜想,然后再设计实验验证猜想。
(3)丙组同学探究“甲组所用盐酸的溶质质量分数”,设计如下方案:.称取12g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为107.6g(气体的溶解忽略不计)。请计算该稀盐酸的溶质质量分数。(写出计算过程)
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】有一包白色固体样品,可能含氢氧化钠、氯化钠、碳酸钠、硫酸钠、硝酸钡中的一种或几种。某同学为探究其成分,完成了以下实验:
实验一:初步探究固体的组成
①取少量白色固体溶于水,得到无色溶液,再滴入几滴紫色石蕊溶液,将溶液等分为两份,分装于甲乙两个烧杯中。
②往烧杯甲中加入稀硫酸,产生沉淀A的质量与所加稀硫酸质量关系如图所示。

③往烧杯乙中通入一定量CO2,产生沉淀B。
请回答:(1)写出步骤②中生成沉淀A的一个化学方程式_____ 。
(2)步骤①中滴入石蕊后溶液显_______ 色。
(3)原样品中,一定不存在的物质是_____ (填化学式)。
实验二:②③两步操作结束后,将烧杯甲的物质全部倒入烧杯乙中,进一步探究,可知原样品中没有氯化钠。

(4)(沉淀A质量+沉淀B质量)_____ 沉淀C质量(“>”“<”“=”或“无法确定”)。
(5)红色溶液X中一定含有的溶质除石蕊以外是_____ (填化学式)。
实验一:初步探究固体的组成
①取少量白色固体溶于水,得到无色溶液,再滴入几滴紫色石蕊溶液,将溶液等分为两份,分装于甲乙两个烧杯中。
②往烧杯甲中加入稀硫酸,产生沉淀A的质量与所加稀硫酸质量关系如图所示。

③往烧杯乙中通入一定量CO2,产生沉淀B。
请回答:(1)写出步骤②中生成沉淀A的一个化学方程式
(2)步骤①中滴入石蕊后溶液显
(3)原样品中,一定不存在的物质是
实验二:②③两步操作结束后,将烧杯甲的物质全部倒入烧杯乙中,进一步探究,可知原样品中没有氯化钠。

(4)(沉淀A质量+沉淀B质量)
(5)红色溶液X中一定含有的溶质除石蕊以外是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】定性定量探究实验:
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳。
(1)镁、铝具有许多相似的金属性,同时也存在着一定的差异性。镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaA1O2表示)和H2,写出该反应的化学方程式:________ 。
(2)三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数。
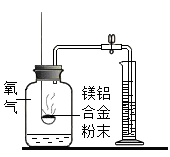
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积。
如图所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹。参与反应的氧气体积与___________ 相等。
方案二:铝镁合金与盐酸反应,测定生成气体的体积。装置如图所示。
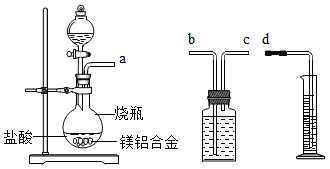
①通过排水法测定所收集到的氢气体积,装置导管口a、b、c、d的连接顺序是:a→________ →________ →________ 。
②反应结束,冷却至室温。烧瓶内还留有气体,对实验结果_________ (填“有”或“没有”)影响。
方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量。称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如图:
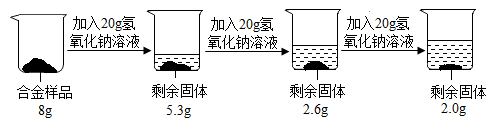
①实验中所加的氢氧化钠溶液应过量,其目的是________ 。
②从上图数据可知,该合金中镁元素与铝元素的质量比为________ 。
【总结反思】
(3)利用铝镁合金中铝与氢氧化钠溶液反应和方案二装置,通过测定________ 体积,也可得出合金中铝的质量。
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳。
(1)镁、铝具有许多相似的金属性,同时也存在着一定的差异性。镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaA1O2表示)和H2,写出该反应的化学方程式:
(2)三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数。
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积。
如图所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹。参与反应的氧气体积与

方案二:铝镁合金与盐酸反应,测定生成气体的体积。装置如图所示。

①通过排水法测定所收集到的氢气体积,装置导管口a、b、c、d的连接顺序是:a→
②反应结束,冷却至室温。烧瓶内还留有气体,对实验结果
方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量。称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如图:

①实验中所加的氢氧化钠溶液应过量,其目的是
②从上图数据可知,该合金中镁元素与铝元素的质量比为
【总结反思】
(3)利用铝镁合金中铝与氢氧化钠溶液反应和方案二装置,通过测定
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究:
[提出问题]金属与盐酸反应剧烈程度受哪些因素的影响?
[作出猜想]a、可能与金属本身的性质有关 b、可能与盐酸的浓度有关
[设计探究]实验所用金属均已用砂纸打磨
(1)实验①为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同浓度,相同质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,铁和稀盐酸反应的化学方程式为__________ 。从实验现象可判断:金属活动性Zn _______ Fe (填“<”“=”“>”)。
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是________ 。
(2)实验②为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是_________ 。

所用药品,实验数据如下表:
(3)得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是__________ 。
(4)[反思评价]根据表中实验II数据分析,锌与盐酸发生反应快慢的变化情况为________ ,其原因为 _______ 。
(5)通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响_______ (写一条即可)。
[提出问题]金属与盐酸反应剧烈程度受哪些因素的影响?
[作出猜想]a、可能与金属本身的性质有关 b、可能与盐酸的浓度有关
[设计探究]实验所用金属均已用砂纸打磨
(1)实验①为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同浓度,相同质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,铁和稀盐酸反应的化学方程式为
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是
(2)实验②为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是

所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分|钟 | 1~2分钟 | 2~3分钟 | 3~4分钟 | 4~5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
(3)得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是
(4)[反思评价]根据表中实验II数据分析,锌与盐酸发生反应快慢的变化情况为
(5)通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】定性定量探究实验:
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳。
(1)镁、铝具有许多相似的金属性,同时也存在着一定的差异性。镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaA1O2表示)和H2,写出该反应的化学方程式:________ 。
(2)三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数。
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积。
如图所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹。参与反应的氧气体积与___________ 相等。

方案二:铝镁合金与盐酸反应,测定生成气体的体积。装置如图所示。

①通过排水法测定所收集到的氢气体积,装置导管口a、b、c、d的连接顺序是:a→________ →________ →________ 。
②反应结束,冷却至室温。烧瓶内还留有气体,对实验结果_________ (填“有”或“没有”)影响。
方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量。称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如图:

①实验中所加的氢氧化钠溶液应过量,其目的是________ 。
②从上图数据可知,该合金中镁元素与铝元素的质量比为________ 。
【总结反思】
(3)利用铝镁合金中铝与氢氧化钠溶液反应和方案二装置,通过测定________ 体积,也可得出合金中铝的质量。
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳。
(1)镁、铝具有许多相似的金属性,同时也存在着一定的差异性。镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaA1O2表示)和H2,写出该反应的化学方程式:
(2)三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数。
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积。
如图所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹。参与反应的氧气体积与

方案二:铝镁合金与盐酸反应,测定生成气体的体积。装置如图所示。

①通过排水法测定所收集到的氢气体积,装置导管口a、b、c、d的连接顺序是:a→
②反应结束,冷却至室温。烧瓶内还留有气体,对实验结果
方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量。称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如图:

①实验中所加的氢氧化钠溶液应过量,其目的是
②从上图数据可知,该合金中镁元素与铝元素的质量比为
【总结反思】
(3)利用铝镁合金中铝与氢氧化钠溶液反应和方案二装置,通过测定
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
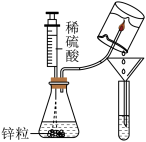
【推荐3】某学习小组同学在做“氢气在空气中燃烧”实验时。对生成物的成分产生了质疑:水和过氧化氢具有相同的组成元素,那么氢气在空气中燃烧除生成水外,是否有过氧化氢生成?带着疑问,该小组进行了以下探究:
[提出猜想]氢气在空气中燃烧除生成水外,还有过氧化氢生成。
[查阅资料]过氧化氢溶液能使无色的淀粉碘化钾溶液变成蓝色。
[实验过程]
[评价与反思](1)点燃氢气前应先__________________ ,其具体操作是_____ 。
(2)写出氢气在氧气中燃烧生成过氧化氢的化学方程式______________________ 。
(3)实验中,将氢气燃烧的火焰对冰,冰的作用是______________________ 。
①用冰有利于吸收氢气燃烧产生的气体
②用冰创设低温环境,使部分氢气燃烧产生一定量的过氧化氢
③有利于生成的过氧化氢在较低的温度下溶入冰融化成的水中,便于收集
[拓展应用]根据推理法,氢气和氧气反应会生成两种氧化物。金属钠也具有类似的化学性质;钠露置在空气中与氧气反应生成________________ ;钠在空气中燃烧生成_______________________ 。

[提出猜想]氢气在空气中燃烧除生成水外,还有过氧化氢生成。
[查阅资料]过氧化氢溶液能使无色的淀粉碘化钾溶液变成蓝色。
[实验过程]
| 实验步骤 | 实验现象 | 实验结论 |
| ①将注射器内的稀硫酸注入到盛有锌粒的锥形瓶中 | 在锌粒表面有 | 氢气在空气中燃烧有过氧化氢生成 |
| ②点燃生成的氢气,用底部结有冰的小烧杯罩在火焰上方,用漏斗和试管收集所得液体。向试管中加入 | 氢气燃烧产生淡蓝色火焰,试管中液体由无色变 |
(2)写出氢气在氧气中燃烧生成过氧化氢的化学方程式
(3)实验中,将氢气燃烧的火焰对冰,冰的作用是
①用冰有利于吸收氢气燃烧产生的气体
②用冰创设低温环境,使部分氢气燃烧产生一定量的过氧化氢
③有利于生成的过氧化氢在较低的温度下溶入冰融化成的水中,便于收集
[拓展应用]根据推理法,氢气和氧气反应会生成两种氧化物。金属钠也具有类似的化学性质;钠露置在空气中与氧气反应生成
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】某学校化学兴趣小组的同学在探究盐的化学性质时,做了如下甲、乙2个实验:
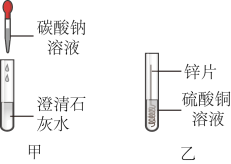
(1)实验乙观察到的现象是:___________ ,溶液由蓝色变成无色。反应的化学方程式为___________ 。
(2)有同学把实验甲、乙反应后的溶液倒入一烧杯中,发现有白色沉淀。同学们决定对该白色沉淀的成分进行探究。
【查阅资料】Zn(OH)2和ZnCO3均为白色固体,难溶于水,可溶于强酸和强碱溶液。
【提出猜想】白色沉淀为:
Ⅰ.Zn(OH)2;
Ⅱ.ZnCO3;
Ⅲ.___________ 。
经过思考讨论,同学们认为猜想Ⅱ不成立,原因是___________ 。
【实验验证】
【拓展与思考】若猜想Ⅰ成立,则实验甲要满足的条件为___________ 。

(1)实验乙观察到的现象是:
(2)有同学把实验甲、乙反应后的溶液倒入一烧杯中,发现有白色沉淀。同学们决定对该白色沉淀的成分进行探究。
【查阅资料】Zn(OH)2和ZnCO3均为白色固体,难溶于水,可溶于强酸和强碱溶液。
【提出猜想】白色沉淀为:
Ⅰ.Zn(OH)2;
Ⅱ.ZnCO3;
Ⅲ.
经过思考讨论,同学们认为猜想Ⅱ不成立,原因是
【实验验证】
| 实验操作 | 实验现象 | 结论及化学方程式 |
| 取少量白色沉淀,加盐酸至过量 | 猜想Ⅲ成立,化学方程式为: |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐2】化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到___________ 证明二氧化碳与氢氧化钠发生了反应。
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3;
贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性,Na2CO3溶液呈碱性,俗称纯碱。
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整。
【实验反思】同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是____________ 。
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3;
贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性,Na2CO3溶液呈碱性,俗称纯碱。
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整。
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量 | 贝贝的猜想成立 |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
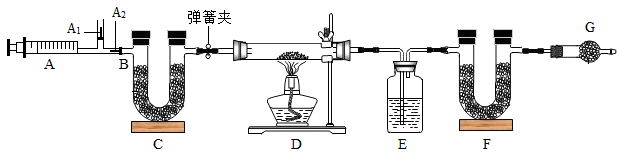
【推荐3】我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:
已知:1.碳酸钠比较稳定,加热时不分解 ;
2. 2NaHCO3 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
(一)实验步骤 :
(1)实验时,组装好装置,实验前应先_______________________ ,然后,实验步骤是:
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反 应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为_________ ,E的作用是 ________________________ 。C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 __________ , F的作用是 _______________________ 。写出 F装置中所发生反应的一个化学方程式 _________________________ 。
(3)实验步骤②与③能否颠倒_______ (填“能”或“不能”)。若不进行步骤④的操作,则所测得的碳酸氢钠质量 ________ (填“偏大”、“偏小”、“无影响”), 该操作中推注射器时缓缓的目的是 __________________________ ;若没有G装置,则碳酸氢钠的质量 ____________ (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
则: ① 碳酸氢钠分解生成二氧化碳的质量为 ______ g
② 碳酸氢钠的质量为_______________ g
③ 该天然碱的化学式中a:b:c=_________________ 。

已知:1.碳酸钠比较稳定,加热时不分解 ;
2. 2NaHCO3
 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
(一)实验步骤 :
(1)实验时,组装好装置,实验前应先
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反 应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为
(3)实验步骤②与③能否颠倒
(4)下表是实验记录数据:
| 反应前 | 反应后 |
| E的质量为100.0g | E的质量为102.25g |
| F的质量为50.0g | F的质量为51.1g |
② 碳酸氢钠的质量为
③ 该天然碱的化学式中a:b:c=
您最近一年使用:0次



