我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动

【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】(1)木炭与CuO的反应是:C+2CuO 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4====Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③_______________ .
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再加少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,____________ ,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水_______________ ,此时停止加热。
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
【评价反思】
(1)使用图乙装置与使用图甲装置相比,其优点是_______________ (写出1条即可);
(2)要证明氯化钙CaCl2是催化剂还需要验证CaCl2反应前后__________________ 不变.
【拓展提高】
我们生活中的铜有一部分是由辉铜矿【主要成分为硫化亚铜(Cu2S)】的矿石冶炼而成,经测定该矿石由硫化亚铜(Cu2S)和其他不含铜元素的物质组成.现用100g该矿石制得2.16g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是__________ g.若制得氧化亚铜(Cu2O)的过程中,铜元素的总损耗为20%,通过计算确定该矿石中硫化亚铜(Cu2S)的质量分数_________ ?(请写出计算过程).

【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】(1)木炭与CuO的反应是:C+2CuO
 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4====Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再加少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
| 步骤 | 现象 | 结论 |
| ①取2.88g红色固体装入试管,滴入足量 的 | 红色固体部分减少,溶液变 为 | 猜想 |
| ②滤了试管中残留的红色固体,洗涤干燥 称其质量为2.08g | 猜想 |
【评价反思】
(1)使用图乙装置与使用图甲装置相比,其优点是
(2)要证明氯化钙CaCl2是催化剂还需要验证CaCl2反应前后
【拓展提高】
我们生活中的铜有一部分是由辉铜矿【主要成分为硫化亚铜(Cu2S)】的矿石冶炼而成,经测定该矿石由硫化亚铜(Cu2S)和其他不含铜元素的物质组成.现用100g该矿石制得2.16g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是
更新时间:2018-07-14 16:06:08
|
相似题推荐
【推荐1】某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从图中选择装置进行了气体的制备实验。

(1)写出仪器a的名称:______ 
(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的表达式为:______ 。
在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口______ ,然后稍稍用力把玻璃管旋入胶皮管。收集满氧气取出集气瓶应______ (填正或倒)放在桌面上,其后的操作是:应先______ 再______ 。
(3)实验室常用锌粒和稀硫酸直接反应制取氢气,选择的发生装置为______ 若用如图装置进行“排水法”收集氢气,则氢气应从______ 端通入(填“a”或“b”)。

(4)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的O2大于理论产量,针对这一现象,同学们进行了如下探究:
【提出猜想】
猜想I:反应生成的MnO2分解放出O2;
猜想Ⅱ:______ ;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解都放出O2。
【实验验证】同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想______ 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论,该组同学选择的实验方法是______ 。
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?______ 。
【实验反思】通过以上实验探究,你对“实验制取氧气”还想探究的问题是______ 。

(1)写出仪器a的名称:

(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的表达式为:
在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口
(3)实验室常用锌粒和稀硫酸直接反应制取氢气,选择的发生装置为

(4)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的O2大于理论产量,针对这一现象,同学们进行了如下探究:
【提出猜想】
猜想I:反应生成的MnO2分解放出O2;
猜想Ⅱ:
猜想Ⅲ:反应生成的K2MnO4和MnO2分解都放出O2。
【实验验证】同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
【实验反思】通过以上实验探究,你对“实验制取氧气”还想探究的问题是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】广东省在氢能产业发展中领跑全国,工业制氢方式有多种。
Ⅰ.天然气制氢
天然气重整制氢过程中,涉及甲烷和水蒸气在高温和催化剂的条件下生成一氧化碳和氢气。
(1)写出上述反应的化学方程式___________ 。
(2)反应前后催化剂的化学性质和质量___________ (填 “不变”或“改变”)。
Ⅱ.电解水制氢
(3)利用电解水的方法制取2吨氢气,理论上需要水的质量为多少吨?_________ (写出计算过程)。
Ⅲ.不同制氢方式比较
不同制氢方式的二氧化碳排放量 单位:kg(CO2)/kg(H2)
(4)从上表可以看出,二氧化碳总排放量较大的制氢方式是__________ , 由此推测当前工业用电主要来自_______________ 。
a.水力发电 b.火力发电 c.核能发电
Ⅰ.天然气制氢
天然气重整制氢过程中,涉及甲烷和水蒸气在高温和催化剂的条件下生成一氧化碳和氢气。
(1)写出上述反应的化学方程式
(2)反应前后催化剂的化学性质和质量
Ⅱ.电解水制氢
(3)利用电解水的方法制取2吨氢气,理论上需要水的质量为多少吨?
Ⅲ.不同制氢方式比较
不同制氢方式的二氧化碳排放量 单位:kg(CO2)/kg(H2)
| 制氢方式 | 直接排放量 | 间接排放量 |
| 天然气制氢 | 10.91 | 2.15 |
| 电解水制氢 | 0 | 53.89 |
a.水力发电 b.火力发电 c.核能发电
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】某化学兴趣小组对日常使用的干电池产生兴趣
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
“黑色物质”是碳棒周围的混合剂,其成分为二氧化锰,碳粉和氯化铵等,总称为“碳包”。
已知:氯化铵能溶于水
(二)回收黑色粉末中的二氧化锰:

(1)干电池使用时将化学能转化成_____ 能。
(2)上述操作中灼烧的目的是_____ ;
(3)过滤时用到的玻璃仪器是玻璃棒、_____ 和_____ ,玻璃棒的做作用是_____ 。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现_____ 的现象,说明为二氧化锰,二氧化锰在该反应前后_____ 和_____ 都不发生变化。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。最终得到ZnSO4﹒7H2O晶体。
(5)步骤①中反应方程式为_____ ,将锌皮剪碎的目的是_____ 。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为273毫升。已知实验条件下氢气的密度为0.09g/L。

(6)计算该锌皮中锌的质量分数_____ 。(写出计算过程)
(7)上述方法测得的锌的质量分数偏大,不可能的原因是_____ 。
A 没等装置冷却就读数
B 锌皮中含有少量铁
C 试管中有气体没有排出
D 将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
“黑色物质”是碳棒周围的混合剂,其成分为二氧化锰,碳粉和氯化铵等,总称为“碳包”。
已知:氯化铵能溶于水
(二)回收黑色粉末中的二氧化锰:

(1)干电池使用时将化学能转化成
(2)上述操作中灼烧的目的是
(3)过滤时用到的玻璃仪器是玻璃棒、
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。最终得到ZnSO4﹒7H2O晶体。
(5)步骤①中反应方程式为
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为273毫升。已知实验条件下氢气的密度为0.09g/L。

(6)计算该锌皮中锌的质量分数
(7)上述方法测得的锌的质量分数偏大,不可能的原因是
A 没等装置冷却就读数
B 锌皮中含有少量铁
C 试管中有气体没有排出
D 将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】着全球“双碳”目标的提出,氨作为氢的载体,越来越引起全国重视,氨气正在由肥料走向燃料。
Ⅰ.氨气、氢气都属于清洁能源,其性质对比参数(图1):______ ,______ 。
(2)将氨气置于空气中发现无法燃烧,而在氧气流中却燃烧起来,说明氨气燃烧与______ 有关。与NH3相比,甲烷燃料过度使用会造成的环境问题是______ 。
Ⅱ.在氨气中添加适量的氢气,进行混合燃烧。科学研究不同当量比下的氨气/氢气/空气的燃烧速度如图2:
(3)分析图中数据发现当量比为_______ 左右,x(NH3)=_______ ,燃烧速度最快。
(4)已知氨气燃烧生成了空气中含量最多的气体,该气体的化学式是_______ 。
Ⅲ.探究制备氨燃料的方法
【方案1】利用碳酸氢铵制备氨气
【方案2】利用铵盐溶液和碱溶液混合加热制备氨气
【方案3】我国科研团队借助一种固体催化剂LDH,在常温、常压和可见光条件下,用氮气和水合成氨气(NH3)的原理如图4所示。______ 。
(6)利用氯化铵溶液和氢氧化钠溶液混合加热制氨气,写出反应的化学方程式_______ ,实验过程中发现此方法制得的氨气量少,可能的原因是______ 。
(7)经讨论改用铵盐固体和碱固体混合物来提高氨气产量(图3),出现_______ 现象证明氨气收集满了。_______ g?(假设杂质不参加反应)。
(9)方案3的反应总方程式是_______ 。
Ⅰ.氨气、氢气都属于清洁能源,其性质对比参数(图1):

(2)将氨气置于空气中发现无法燃烧,而在氧气流中却燃烧起来,说明氨气燃烧与
Ⅱ.在氨气中添加适量的氢气,进行混合燃烧。科学研究不同当量比下的氨气/氢气/空气的燃烧速度如图2:

(3)分析图中数据发现当量比为
(4)已知氨气燃烧生成了空气中含量最多的气体,该气体的化学式是
Ⅲ.探究制备氨燃料的方法
【方案1】利用碳酸氢铵制备氨气
【方案2】利用铵盐溶液和碱溶液混合加热制备氨气
【方案3】我国科研团队借助一种固体催化剂LDH,在常温、常压和可见光条件下,用氮气和水合成氨气(NH3)的原理如图4所示。

(6)利用氯化铵溶液和氢氧化钠溶液混合加热制氨气,写出反应的化学方程式
(7)经讨论改用铵盐固体和碱固体混合物来提高氨气产量(图3),出现

(9)方案3的反应总方程式是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:

(1)上表中,第10分钟时,x=______________ 。
(2)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线_______ ;
(3)计算大理石样品中碳酸钙的质量分数_______ 。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,你认为对测量结果有没有影响_______ ?


时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x=
(2)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线
(3)计算大理石样品中碳酸钙的质量分数
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,你认为对测量结果有没有影响

您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展探究。
任务一:了解纯碱的制备——“侯氏制碱法”
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,反应生成碳酸氢钠和氯化铵( ),再加热碳酸氢钠即可制得纯碱。
),再加热碳酸氢钠即可制得纯碱。______ (填“酸”“碱”或“盐”)。
(2)饱和氯化钠溶液吸收的两种气体是______(填字母序号)。
任务二:分析纯碱的纯度——工业纯碱中碳酸钠的质量分数
已知制得的纯碱样品中含有少量氯化钠,某探究小组欲测定该纯碱的纯度。
提示:本实验的化学方程式为:
【实验步骤】
(3)①组装如下图装置,并______ 。
②称取一定量的样品放入锥形瓶中,加少量水溶解,并在其他装置中加入相应的药品;
③打开止水夹K,缓缓通入一段时间 后关闭K,称取装置C的质量;
后关闭K,称取装置C的质量;
④打开盛放稀硫酸仪器的旋塞滴入稀硫酸,直到______ 。
⑤再次打开止水夹K,缓缓通入一段时间 ,再次称量装置C的质量;
,再次称量装置C的质量;
⑥计算出样品中碳酸氢钠的质量分数。
(4)B装置的作用是______ 。
(5)步骤⑤中缓缓通入一段时间 的目的是
的目的是______ 。
(6)如果缺少装置D,所测样品中碳酸钠的质量分数______ (填“偏大”“偏小”或“不变”)。
(7)取 碳酸钠固体样品于锥形瓶中,加入足量的稀硫酸,若C处固体增重
碳酸钠固体样品于锥形瓶中,加入足量的稀硫酸,若C处固体增重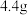 ,计算样品中碳酸钠的质量分数?(写出计算过程,结果精确到
,计算样品中碳酸钠的质量分数?(写出计算过程,结果精确到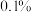 )
)
任务三:探究纯碱的用途——用于生产洗涤剂
【查阅资料】 可用于生产洗涤剂。
可用于生产洗涤剂。 溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。 的化学性质和
的化学性质和 相似。
相似。
【实验探究】兴趣小组继续对影响 溶液去油污效果的因素进行探究。
溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为 、
、 和
和 的
的 溶液,并测定溶液pH,记录数据如表:
溶液,并测定溶液pH,记录数据如表:
【解释与结论】
(8)实验①、②、③对比,可得出的结论是______ 。
(9)要证明 溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是
溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是______ 。
【拓展与应用】
(10)下列物质可用于去油污的是______(填字母序号)。
任务一:了解纯碱的制备——“侯氏制碱法”
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,反应生成碳酸氢钠和氯化铵(
 ),再加热碳酸氢钠即可制得纯碱。
),再加热碳酸氢钠即可制得纯碱。
(2)饱和氯化钠溶液吸收的两种气体是______(填字母序号)。
A. | B. | C. | D. |
任务二:分析纯碱的纯度——工业纯碱中碳酸钠的质量分数
已知制得的纯碱样品中含有少量氯化钠,某探究小组欲测定该纯碱的纯度。
提示:本实验的化学方程式为:

【实验步骤】
(3)①组装如下图装置,并
②称取一定量的样品放入锥形瓶中,加少量水溶解,并在其他装置中加入相应的药品;
③打开止水夹K,缓缓通入一段时间
 后关闭K,称取装置C的质量;
后关闭K,称取装置C的质量;④打开盛放稀硫酸仪器的旋塞滴入稀硫酸,直到
⑤再次打开止水夹K,缓缓通入一段时间
 ,再次称量装置C的质量;
,再次称量装置C的质量;⑥计算出样品中碳酸氢钠的质量分数。

(4)B装置的作用是
(5)步骤⑤中缓缓通入一段时间
 的目的是
的目的是(6)如果缺少装置D,所测样品中碳酸钠的质量分数
(7)取
 碳酸钠固体样品于锥形瓶中,加入足量的稀硫酸,若C处固体增重
碳酸钠固体样品于锥形瓶中,加入足量的稀硫酸,若C处固体增重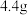 ,计算样品中碳酸钠的质量分数?(写出计算过程,结果精确到
,计算样品中碳酸钠的质量分数?(写出计算过程,结果精确到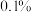 )
)任务三:探究纯碱的用途——用于生产洗涤剂
【查阅资料】
 可用于生产洗涤剂。
可用于生产洗涤剂。 溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。 的化学性质和
的化学性质和 相似。
相似。【实验探究】兴趣小组继续对影响
 溶液去油污效果的因素进行探究。
溶液去油污效果的因素进行探究。用不同温度的水,配制溶质质量分数分别为
 、
、 和
和 的
的 溶液,并测定溶液pH,记录数据如表:
溶液,并测定溶液pH,记录数据如表:| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 溶质质量分数 |  |  |  |  |  |  |  |  |  |
溶液温度( ) ) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
| 溶液pH | 10.9 | 11.1 | 11.2 | 11.0 | 11.27 | 11.30 | 11.22 | 11.46 | 11.5 |
(8)实验①、②、③对比,可得出的结论是
(9)要证明
 溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是
溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是【拓展与应用】
(10)下列物质可用于去油污的是______(填字母序号)。
A. | B. | C. | D. |
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】铜是人类较早冶炼和使用的金属。
I.关于古法炼铜
下图为古法炼铜流程,以孔雀石和木炭为原料,经高温煅烧,冷却得到块状金属铜。
(1)Cu2(OH)2CO3受热分解的反应方程式是________ 。
(2)工艺中木炭的主要作用有两个:①________ ;②直接与氧化铜反应生成铜。
(3)球形容器封盖后保留细小通气孔的目的是________ 。
(4)此法冶炼产物是铜块而不是散落在炭粉中的铜颗粒,原因是________ 。
Ⅱ.关于现代炼铜
下图为现代工业用黄铜矿火法炼铜的部分流程。________ (选填“石灰水”或“石灰浆”)吸收炉气。
(6)吹炼中,冰铜中FeS在高温下被氧化成氧化亚铁和SO2,该反应的化学方程式为________ 。
(7)精炼时竖炉内部进气管常设计成环形(如图),该设计的优点是________ 。
景泰蓝的制作工艺主要有制胎、掐丝、烧蓝、磨光、镀金等。
(8)以铜为材料,加工成丝后弯曲转折成所需的图案,这利用了铜的________ (填一种物理性质),利用黄铜、青铜制作焊料是因为其熔点比纯铜________ (填“高”或“低”)。
(9)景泰蓝工艺将釉料涂在铜器表面,烧制后牢固附着于金属表面,既能够________ ,又起到了美化装饰效果。
IV.关于含铜元素物质的相互转化
A、B、C为含铜元素的不同类别物质,物质间的转化关系如图所示,其中B为配制波尔多液的原料之一(“→”表示物质之间可以转化):________ 。
(11)A→B的反应现象是________ 。
(12)B→C的化学方程式为________ 。
(13)以上转化中未涉及的基本反应类型是________ 。
I.关于古法炼铜
下图为古法炼铜流程,以孔雀石和木炭为原料,经高温煅烧,冷却得到块状金属铜。

(1)Cu2(OH)2CO3受热分解的反应方程式是
(2)工艺中木炭的主要作用有两个:①
(3)球形容器封盖后保留细小通气孔的目的是
(4)此法冶炼产物是铜块而不是散落在炭粉中的铜颗粒,原因是
Ⅱ.关于现代炼铜
下图为现代工业用黄铜矿火法炼铜的部分流程。

(6)吹炼中,冰铜中FeS在高温下被氧化成氧化亚铁和SO2,该反应的化学方程式为
(7)精炼时竖炉内部进气管常设计成环形(如图),该设计的优点是

景泰蓝的制作工艺主要有制胎、掐丝、烧蓝、磨光、镀金等。
(8)以铜为材料,加工成丝后弯曲转折成所需的图案,这利用了铜的
(9)景泰蓝工艺将釉料涂在铜器表面,烧制后牢固附着于金属表面,既能够
IV.关于含铜元素物质的相互转化
A、B、C为含铜元素的不同类别物质,物质间的转化关系如图所示,其中B为配制波尔多液的原料之一(“→”表示物质之间可以转化):

(11)A→B的反应现象是
(12)B→C的化学方程式为
(13)以上转化中未涉及的基本反应类型是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】人类对于金属的利用已经几千年,金属材料的应用推动了社会的进步。
资料 1:春秋时期,楚国人在铜绿山上采孔雀石进行火法炼铜,制造青铜剑,其中孔雀石的主要成分为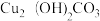 。
。
资料 2:西汉时期,人们研究了湿法炼铜,是用硫酸铜溶液和铁进行反应。
(1)青铜属于______ (选填“纯金属”或“合金”),青铜制造剑的优点是____________ 。
(2)用孔雀石火法炼铜过程如图过程:

①孔雀石中的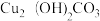 高温分解可生成氧化铜、二氧化碳和水,写出该反应的化学方程式
高温分解可生成氧化铜、二氧化碳和水,写出该反应的化学方程式________ ;过程②发生的化学反应基本类型是_________ 。
(3)写出湿法炼铜的化学方程式_________ 。
(4)现代高炉炼铁制得的是生铁,一包久置空气中的生铁粉末(成分碳、铁、氧化铁),为测定各成分的含量,小丽进行了以下实验探究。

①如上图,反应前小丽先通入氢气一段时间,再点燃 A 处酒精灯,继续通入足量氢气进行反应,实验结束后 A 中固体为________ (填化学式)。
②测定样品中氧化铁的质量分数,需要测定的实验数据有_______ ,若没有装置 C,测定结果是否有影响?并说明理由_______ 。
资料 1:春秋时期,楚国人在铜绿山上采孔雀石进行火法炼铜,制造青铜剑,其中孔雀石的主要成分为
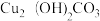 。
。资料 2:西汉时期,人们研究了湿法炼铜,是用硫酸铜溶液和铁进行反应。
(1)青铜属于
(2)用孔雀石火法炼铜过程如图过程:

①孔雀石中的
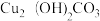 高温分解可生成氧化铜、二氧化碳和水,写出该反应的化学方程式
高温分解可生成氧化铜、二氧化碳和水,写出该反应的化学方程式(3)写出湿法炼铜的化学方程式
(4)现代高炉炼铁制得的是生铁,一包久置空气中的生铁粉末(成分碳、铁、氧化铁),为测定各成分的含量,小丽进行了以下实验探究。

①如上图,反应前小丽先通入氢气一段时间,再点燃 A 处酒精灯,继续通入足量氢气进行反应,实验结束后 A 中固体为
②测定样品中氧化铁的质量分数,需要测定的实验数据有
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】金属材料对人类的生产生活起着重要的作用。请回答下列有关问题:
(1)合金具有许多特殊的性能,合金的硬度一般比各成分的金属的硬度______ 。
(2)如图所示的实验,取一块废旧的铁丝网剪成几小片,用稀盐酸除去铁锈后的银白色的铁丝,放入锥形瓶中。向锥形瓶中加入3—4mL浓食盐水,塞紧带导管的单孔塞, 导管的另一端伸入滴有红墨水的水中。

①加入浓食盐水的作用是______ ;
②一段时间后,观察到的现象是a.银白色的铁丝生锈变黄色,b.______ ;产生b现象的原因是______ 。
③写出—条防止铁制品生锈的方法______ 。
(3)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3]。某化学兴趣小组欲通过实验探究“铜生锈是否需要空气中的水?”如图所示实验中(试管内的“ ”均为铜片),只需完成实验
”均为铜片),只需完成实验______ 即可达到探究目的。(填序号)。

(4)某化学兴趣小组用如图所示装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。

①木炭与氧化铜发生置换反应生成使澄清石灰水变浑浊的气体。该反应的化学方程式是______ 。
②木炭呈块状,实验时要先将木炭研细,再与CuO粉末混合均匀后使用。这样处理的目的是______ 。
③酒精灯火焰处加有铁丝网罩,其作用是______ 。
④用上图所示装置完成木炭还原氧化铜的实验,试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体进行探究。
【查阅资料】木炭与氧化铜反应可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与硫酸反应:
(5)由于试管中有空气,实验时应注意:
a.混合物需进行预热,除了使试管受热均匀外,目的是______ 。
b.不能把石灰水混浊作为木炭跟CuO反应的充分证据。因为试管中还可能发生反应:______ 。(写化学方程式)
(1)合金具有许多特殊的性能,合金的硬度一般比各成分的金属的硬度
(2)如图所示的实验,取一块废旧的铁丝网剪成几小片,用稀盐酸除去铁锈后的银白色的铁丝,放入锥形瓶中。向锥形瓶中加入3—4mL浓食盐水,塞紧带导管的单孔塞, 导管的另一端伸入滴有红墨水的水中。

①加入浓食盐水的作用是
②一段时间后,观察到的现象是a.银白色的铁丝生锈变黄色,b.
③写出—条防止铁制品生锈的方法
(3)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3]。某化学兴趣小组欲通过实验探究“铜生锈是否需要空气中的水?”如图所示实验中(试管内的“
 ”均为铜片),只需完成实验
”均为铜片),只需完成实验
(4)某化学兴趣小组用如图所示装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。

①木炭与氧化铜发生置换反应生成使澄清石灰水变浑浊的气体。该反应的化学方程式是
②木炭呈块状,实验时要先将木炭研细,再与CuO粉末混合均匀后使用。这样处理的目的是
③酒精灯火焰处加有铁丝网罩,其作用是
④用上图所示装置完成木炭还原氧化铜的实验,试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体进行探究。
【查阅资料】木炭与氧化铜反应可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与硫酸反应:

| 实验步骤 | 实验现象 | 实验结论 |
| a.取1.8g红色固体于试管中,滴加足量 | 固体部分溶解; | 所得固体是铜和氧化亚铜的混合物 |
| b.将①反应后的物质过滤将所得滤渣洗涤、干燥、称量 | 所得固体质量> |
(5)由于试管中有空气,实验时应注意:
a.混合物需进行预热,除了使试管受热均匀外,目的是
b.不能把石灰水混浊作为木炭跟CuO反应的充分证据。因为试管中还可能发生反应:
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】学校进行消防演练时,同学们学习并使用了某品牌的干粉灭火器。
(1)该干粉灭火器的主要成分有:碳酸氢钠(俗名______ )、硬脂酸镁、滑石粉。
(2)干粉灭火器的灭火原理是______ ,使用干粉灭火器灭火的正确操作顺序是______ 。
A 按下压把,对准火焰根部扫射
按下压把,对准火焰根部扫射
B 拔出保险销
拔出保险销
C 解脱喷管
解脱喷管
(3)同学们对灭火后残留的白色固体产生了兴趣,并进行了如下的探究:
【查阅资料】Ⅰ.硬脂酸镁、滑石粉不溶于水,碳酸氢钠可溶于水。
Ⅱ.碳酸氢钠受热易分解,生成碳酸钠、水、和二氧化碳。
Ⅲ NaHCO3与CaCl2不反应,CaCl2溶液呈中性, NaHCO3与 可以发生如下反应:
可以发生如下反应:
【实验探究】称取25g白色固体,加足量的水溶解、过滤得滤液100g。
①甲组同学取少量滤液于试管中,滴加足量的稀盐酸,产生大量气泡的原因是______ (用化学方程式表示,写一个即可)。
②乙组同学取40g滤液于烧杯中,加入足量CaCl2溶液后过滤、洗涤、干燥,得5g白色固体;再向反应后的滤液滴加酚酞试液,显红色,则碳酸氢钠的水溶液呈______ 性(选填“酸性”或“碱性”或“中性”)。原100g的滤液中一定含有______ 。
③丙组同学另取40g滤液,滴加足量的氢氧化钙溶液,充分反应后过滤、洗涤、干燥得10g固体。计算25g白色固体中NaHCO3的质量分数______ (写出计算过程)。
(1)该干粉灭火器的主要成分有:碳酸氢钠(俗名
(2)干粉灭火器的灭火原理是
A
 按下压把,对准火焰根部扫射
按下压把,对准火焰根部扫射B
 拔出保险销
拔出保险销C
 解脱喷管
解脱喷管(3)同学们对灭火后残留的白色固体产生了兴趣,并进行了如下的探究:
【查阅资料】Ⅰ.硬脂酸镁、滑石粉不溶于水,碳酸氢钠可溶于水。
Ⅱ.碳酸氢钠受热易分解,生成碳酸钠、水、和二氧化碳。
Ⅲ NaHCO3与CaCl2不反应,CaCl2溶液呈中性, NaHCO3与
 可以发生如下反应:
可以发生如下反应:
【实验探究】称取25g白色固体,加足量的水溶解、过滤得滤液100g。
①甲组同学取少量滤液于试管中,滴加足量的稀盐酸,产生大量气泡的原因是
②乙组同学取40g滤液于烧杯中,加入足量CaCl2溶液后过滤、洗涤、干燥,得5g白色固体;再向反应后的滤液滴加酚酞试液,显红色,则碳酸氢钠的水溶液呈
③丙组同学另取40g滤液,滴加足量的氢氧化钙溶液,充分反应后过滤、洗涤、干燥得10g固体。计算25g白色固体中NaHCO3的质量分数
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】食盐在生产、生活中用途广泛。
(1)《天工开物》中描述了我国古代制作海盐的场景:“凡煎盐锅,古谓之‘牢盆’,其下列灶燃薪,共煎此盘,火燃釜底,滚沸延及成盐。”
①煎盐用的“牢盆”主要材料一般是铁,原因是铁具有______________ 性。
②“滚沸延及成盐”描写的是氯化钠______________ 结晶的过程。
(2)若要配制 500 g 16%的食盐水用于农业生产中的选种,操作步骤如下图:

①计算得出需要的食盐质量为______________ g。
②图中步骤 4 为______________ 。
③装瓶时有食盐水溅出,剩余溶液的溶质质量分数______________ 16%(填“>”、“<”或“=”)。
(3)工业上电解饱和食盐水生产烧碱、氯气的方法叫“氯碱工业”,具体原理如下图:

①电解槽中发生反应的化学方程式是 ,请写出 X 的化学式
,请写出 X 的化学式 ______________ 。
②20℃时,电解 200 kg 溶质质量分数约为 23.4%食盐水,理论上可制得多少 kg 烧碱。(写出计算过程)___
③【提出问题】“氯碱工业”中生产的烧碱含有哪些杂质?
【猜想假设】猜想一:氯化钠; 猜想二:碳酸钠; 猜想三:氯化钠和碳酸钠
生产的烧碱中可能含有碳酸钠,作出此猜想的依据是______________ 。(用化学方程式表示)
【设计实验】
【反思评价】
上述实验中过量稀硝酸的作用是______________ 。
(1)《天工开物》中描述了我国古代制作海盐的场景:“凡煎盐锅,古谓之‘牢盆’,其下列灶燃薪,共煎此盘,火燃釜底,滚沸延及成盐。”
①煎盐用的“牢盆”主要材料一般是铁,原因是铁具有
②“滚沸延及成盐”描写的是氯化钠
(2)若要配制 500 g 16%的食盐水用于农业生产中的选种,操作步骤如下图:

①计算得出需要的食盐质量为
②图中步骤 4 为
③装瓶时有食盐水溅出,剩余溶液的溶质质量分数
(3)工业上电解饱和食盐水生产烧碱、氯气的方法叫“氯碱工业”,具体原理如下图:

①电解槽中发生反应的化学方程式是
 ,请写出 X 的化学式
,请写出 X 的化学式 ②20℃时,电解 200 kg 溶质质量分数约为 23.4%食盐水,理论上可制得多少 kg 烧碱。(写出计算过程)
③【提出问题】“氯碱工业”中生产的烧碱含有哪些杂质?
【猜想假设】猜想一:氯化钠; 猜想二:碳酸钠; 猜想三:氯化钠和碳酸钠
生产的烧碱中可能含有碳酸钠,作出此猜想的依据是
【设计实验】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量烧碱样品于试管中,加入过量的稀硝酸,再滴加少量的 | 猜想三正确 |
上述实验中过量稀硝酸的作用是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】 (1)实验室制取气体时需要的一些装置如图所示,请回答下列问题。

①实验室制取氧气和二氧化碳的发生装置都可选用B装置的原因是______ ,装置中使用分液漏斗的优点是______ 。
②若要得到干燥的氧气,所选择装置的连接顺序为B→______ →______ (填字母序号)。
③若要想检验二氧化碳气体中混有的氯化氢气体,可将F装置中的浓硫酸换成______ 。
(2)生石灰是化学反应中一种常见的干燥剂,也是一种传统的建筑材料。工业上通过在石灰窑中煅烧石灰石制得生石灰,其反应原理是: ,某化学兴趣小组的同学对刚出窑的生石灰的成分进行探究。
,某化学兴趣小组的同学对刚出窑的生石灰的成分进行探究。
【提出问题】
刚出窑的生石灰有哪些成分?
【猜想】
Ⅰ.只有氧化钙 Ⅱ.只有碳酸钙 Ⅲ.既有氧化钙也有碳酸钙
【实验探究】
(1)甲同学从样品中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生。甲同学据此认为试管中的固体只有氧化钙,即猜想1成立。乙同学认为甲的实验不足以证明猜想I成立,理由是______ 。
(2)乙同学认为利用感觉温度变化的方法判断是否有碳酸钙不可靠,他用水、酚酞试液和稀盐酸证明了猜想Ⅲ成立,请完成他的实验报告。
【思考】使用生石灰的建筑工地上常有一个大的石灰池,使用生石灰时,先将生石灰倒入池内水中,一段时间后,再取用其中的石灰浆使用。长期使用的石灰池内壁会逐渐增厚,其主要原因是______ 。(用化学方程式表示)

①实验室制取氧气和二氧化碳的发生装置都可选用B装置的原因是
②若要得到干燥的氧气,所选择装置的连接顺序为B→
③若要想检验二氧化碳气体中混有的氯化氢气体,可将F装置中的浓硫酸换成
(2)生石灰是化学反应中一种常见的干燥剂,也是一种传统的建筑材料。工业上通过在石灰窑中煅烧石灰石制得生石灰,其反应原理是:
 ,某化学兴趣小组的同学对刚出窑的生石灰的成分进行探究。
,某化学兴趣小组的同学对刚出窑的生石灰的成分进行探究。【提出问题】
刚出窑的生石灰有哪些成分?
【猜想】
Ⅰ.只有氧化钙 Ⅱ.只有碳酸钙 Ⅲ.既有氧化钙也有碳酸钙
【实验探究】
(1)甲同学从样品中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生。甲同学据此认为试管中的固体只有氧化钙,即猜想1成立。乙同学认为甲的实验不足以证明猜想I成立,理由是
(2)乙同学认为利用感觉温度变化的方法判断是否有碳酸钙不可靠,他用水、酚酞试液和稀盐酸证明了猜想Ⅲ成立,请完成他的实验报告。
| 实验步骤 | 实验现象 | 实验结论 |
| ① ② | 猜想III成立 |
您最近一年使用:0次



