我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料制得黄铜(铜和锌的合金,外观似黄金),其生产流程如图1:
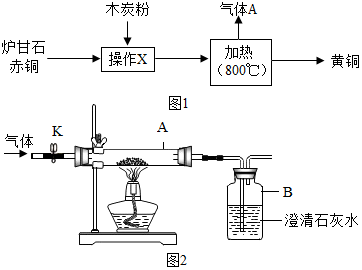
回答下列问题:
(1)赤铜中主要成分Cu2O的铜元素的化合价为_____
(2)加热时,发生的主要反应化学方程式为:①ZnCO3 ZnO+CO2↑;②2ZnO+C
ZnO+CO2↑;②2ZnO+C  2Zn+CO2↑;③
2Zn+CO2↑;③ _____ (赤铜和木炭粉反应)
(3)某兴趣小组同学对上述反应生成的气体A的成分进行研究.
【提出问题】生成的气体中是否含有一氧化碳?
兴趣小组同学利用图2所示的装置进行实验,对生成的气体成分进行探究.
【实验与讨论】
①打开K,缓缓通入干燥的氮气一段时间.
②关闭K,加热至一定温度使玻璃管中的炉甘石、赤铜和木炭粉反应,用气囊收集气体样品.
③欲除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列图3装置中最为合理的是_____ .
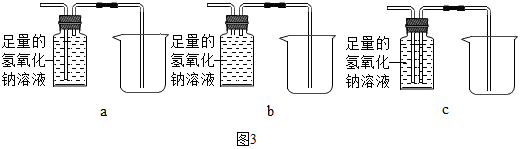
【实验求证】将除尽二氧化碳后的气体样品干燥,仍然用图2所示的装置进行实验,A中的固体应选用_____ ,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水 _____ ,其化学方程式为 _____ ,可说明气体样品中含有一氧化碳.
【实验反思】上述实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比_____ (填“大于”、“等于”或“小于”)3:8.
(4)另一兴趣小组同学对上述反应生成的固体成分进行了研究.
①甲同学说是铜、锌合金.乙同学说可能是金.
其他的同学否定了乙同学的猜测.其理由是_____ .
②为测定该黄铜(铜、锌合金)中铜的质量分数,某兴趣小组取20g黄铜样品放入盛有200g稀硫酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的总质量为219.8g,则:该黄铜样品中铜的质量分数为_____ .(计算结果保留0.1%)

③有的兴趣小组用图4装置测定黄铜中铜的质量分数.下列关于该实验的说法正确的是_____
A.分液漏斗与试管间的橡胶管仅有使液体顺利下滴的作用
B.若实验中稀硫酸不足,可以拔下分液漏斗上方的橡皮塞添加
C.该测定还需要的数据是样品质量和此温度、压强下氢气的密度
D.实验结束时,需冷却至室温并将量气管缓缓下移至两侧液面相平再读数
(5)拓展延伸
①某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图5所示,则:
a.溶液甲中一定含有Al(NO3)3和Zn(NO3)2
b.固体乙中一定含有Ag,可能含有Cu和Zn
c.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
d.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
上述四种说法正确的个数为_____
A.1个 B.2个 C.3个 D.4个
②利用废旧电池铜帽(含Cu、Zn)提取Cu,并得到ZnSO4溶液,主要流程如图6,(已知:①反应条件已略去;②2Cu+2H2SO4+O2 2CuSO4+2H2O).
2CuSO4+2H2O).

a.溶液A和固体C都含有_____ 两种元素,过程Ⅱ、Ⅲ中的分离操作是 _____ .
b.请写出步骤Ⅲ中发生反应的化学方程式:_____ .

回答下列问题:
(1)赤铜中主要成分Cu2O的铜元素的化合价为
(2)加热时,发生的主要反应化学方程式为:①ZnCO3
 ZnO+CO2↑;②2ZnO+C
ZnO+CO2↑;②2ZnO+C  2Zn+CO2↑;③
2Zn+CO2↑;③ (3)某兴趣小组同学对上述反应生成的气体A的成分进行研究.
【提出问题】生成的气体中是否含有一氧化碳?
兴趣小组同学利用图2所示的装置进行实验,对生成的气体成分进行探究.
【实验与讨论】
①打开K,缓缓通入干燥的氮气一段时间.
②关闭K,加热至一定温度使玻璃管中的炉甘石、赤铜和木炭粉反应,用气囊收集气体样品.
③欲除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列图3装置中最为合理的是

【实验求证】将除尽二氧化碳后的气体样品干燥,仍然用图2所示的装置进行实验,A中的固体应选用
【实验反思】上述实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比
(4)另一兴趣小组同学对上述反应生成的固体成分进行了研究.
①甲同学说是铜、锌合金.乙同学说可能是金.
其他的同学否定了乙同学的猜测.其理由是
②为测定该黄铜(铜、锌合金)中铜的质量分数,某兴趣小组取20g黄铜样品放入盛有200g稀硫酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的总质量为219.8g,则:该黄铜样品中铜的质量分数为

③有的兴趣小组用图4装置测定黄铜中铜的质量分数.下列关于该实验的说法正确的是
A.分液漏斗与试管间的橡胶管仅有使液体顺利下滴的作用
B.若实验中稀硫酸不足,可以拔下分液漏斗上方的橡皮塞添加
C.该测定还需要的数据是样品质量和此温度、压强下氢气的密度
D.实验结束时,需冷却至室温并将量气管缓缓下移至两侧液面相平再读数
(5)拓展延伸
①某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图5所示,则:
a.溶液甲中一定含有Al(NO3)3和Zn(NO3)2
b.固体乙中一定含有Ag,可能含有Cu和Zn
c.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
d.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
上述四种说法正确的个数为
A.1个 B.2个 C.3个 D.4个
②利用废旧电池铜帽(含Cu、Zn)提取Cu,并得到ZnSO4溶液,主要流程如图6,(已知:①反应条件已略去;②2Cu+2H2SO4+O2
 2CuSO4+2H2O).
2CuSO4+2H2O).
a.溶液A和固体C都含有
b.请写出步骤Ⅲ中发生反应的化学方程式:
更新时间:2019-05-08 13:13:35
|
相似题推荐
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐1】小开发现实验室有一瓶保管不善的铁粉,大部分已结块为红褐色,借此探究铁生锈相关问题。
【知识回顾】铁生锈的条件为铁与___________ (填化学式)接触。
【查阅资料】①铁锈成分复杂,化学式可简单表示为Fe2O3·xH2O。受热较易失去结晶水,
其反应可表示为 。
。
②浓硫酸能吸水。碱石灰是氢氧化钠和生石灰两种固体混合物,可以吸收水和二氧化碳。
(1)请写出生石灰吸收水的化学方程式___________ 。
【提出问题】铁锈(Fe2O3·xH2O)中x的值等于多少呢?
【问题探究】小开称取27.0g这种铁粉样品,按左图所示装置进行实验。

(2)实验结束时,应先熄灭装置___________ (填“A”或“D”)处的热源。
【数据处理】右图是A装置中固体质量随加热时间的变化图像。
(3)写出T3-T4发生反应的化学方程式___________ 。
(4)反应前后,C装置增重的质量为___________ g。
【得出结论】该铁粉样品中铁锈(Fe2O3·xH2O)中x的值为___________ 。
【知识回顾】铁生锈的条件为铁与
【查阅资料】①铁锈成分复杂,化学式可简单表示为Fe2O3·xH2O。受热较易失去结晶水,
其反应可表示为
 。
。②浓硫酸能吸水。碱石灰是氢氧化钠和生石灰两种固体混合物,可以吸收水和二氧化碳。
(1)请写出生石灰吸收水的化学方程式
【提出问题】铁锈(Fe2O3·xH2O)中x的值等于多少呢?
【问题探究】小开称取27.0g这种铁粉样品,按左图所示装置进行实验。

(2)实验结束时,应先熄灭装置
【数据处理】右图是A装置中固体质量随加热时间的变化图像。
(3)写出T3-T4发生反应的化学方程式
(4)反应前后,C装置增重的质量为
【得出结论】该铁粉样品中铁锈(Fe2O3·xH2O)中x的值为
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】某研究小组探究一定条件下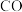 热还原
热还原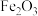 所得到的一种黑色粉末的成分(只含一种成分)。试回答下列问题:
所得到的一种黑色粉末的成分(只含一种成分)。试回答下列问题:
【提出问题】黑色固体成分是什么呢?
【查阅资料】①铁的氧化物中,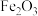 为砖红色,
为砖红色, 、
、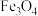 均为黑色;
均为黑色;
②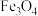 中铁元素的化合价既有
中铁元素的化合价既有 价,也有
价,也有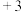 价,它的组成可写成
价,它的组成可写成 ;
;
③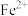 遇到K3(CN)6溶液生成蓝色沉淀。
遇到K3(CN)6溶液生成蓝色沉淀。
【猜想与假设】
猜想一:黑色粉末的成分可能是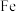 ;
;
猜想二:黑色粉末的成分可能是 ;
;
猜想三:黑色粉末的成分可能是________ 。
假设“猜想一”正确,请写出发生的化学反应方程式________ 。
证明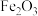 已被还原的现象是
已被还原的现象是________ 。
【实验设计】研究小组设计并完成实验如下:
【讨论交流】实验结束后,老师和同学们一起交流。老师告诉同学们,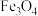 俗称磁性氧化铁,是一种具有磁性的铁的氧化物,溶于盐酸可以生成两种盐,写出反应的化学方程式
俗称磁性氧化铁,是一种具有磁性的铁的氧化物,溶于盐酸可以生成两种盐,写出反应的化学方程式________ 。
【探究启示】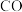 属于可燃性气体、有毒,在加热还原
属于可燃性气体、有毒,在加热还原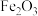 前,需要进行
前,需要进行________ 。实验结束后需要进行________ 。
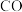 热还原
热还原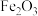 所得到的一种黑色粉末的成分(只含一种成分)。试回答下列问题:
所得到的一种黑色粉末的成分(只含一种成分)。试回答下列问题:【提出问题】黑色固体成分是什么呢?
【查阅资料】①铁的氧化物中,
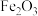 为砖红色,
为砖红色, 、
、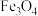 均为黑色;
均为黑色;②
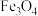 中铁元素的化合价既有
中铁元素的化合价既有 价,也有
价,也有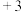 价,它的组成可写成
价,它的组成可写成 ;
;③
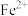 遇到K3(CN)6溶液生成蓝色沉淀。
遇到K3(CN)6溶液生成蓝色沉淀。【猜想与假设】
猜想一:黑色粉末的成分可能是
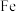 ;
;猜想二:黑色粉末的成分可能是
 ;
;猜想三:黑色粉末的成分可能是
假设“猜想一”正确,请写出发生的化学反应方程式
证明
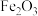 已被还原的现象是
已被还原的现象是【实验设计】研究小组设计并完成实验如下:
| 步骤 | 操作 | 现象 |
| ① | 取一定量的黑色粉末于试管中,加入足量的盐酸 | 固体完全溶解,无气泡 |
| ② | 取步骤①中所得溶液少量于试管,滴加K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ③ |
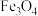 俗称磁性氧化铁,是一种具有磁性的铁的氧化物,溶于盐酸可以生成两种盐,写出反应的化学方程式
俗称磁性氧化铁,是一种具有磁性的铁的氧化物,溶于盐酸可以生成两种盐,写出反应的化学方程式【探究启示】
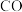 属于可燃性气体、有毒,在加热还原
属于可燃性气体、有毒,在加热还原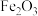 前,需要进行
前,需要进行
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】某学习小组欲从高锰酸钾制氧气剩余物中回收副产物,设计了如图所示实验方案:
【资料卡片】
①KMnO4能和纤维素反应,在中性溶液中比较稳定,加热碱性条件中的KMnO4溶液会有部分KMnO4和H2O反应,生成MnO2;
②锰酸钾溶于水为墨绿色,不稳定,在水溶液中能全部转化为KMnO4、MnO2和KOH,反应的化学方程式如下: 。
。
【实验方案】

(1)将剩余物加入水中,观察到的现象是:①部分固体溶解;②有少量不溶物出现;③__________ 。
(2)回收物甲是___________ (填化学式)。
(3)静置后过滤时,发现滤液浑浊,在操作均正确的情况下(过滤前滤纸完好无损),原因是___ 。
(4)滤液B中一定含有的溶质是KMnO4和_______ ,需要加入少量硫酸进行中和,中和反应的化学方程式是_________________ 。
(5)冷却结晶后,低温烘干高锰酸钾晶体是为了防止__________ 。
(6)加热31.6gKMnO4使之完全分解,按以上实验方案可得回收物甲的质量可能是___ 。
A. 8.7g B. 11.5g C. 12.8g D. 28.4g
【资料卡片】
①KMnO4能和纤维素反应,在中性溶液中比较稳定,加热碱性条件中的KMnO4溶液会有部分KMnO4和H2O反应,生成MnO2;
②锰酸钾溶于水为墨绿色,不稳定,在水溶液中能全部转化为KMnO4、MnO2和KOH,反应的化学方程式如下:
 。
。【实验方案】

(1)将剩余物加入水中,观察到的现象是:①部分固体溶解;②有少量不溶物出现;③
(2)回收物甲是
(3)静置后过滤时,发现滤液浑浊,在操作均正确的情况下(过滤前滤纸完好无损),原因是
(4)滤液B中一定含有的溶质是KMnO4和
(5)冷却结晶后,低温烘干高锰酸钾晶体是为了防止
(6)加热31.6gKMnO4使之完全分解,按以上实验方案可得回收物甲的质量可能是
A. 8.7g B. 11.5g C. 12.8g D. 28.4g
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐1】含铁3%-5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原料。现有一块铝镁合金,欲测定其中镁的质量分数,几位同学查阅资料如下:
a.铝镁合金中含铝、镁,其余微量元素质量忽略不计,且不与后续实验中的物质反应。
b.浓硫酸是粘稠的液体,有强烈的腐蚀性。
(1)某实验小组拟选用下列实验装置中的某些装置完成实验:
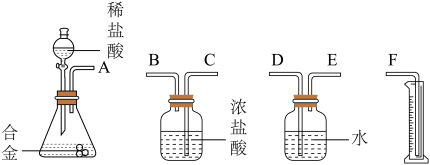
从安全性考虑,装置导管口的连接顺序是A→___ →___ →F(填序号);请写出合金中铝与稀硫酸反应的化学方程式___ 。
(2)为确定酸的浓度、合金的形状对合金与酸反应快慢的影响,同学们分别取等量的稀硫酸、等质量的合金进行了如下实验:
可通过对比实验______ 和_______ (填实验编号,合理即可),得到结论:粉碎后合金反应速率更快。利用上述装置,该实验要比较产生氢气的快慢,可以测量产生相同体积氢气所需的时间,也可以测量______ 。
(3)仔细分析讨论后,同学们认为原装置有所不足,其中会导致所测氢气体积偏小的是___(填序号)。
(4)同学们设计了如图所示的实验装置。取51g该铝镁合金,最终测得的氢气体积,经过后续测算,得到氢气的质量为5.6g,则该铝镁合金___ (填“适用”或“不适用”)于轮船制造、化工生产、机械制造等行业。

a.铝镁合金中含铝、镁,其余微量元素质量忽略不计,且不与后续实验中的物质反应。
b.浓硫酸是粘稠的液体,有强烈的腐蚀性。
(1)某实验小组拟选用下列实验装置中的某些装置完成实验:

从安全性考虑,装置导管口的连接顺序是A→
(2)为确定酸的浓度、合金的形状对合金与酸反应快慢的影响,同学们分别取等量的稀硫酸、等质量的合金进行了如下实验:
| 实验编号 | 稀硫酸的浓度 | 合金形状 | 收集50mL氢气所需时间/s |
| ① | 10% | 粉碎 | 60 |
| ② | 10% | 不粉碎 | 102 |
| ③ | 20% | 粉碎 | 36 |
| ④ | 20% | 不粉碎 | 90 |
(3)仔细分析讨论后,同学们认为原装置有所不足,其中会导致所测氢气体积偏小的是___(填序号)。
| A.稀硫酸中水被带出 |
| B.实验结束时,连接集气瓶和量筒的导管中有少量水存在 |
| C.稀硫酸滴入锥形瓶中,即使不产生氢气,也会将瓶内空气排出 |
| D.导管占用量筒中液体体积 |

您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】小明在冬天输液时发现输液管上加了如图装置,护士告诉他这是一次性输液加热棒,可消除药液温度与体温的差异。小明发现该品牌加热棒里的成分是活性炭粉、氯化钠、还原性铁粉及少量的Fe3O4。现对有关物质的性质及成分进行探究。
【查阅资料】
①铁粉、Fe3O4都能被磁铁吸引,均呈黑色,都能与酸溶液反应。
②碱石灰是氢氧化钠和氧化钙的混合物。
实验一:测定加热棒内氯化钠的含量
(1)方法1:取10g样品于烧杯中,加入足量的水充分溶解、过滤、洗涤、干燥,测得固体质量为8g,则氯化钠的质量分数是________ 。
(2)方法2:取方法1中的滤液和洗涤液,加过量AgNO3溶液,发生反应的化学方程式为________ 。判断所加AgNO3溶液已经过量的方法________ 。将过滤后的沉淀直接干操、称量,则实验结果将______ (填“偏小”、“偏大”或“无影响”)。
实验二:测定加热棒内铁粉的含量。
(3)取一定质量的样品,________ (填操作及现象),通过测定产生气体的质量计算铁的含量。
实验三:测定加热棒内四氧化三铁的含量。
(4)另取10g样品,用磁铁充分吸引样品,得黑色粉末。取黑色粉末进行下列实验。

①实验开始时,进行的实验操作为________ 。
A先加热,后通入一氧化碳 B.先通入一氧化碳,后加热
②设计C装置的目的是_________ 。
③该装置的不足之处__________ 。
实验四:测定加热棒内活性炭粉的含量
(5)另取10g样品,加入足量的稀硫酸,经过滤、洗涤、干燥,得到黑色固体,该黑色固体是________ ,通过黑色固体质量计算活性炭粉的含量。
【查阅资料】
①铁粉、Fe3O4都能被磁铁吸引,均呈黑色,都能与酸溶液反应。
②碱石灰是氢氧化钠和氧化钙的混合物。
实验一:测定加热棒内氯化钠的含量
(1)方法1:取10g样品于烧杯中,加入足量的水充分溶解、过滤、洗涤、干燥,测得固体质量为8g,则氯化钠的质量分数是
(2)方法2:取方法1中的滤液和洗涤液,加过量AgNO3溶液,发生反应的化学方程式为
实验二:测定加热棒内铁粉的含量。
(3)取一定质量的样品,
实验三:测定加热棒内四氧化三铁的含量。
(4)另取10g样品,用磁铁充分吸引样品,得黑色粉末。取黑色粉末进行下列实验。

①实验开始时,进行的实验操作为
A先加热,后通入一氧化碳 B.先通入一氧化碳,后加热
②设计C装置的目的是
③该装置的不足之处
实验四:测定加热棒内活性炭粉的含量
(5)另取10g样品,加入足量的稀硫酸,经过滤、洗涤、干燥,得到黑色固体,该黑色固体是
您最近一年使用:0次
【推荐3】社会发展离不开金属,生产生活中铁、铝及其合金制品随处可见,了解不同金属的化学性质有利于人们合理地使用并改造金属。
铝制易拉罐:某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。

(1)制备铝及其它金属
工业上常用电解氧化铝的方法制备金属铝,反应的化学方程式为_______ 。分别写出还原法、湿法冶炼其他金属的方程式_______ 。
(2)铝合金中的铟(In)
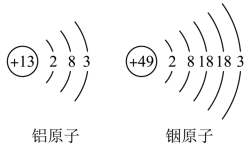
如图为铝、铟的原子结构示意图。某同学推测金属铟与铝的化学性质相似,理由是_______ 。实验证明,铟可以与稀盐酸反应,其反应的化学方程式_______ 。
探究金属R:
现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(3)取少最的金属粉末于试管中,逐滴滴加稀硫酸,有气泡产生,待不再产生气泡时,再进行_______ (填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是_______ 。
(4)金属R与稀硫酸反应的化学方程式为_______ ,该反应质于基本反应类型中的_______ 反应。描述该反应的微观过程_______ 。
(5)下图是铝片与硫酸铜溶液反应的微观示意图:

通过以上分析可以知道,不同金属的化学性质不同的原因是_______ 。
探究金属镁、铝、锌的活动性强弱
(6)请利用金属能与酸反应的性质,自选仪器和药品,探究金属镁、铝、锌的活动性强弱,完成下列实验报告:
请以反应时间为横坐标,生成氢气质量为纵坐标,画出等质量的镁、铝、锌三种金属与足量的等质量等质量分数的稀盐酸反应的图像_______ 。
探究蒸汽眼罩
(7)蒸汽眼罩逐渐走进日常生活,它借助铁生锈产生热量,使材料内部的水分稳定蒸发,利用产生的热度和湿度缓解眼部疲劳。
【实验探究】
①探究一:蒸汽眼罩快速发热的原因
铁生锈,是铁与_______ 共同作用的结果,但放热缓慢。哪些因素能加快反应,使蒸汽眼罩快速发热?某小组同学采用对照实验展开探究,设计实验方案如下:
(查阅资料:蒸汽眼罩内部材料有铁粉、活性炭、氯化钠、水等。)
下列方案之间能否形成对照?若能,请指出变量;若不能,请说明理由。
方案二与方案四_______ ;
方案一与方案四_______ 。
使用温度传感器收集数据并生成图像如图:


对比分析图像,你获得的结论是_______ 。
②探究二:测量蒸汽眼罩内部材料中铁的质量分数
温馨提示:a.实验仪器和药品自选。b.实验中的数据可分别用m1、m2、m3等来表示。
你的实验方案_______ 。
数据,计算蒸汽眼罩内部材料中铁的质量分数_______ 。
【反思评价】结合上述探究谈谈你对铁生锈的辩证认识_______ 。
铝制易拉罐:某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。

(1)制备铝及其它金属
工业上常用电解氧化铝的方法制备金属铝,反应的化学方程式为
(2)铝合金中的铟(In)

如图为铝、铟的原子结构示意图。某同学推测金属铟与铝的化学性质相似,理由是
探究金属R:
现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(3)取少最的金属粉末于试管中,逐滴滴加稀硫酸,有气泡产生,待不再产生气泡时,再进行
(4)金属R与稀硫酸反应的化学方程式为
(5)下图是铝片与硫酸铜溶液反应的微观示意图:

通过以上分析可以知道,不同金属的化学性质不同的原因是
探究金属镁、铝、锌的活动性强弱
(6)请利用金属能与酸反应的性质,自选仪器和药品,探究金属镁、铝、锌的活动性强弱,完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
探究蒸汽眼罩
(7)蒸汽眼罩逐渐走进日常生活,它借助铁生锈产生热量,使材料内部的水分稳定蒸发,利用产生的热度和湿度缓解眼部疲劳。
【实验探究】
①探究一:蒸汽眼罩快速发热的原因
铁生锈,是铁与
(查阅资料:蒸汽眼罩内部材料有铁粉、活性炭、氯化钠、水等。)
| 药品 | |
| 方案一 | 4g铁粉、2mL水 |
| 方案二 | 4g铁粉、2mL水、2g氯化钠 |
| 方案三 | 4g铁粉、2mL水、2g活性炭 |
| 方案四 | 4g铁粉、2mL水、2g活性炭、2g氯化钠 |
方案二与方案四
方案一与方案四
使用温度传感器收集数据并生成图像如图:


对比分析图像,你获得的结论是
②探究二:测量蒸汽眼罩内部材料中铁的质量分数
温馨提示:a.实验仪器和药品自选。b.实验中的数据可分别用m1、m2、m3等来表示。
你的实验方案
数据,计算蒸汽眼罩内部材料中铁的质量分数
【反思评价】结合上述探究谈谈你对铁生锈的辩证认识
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐1】化学学习小组进行“金属和酸溶液反应的探究”的活动。
(1)用等量镁片、铝片分别与浓度相同的稀盐酸反应,实验过程如下:
由实验①判断实验室制取氢气不采用镁的原因是______ ,下图能正确表示镁、铝和盐酸反应生成氢气的质量与时间的关系是______

(2)为了真实地观察未打磨的铝片与稀盐酸反应的情况,小红用压强传感器测量集气瓶中气体压强的变化,如图所示。

请解释曲线变化的原因:
OA段______ ;AB段______ ; BC段______ 。
指出反应结束并恢复到常温时集气瓶内的压强值约为______ kPa。
(1)用等量镁片、铝片分别与浓度相同的稀盐酸反应,实验过程如下:
| 实验 | 操 作 | 现象 | 收集200mL氢气所需时间/S |
| ① | 7.3% HCl 溶液 5 mL+镁片 | 迅速产生大量气泡 | 7 |
| ② | 7.3% HCl溶液5mL+铝片 | 开始无明显现象。 过一会儿有较多气袍 | 450 |

(2)为了真实地观察未打磨的铝片与稀盐酸反应的情况,小红用压强传感器测量集气瓶中气体压强的变化,如图所示。

请解释曲线变化的原因:
OA段
指出反应结束并恢复到常温时集气瓶内的压强值约为
您最近一年使用:0次
科学探究题
|
较难
(0.4)
真题
【推荐2】中和反应在日常生活和工农业生产中有广泛的应用。某小组在实验室探究氢氧化钠和盐酸的反应。
(1)向盛有5mL氢氧化钠溶液的烧杯中滴加几滴酚酞溶液,可观察到_______ 的现象。再向其中滴入稀盐酸,溶液变无色。
学生对于所加盐酸是否过量提出了疑问,于是对反应后溶液中溶质的成分作出猜想:猜想一:NaCl 猜想二:NaCl、HCl
(2)为了验证其猜想,同学们进行如下探究。
(3)向氢氧化钠溶液中滴加稀盐酸时,有同学触摸到试管外壁,感觉有温度变化。小组利用数字传感器得出反应时间与溶液温度变化的关系,如图所示。_______ 。
(4)查阅资料得知,在中和反应中溶液的导电性也发生变化。已知电导率是衡量溶液导电能力大小的物理量。在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比。_______ N点(填“>”“<”或“=”)。
②M点表示_______ 。
交流与反思:
a.中和反应发生的实质是_______ 。
b.中和反应可以从热量、酸碱性、产物、导电性等方面进行探究。
(1)向盛有5mL氢氧化钠溶液的烧杯中滴加几滴酚酞溶液,可观察到
学生对于所加盐酸是否过量提出了疑问,于是对反应后溶液中溶质的成分作出猜想:猜想一:NaCl 猜想二:NaCl、HCl
(2)为了验证其猜想,同学们进行如下探究。
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的溶液,加入镁条 | 猜想二正确证明盐酸过量 |
(3)向氢氧化钠溶液中滴加稀盐酸时,有同学触摸到试管外壁,感觉有温度变化。小组利用数字传感器得出反应时间与溶液温度变化的关系,如图所示。

(4)查阅资料得知,在中和反应中溶液的导电性也发生变化。已知电导率是衡量溶液导电能力大小的物理量。在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比。

②M点表示
交流与反思:
a.中和反应发生的实质是
b.中和反应可以从热量、酸碱性、产物、导电性等方面进行探究。
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐3】控制变量法是科学探究中常用的方法。化学反应的快慢常与外界条件有关,如温度、压强、催化剂、固体表面积等因素。以下实验设计的目的是探究化学反应快慢与外界条件的关系。
Ⅰ.现有四份等质量的铁分别与足量的盐酸进行反应,图1为随着反应时间的变化产生气体体积V的关系曲线。四组实验条件分别是:
a.50℃、铁粉 b.30℃、铁粉 c.30℃、铁丝 d.20℃、铁丝
(1)请写出铁与盐酸反应的化学方程式:_____ ,该反应进行时会放出热量。
(2)通过实验a和b对比,得出的结论是_____ ;若要比较金属铁的表面积对反应快慢的影响,应选择的实验组别是 _____ 。实验中观察到产生气体“逐渐变快又变慢”,请解释“逐渐变快”的原因是 _____ 。
Ⅱ.(3)常温时,用足量的铁、锌、镁三种金属片分别与等量盐酸反应,图2中,甲图为实验发生装置,乙图为测得的产生氢气的量(图中压强越大,表示产生氢气的量越多)。
①该实验中,你认为还需要控制的变量是_____ ;
②根据乙图,得出反应物的量与生成H2体积的关系是_____ 。
(4)若足量的镁片与盐酸反应,测得产生H2的实际值比理论值偏大,请分析可能的原因(写出一条即可):
_____ 。


Ⅰ.现有四份等质量的铁分别与足量的盐酸进行反应,图1为随着反应时间的变化产生气体体积V的关系曲线。四组实验条件分别是:
a.50℃、铁粉 b.30℃、铁粉 c.30℃、铁丝 d.20℃、铁丝
(1)请写出铁与盐酸反应的化学方程式:
(2)通过实验a和b对比,得出的结论是
Ⅱ.(3)常温时,用足量的铁、锌、镁三种金属片分别与等量盐酸反应,图2中,甲图为实验发生装置,乙图为测得的产生氢气的量(图中压强越大,表示产生氢气的量越多)。
①该实验中,你认为还需要控制的变量是
②根据乙图,得出反应物的量与生成H2体积的关系是
(4)若足量的镁片与盐酸反应,测得产生H2的实际值比理论值偏大,请分析可能的原因(写出一条即可):


您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】化学兴趣小组在实验室用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳;并验证它的某些化学性质。
【查阅资料】
1 实验室制取的一氧化碳气体中混有水和二氧化碳。
2 生石灰(氧化钙)能吸收水,氢氧化钠溶液(NaOH)可吸收二氧化碳。
3 澄清石灰水能与稀盐酸反应,生成可溶的氯化钙和水。
【进行实验】
步骤一:如图,将甲酸与浓硫酸共热,由A装置制备一氧化碳,并在B装置中获得干燥、纯净的一氧化碳。
步骤二:将所得一氧化碳通入后续装置进行反应。
结合实验装置,回答问题。



(1)图中B处的装置为图1中甲和乙,为制备干燥、纯净的一氧化碳,甲、乙的连接顺序为____ (选填“先甲后乙或先乙后甲”);
(2)进行一氧化碳与氧化铁实验时,应先通一段时间一氧化碳再点酒精喷灯,目的是_____ ;图中C处一氧化碳体现_____ 性;反应方程式为______ 。
(3)C处反应结束后,固体质量从18g减少到15.6g,则参加反应的氧化铁质量是______ 。
(4)反应结束后,将试管D中物质全部倒入F装置中,并慢慢加入稀盐酸,用气压传感器测得圆底烧瓶中压强变化如图2,70s后压强变大的原因是______ 。
【查阅资料】
1 实验室制取的一氧化碳气体中混有水和二氧化碳。
2 生石灰(氧化钙)能吸收水,氢氧化钠溶液(NaOH)可吸收二氧化碳。
3 澄清石灰水能与稀盐酸反应,生成可溶的氯化钙和水。
【进行实验】
步骤一:如图,将甲酸与浓硫酸共热,由A装置制备一氧化碳,并在B装置中获得干燥、纯净的一氧化碳。
步骤二:将所得一氧化碳通入后续装置进行反应。
结合实验装置,回答问题。



(1)图中B处的装置为图1中甲和乙,为制备干燥、纯净的一氧化碳,甲、乙的连接顺序为
(2)进行一氧化碳与氧化铁实验时,应先通一段时间一氧化碳再点酒精喷灯,目的是
(3)C处反应结束后,固体质量从18g减少到15.6g,则参加反应的氧化铁质量是
(4)反应结束后,将试管D中物质全部倒入F装置中,并慢慢加入稀盐酸,用气压传感器测得圆底烧瓶中压强变化如图2,70s后压强变大的原因是
您最近一年使用:0次
【推荐2】为了测定某样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不溶于水和酸),某兴趣小组的同学进行了如下的实验,请你参与过程分析。

【查阅资料】
1 草酸(H2C2O4)在浓硫酸作用下受热分解,化学方程式为H2C2O4 CO2↑+CO↑+H2O;
CO2↑+CO↑+H2O;
2 碱石灰主要成分为生石灰与氢氧化钠固体。
【实验设计及操作】用如图所示装置进行实验。
【问题讨论】(1)在装置E的实验中,为提升实验的温度,在仪器不变的情况下可作的改进是______ ;观察到 中现象是
中现象是______ ;
(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是______ (填序号);
①浓硫酸、石灰水、氢氧化钠溶液
②石灰水、氢氧化钠溶液、浓硫酸
③氢氧化钠溶液、石灰水、浓硫酸
(3)装置G的作用是___________ ;
(4)实验装置有一明显缺陷是____________ ;
【数据处理】称取样品10g,用上述装置进行实验,充分反应后称量 装置增重6.6g,则样品中氧化铁质量分数为
装置增重6.6g,则样品中氧化铁质量分数为______ 。
【实验反思】当观察到 中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数
中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数______ (填“偏大”、“偏小”或“无影响”)。

【查阅资料】
1 草酸(H2C2O4)在浓硫酸作用下受热分解,化学方程式为H2C2O4
 CO2↑+CO↑+H2O;
CO2↑+CO↑+H2O;2 碱石灰主要成分为生石灰与氢氧化钠固体。
【实验设计及操作】用如图所示装置进行实验。
【问题讨论】(1)在装置E的实验中,为提升实验的温度,在仪器不变的情况下可作的改进是
 中现象是
中现象是(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是
①浓硫酸、石灰水、氢氧化钠溶液
②石灰水、氢氧化钠溶液、浓硫酸
③氢氧化钠溶液、石灰水、浓硫酸
(3)装置G的作用是
(4)实验装置有一明显缺陷是
【数据处理】称取样品10g,用上述装置进行实验,充分反应后称量
 装置增重6.6g,则样品中氧化铁质量分数为
装置增重6.6g,则样品中氧化铁质量分数为【实验反思】当观察到
 中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数
中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐3】铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为 _____________________________________ 。某化学兴趣小组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为____________________ 。
为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【查阅资料】氢氧化钠溶液和澄清石灰水化学性质类似,能与二氧化碳反应,但反应无明显现象。
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中。
②装置A和B两组实验同时开始进行。在装置B的反应中,实验开始前应先________ (选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是 ____________________________________________ 。
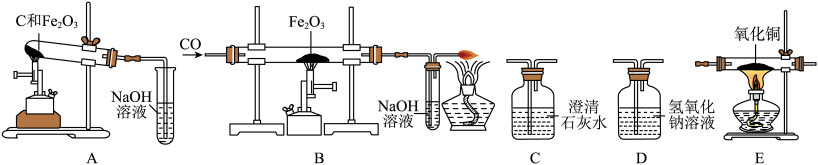
【实验现象】当装置B的玻璃管中固体完全由________________ 时(选填“红色变为黑色”或“黑色变为红色”),装置A的试管中仍有 ________________________ 。
【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个:____________ 。
【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是__________________ (选填字母,装置可重复使用)。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2,因此装置A的不足之处是 ______________________________________ 。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为
为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【查阅资料】氢氧化钠溶液和澄清石灰水化学性质类似,能与二氧化碳反应,但反应无明显现象。
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中。
②装置A和B两组实验同时开始进行。在装置B的反应中,实验开始前应先

【实验现象】当装置B的玻璃管中固体完全由
【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个:
【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是
您最近一年使用:0次



