过氧化镁(MgO2)是一种重要的化工原料,可用来处理被地下水污染的土壤,还可以用于配制牙膏,对牙齿有漂白和防过敏的作用。
(一)过氧化镁的性质
(1)过氧化镁是一种白色粉末。化学性质不够稳定,加热时会分解生成氧气和氧化镁;也不溶于水,但在水中会逐渐分解放出氧气。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl==MgCl2+H2O2,同时放出大量的热。
(二)过氧化镁的制备
(1)煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为_____ 。检测煅烧过程碱式碳酸镁完全分解的方法是 _____ (写出具体的操作和现象)。
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O
(3)分离:得到产品。
(4)测定:在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑)。
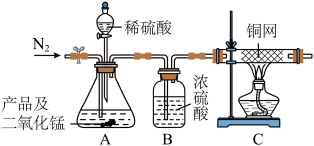
以下是某小组进行过氧化镁样品纯度检测的实验装置和实验步骤。
已知:a.MnO2与稀盐酸不反应
b.MgO+C Mg+CO↑
Mg+CO↑
实验前称取产品及二氧化锰共12g,先缓慢通入N2一段时间,加热铜网至红热后,再缓慢滴入过量稀盐酸,直至A中样品完全反应,继续缓慢通N2一段时间后停止加热。对锥形瓶中的剩余物过滤,洗涤,干燥,得到滤渣2g。
①样品完全反应后继续缓慢通N2的目的是_____ ;
②装置B的作用_____ (填字母代号)
a.除去气体中水蒸气 b.便于观察和控制气流速度
③实验测得C装置中铜网增重1.6g,该产品中过氧化镁的含量为_____ %(计算结果精确:到0.1%)
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是_____ (填序号)。
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
(一)过氧化镁的性质
(1)过氧化镁是一种白色粉末。化学性质不够稳定,加热时会分解生成氧气和氧化镁;也不溶于水,但在水中会逐渐分解放出氧气。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl==MgCl2+H2O2,同时放出大量的热。
(二)过氧化镁的制备
(1)煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O

(3)分离:得到产品。
(4)测定:在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑)。
以下是某小组进行过氧化镁样品纯度检测的实验装置和实验步骤。
已知:a.MnO2与稀盐酸不反应
b.MgO+C
 Mg+CO↑
Mg+CO↑实验前称取产品及二氧化锰共12g,先缓慢通入N2一段时间,加热铜网至红热后,再缓慢滴入过量稀盐酸,直至A中样品完全反应,继续缓慢通N2一段时间后停止加热。对锥形瓶中的剩余物过滤,洗涤,干燥,得到滤渣2g。
①样品完全反应后继续缓慢通N2的目的是
②装置B的作用
a.除去气体中水蒸气 b.便于观察和控制气流速度
③实验测得C装置中铜网增重1.6g,该产品中过氧化镁的含量为
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
更新时间:2019-05-13 11:07:01
|
相似题推荐
综合应用题
|
较难
(0.4)
【推荐1】煤中硫的存在形态分为有机硫和无机硫(如CaSO4等),煤中全硫含量的测定和脱硫是缓解燃煤污染的重要环节。
(1)直接燃烧含硫煤可能导致的环境问题是_______ (填“酸雨”、“白色污染”或“水体富营养化”)。
任务一:测定全硫含量( )
)
用高温燃烧中和法测定全硫含量的流程如图1所示:
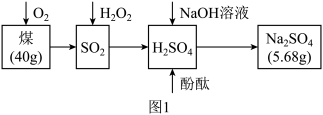
(2)图1流程中,发生的中和反应是_______ (用化学方程式表示),当观察到_______ 现象时,说明硫酸已被完全反应。
(3)氧气流速与测定出的全硫含量关系如图2,最适宜的氧气流速为_______ 升/分钟,氧气流速过快(或过慢)会使测出的全硫含量偏低,其原因是_______ (写一种)。
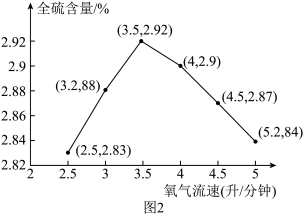
(4)根据图1中的实验数据,计算煤中全硫含量为_______ (假设硫已完全转化)。
任务二:煤的脱硫
(5)微波辅助柠檬酸强化脱硫是新型“减污染洁净煤”技术,为研究温度和柠檬酸浓度对煤炭脱硫率的影响,研究小组进行如下实验:
若实验1、2和实验2、3分别形成对比实验,则x、y的数值分别为________ 、_______ 。
(6)从燃烧条件的角度,提出一条高效使用脱硫煤的方法:_______ 。
(1)直接燃烧含硫煤可能导致的环境问题是
任务一:测定全硫含量(
 )
)用高温燃烧中和法测定全硫含量的流程如图1所示:

(2)图1流程中,发生的中和反应是
(3)氧气流速与测定出的全硫含量关系如图2,最适宜的氧气流速为

(4)根据图1中的实验数据,计算煤中全硫含量为
任务二:煤的脱硫
(5)微波辅助柠檬酸强化脱硫是新型“减污染洁净煤”技术,为研究温度和柠檬酸浓度对煤炭脱硫率的影响,研究小组进行如下实验:
| 温度/℃ | 柠檬酸的溶质质量分数% | 煤炭脱硫率/% | |
| 实验1 | 60 | x | 17.59 |
| 实验2 | 80 | 4 | 20.59 |
| 实验3 | y | 10 | 18.54 |
(6)从燃烧条件的角度,提出一条高效使用脱硫煤的方法:
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】以FeSO4溶液为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:
(1)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有______ (填字母)。
A.能与酸反应 B.能与碱反应 C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是______ 。
(2)“过滤”后需对固体进行洗涤与干燥,检验固体有无洗涤干净时,可向最后一次洗涤之后得到的溶液中滴加______ (写化学式)溶液,若观察到没有白色沉淀产生,表明已洗净。
(3)“煅烧”时生成Fe2O3的反应化学方程式为______ 。
(4)已知FeO(OH)在650℃时开始分解,约800℃时分解完毕,温度再升高,又会有氧气生成,这样对氧化铁的质量分数会有影响,下图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。某次实验中所得产品中Fe2O3质量分数较低,其原因是______ 。

(5)用该方法制备Fe2O3,计算理论上152t溶质质量分数为10%的FeSO4溶液可制得Fe2O3的最大质量(写出计算过程)。

已知“沉淀”时的主要反应为:

(1)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有
A.能与酸反应 B.能与碱反应 C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是
(2)“过滤”后需对固体进行洗涤与干燥,检验固体有无洗涤干净时,可向最后一次洗涤之后得到的溶液中滴加
(3)“煅烧”时生成Fe2O3的反应化学方程式为
(4)已知FeO(OH)在650℃时开始分解,约800℃时分解完毕,温度再升高,又会有氧气生成,这样对氧化铁的质量分数会有影响,下图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。某次实验中所得产品中Fe2O3质量分数较低,其原因是

(5)用该方法制备Fe2O3,计算理论上152t溶质质量分数为10%的FeSO4溶液可制得Fe2O3的最大质量(写出计算过程)。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】生活中铜制品长期露置在潮湿空气中会锈蚀生成碱式碳酸铜【Cu2(OH)2CO3】。某研究性学习小组为探究某锈蚀铜样品中单质铜的质量分数,并回收铜。
【查阅资料】①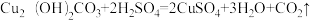
(2)
【实验设计】取锈蚀铜样品(假设除铜和碱式碳酸铜外,不含其它物质)均分为两等份,设计甲、乙两方案。

(1)方案甲中操作I的名称为__________ ;滤液中的阳离子有__________ (填离子符号)。
(2)方案乙中步骤I碱式碳酸铜受热分解生成黑色固体A、CO2和H2O,该步骤中还有另一个化合反应也生成固体A,该化合反应的化学方程式为__________ 。
【实验结果】
(3)方案甲所得固体经洗涤、干燥后,称得质量为6.4g。则该锈蚀铜样品中单质铜的质量分数为________ 。
(4)方案乙中,所得铜的质量__________ (填“>”、“<”或“=”)6.4g。
【实验反思】
(5)方案甲中,若需对所得滤液中的铜元素进行回收,则可以加入一种稍过量的金属,该反应的化学方程式可能为___________ 。
(6)方案乙与方案甲相比,方案乙的缺点有__________ (任写一个)。
【拓展延伸】
(7)指导老师指出,方案乙最终所得铜中可能含有Cu2O(也为红色),请为该小组设计检验是否含有Cu2O的实验方案(写出操作、现象、结论)___________ 。
(8)查阅资料发现,古代青铜器除锈蚀生成碱式碳酸铜外,在氯离子等作用下,会生成氯化亚铜(CuC1),CuC1易与O2、H2O反应生成氯化氢和碱式氯化铜【Cu2(OH)3C1】,该化学方程式为__________ 。
【查阅资料】①
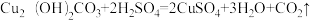
(2)

【实验设计】取锈蚀铜样品(假设除铜和碱式碳酸铜外,不含其它物质)均分为两等份,设计甲、乙两方案。

(1)方案甲中操作I的名称为
(2)方案乙中步骤I碱式碳酸铜受热分解生成黑色固体A、CO2和H2O,该步骤中还有另一个化合反应也生成固体A,该化合反应的化学方程式为
【实验结果】
(3)方案甲所得固体经洗涤、干燥后,称得质量为6.4g。则该锈蚀铜样品中单质铜的质量分数为
(4)方案乙中,所得铜的质量
【实验反思】
(5)方案甲中,若需对所得滤液中的铜元素进行回收,则可以加入一种稍过量的金属,该反应的化学方程式可能为
(6)方案乙与方案甲相比,方案乙的缺点有
【拓展延伸】
(7)指导老师指出,方案乙最终所得铜中可能含有Cu2O(也为红色),请为该小组设计检验是否含有Cu2O的实验方案(写出操作、现象、结论)
(8)查阅资料发现,古代青铜器除锈蚀生成碱式碳酸铜外,在氯离子等作用下,会生成氯化亚铜(CuC1),CuC1易与O2、H2O反应生成氯化氢和碱式氯化铜【Cu2(OH)3C1】,该化学方程式为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组采用如下左图装置焙烧MnCO3制取MnO2。

已知:MnCO3在空气中加热时依次发生下列反应:



(1)焙烧时向石英管中通入空气的目的是__________。
(2)焙烧MnCO3时,测得残留固体的质量随温度的变化如上右图所示,则焙烧MnCO3制取MnO2应该控制反应的温度为________℃。
(3)试根据化学方程式求11.5 g MnCO3通过焙烧最多制得的MnO2的质量为_________。(请列式写出计算过程)。
(4)计算11.5 g MnCO3加热到900℃时得到的固体中所含氧元素质量的方法有很多,其中结合有关数据并利用如右上图所示数据进行计算的表达式为_________(保留原始数字,不得化简)。

已知:MnCO3在空气中加热时依次发生下列反应:



(1)焙烧时向石英管中通入空气的目的是__________。
(2)焙烧MnCO3时,测得残留固体的质量随温度的变化如上右图所示,则焙烧MnCO3制取MnO2应该控制反应的温度为________℃。
(3)试根据化学方程式求11.5 g MnCO3通过焙烧最多制得的MnO2的质量为_________。(请列式写出计算过程)。
(4)计算11.5 g MnCO3加热到900℃时得到的固体中所含氧元素质量的方法有很多,其中结合有关数据并利用如右上图所示数据进行计算的表达式为_________(保留原始数字,不得化简)。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
【推荐2】为测定某石灰石的纯度(石灰石中所含杂质不与盐酸反应,不溶于盐酸也不溶于水),某同学实验并记录如下:

(1)写出高温煅烧石灰石所发生反应的化学方程式__________________________________________ ;(2)根据已知条件列出求解B中参加反应的碳酸钙质量(x)的比例式______________________ ;
(3)此石灰石的纯度为___________ ;
(4)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是_________ ;
(5)向E烧杯内加入232.8克的水,得到的溶质的质量分数为_____________ 。

(1)写出高温煅烧石灰石所发生反应的化学方程式
(3)此石灰石的纯度为
(4)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是
(5)向E烧杯内加入232.8克的水,得到的溶质的质量分数为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】氯化钙和氯化铵的混合溶液可用于铜合金着色。为测定某氯化钙和氯化铵的混合溶液中氯化钙的含量,某化学小组称取40.0g该溶液样品,向其中滴加碳酸钠溶液,测得生成沉淀的质量与加入碳酸钠溶液的质量间的关系如下图所示。请回答:

(1)滴入碳酸钠溶液后,需进行搅拌,其目的是______ 。
(2)由图可知,当生成5g沉淀后,继续加入碳酸钠溶液沉淀的质量不再增加,其原因是______ 。
(3)请计算该样品中氯化钙的质量分数。(写出计算过程,结果精确到0.1%)
(4)反思:测定反应生成沉淀的质量时,需先对沉淀进行洗涤、干燥,否则会影响测定结果。取最后一次的洗涤液,向其中滴入硝酸银溶液,若观察到______ (填现象),说明沉淀已洗涤干净,如果沉淀未完全干燥,所测氯化钙的质量分数会______ (填“偏大”“不变”或“偏小”)。

(1)滴入碳酸钠溶液后,需进行搅拌,其目的是
(2)由图可知,当生成5g沉淀后,继续加入碳酸钠溶液沉淀的质量不再增加,其原因是
(3)请计算该样品中氯化钙的质量分数。(写出计算过程,结果精确到0.1%)
(4)反思:测定反应生成沉淀的质量时,需先对沉淀进行洗涤、干燥,否则会影响测定结果。取最后一次的洗涤液,向其中滴入硝酸银溶液,若观察到
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】某化学兴趣小组为验证硫酸的部分化学性质使用氢氧化钠、碳酸钠、金属铝和另外一种不同类别的物质A进行了相关实验。_________ ,属于______ 反应(填基本反应类型)。
(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三、则B溶液是________ 溶液,图三中的M与图二中X、Y、Z中的________ 数值相等。
(3)该化学兴趣小组又做了如图四所示实验:
【提出问题】②号试管中无色溶液的溶质是什么?
【作出猜想】猜想一:硫酸钠 猜想二:硫酸钠和硫酸 猜想三:硫酸钠和氢氧化钠
【实验验证】该小组同学用试管取适量②号试管中的无色溶液。
【质疑反思】小东认为猜想三不能成立,因为①②号试管中的溶液混合后烧杯中没有蓝色沉淀生成。
请你告诉他出现这种现象的原因可能是___________ 。

(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三、则B溶液是
(3)该化学兴趣小组又做了如图四所示实验:
【提出问题】②号试管中无色溶液的溶质是什么?
【作出猜想】猜想一:硫酸钠 猜想二:硫酸钠和硫酸 猜想三:硫酸钠和氢氧化钠
【实验验证】该小组同学用试管取适量②号试管中的无色溶液。
| 实验操作 | 实验现象 | 实验结论 | |
| 小月 | 用试管取少量②号试管中的无色溶液,加入适量 | 无气泡生成 | 猜想二不成立 |
| 小妮 | 用试管另取少量②号试管中的无色溶液,加入适量硫酸铜溶液 | 猜想三成立,发生反应的化学方程式为 |
请你告诉他出现这种现象的原因可能是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】金属及其化合物在生产生活中有广泛的应用。
(一)金属的应用和防护

(1)“航母”舰体材料为合金钢。合金钢是_______ (填序号)。
a.合成材料 b.复合材料 c.无机材料
(2)“航母”升降机可由铝合金制造。用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到Al和O2,阳极区使用的石墨易消耗的原因是_______ 。
(3)“航母”螺旋桨可由铜合金制造。铜合金比铜的硬度_______ (填“大”或“小”)。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为_______ 。
(5)碱式碳酸铝镁Mg6Al2(OH)12CO3•4H2O是一种新型塑料阻燃剂,其受热分解生成熔点较高的MgO和Al2O3,其阻燃原理是_______ 。
(二)金属及其化合物的利用
聚合碱式氯化铝铁(简称PAFC)【化学式:[FeaAlb(OH)xCly]n】是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘为配料M(主要成分:Al2O3、Fe2O3,杂质FeO、二氧化硅等)为原料制取PAFC的实验流程如下:

(6)将配料粉碎的目的是_______ 。
(7)“酸溶”时生成AlCl3的化学方程式为_______ 。滤渣X中含_______ (写化学式)等。
(8)“转化”时加入NaClO3溶液使酸性溶液中的FeCl2转化为FeCl3,同时生成NaCl,该转化的化学方程式为_______ 。
(9)“操作”包括过滤、洗涤、干燥,判断产品PAFC已洗涤干净的方法是_______ 。
(三)[FeaAlb(OH)xCly]n的组成确定
资料:[FeaAlb(OH)xCly]n受热分解生成氧化铁、氧化铝、水和氯化氢。
取少量PAFC固体样品,用下图装置进行热分解实验。

表:装置B和C的质量变化
(10)装配好实验装置后,先要_______ ,再加入样品。
(11)反应前后均需要通入N2,反应后通入N2的目的是_______ 。
(12)控制温度对A中固体加热至反应完全
①测得B、C装置质量变化如上表所示。
②取出A中固体,向其中加入足量稀盐酸,完全溶解后,向其中加入过量NaOH溶液,得红褐色沉淀,过滤、洗涤,在空气中充分灼烧得红棕色固体0.80g。
结论:①[FeaAlb(OH)xCly]n中,x︰y=_______ 。
②完全反应后A中生成氧化铝的质量为_______ g。
(一)金属的应用和防护

(1)“航母”舰体材料为合金钢。合金钢是
a.合成材料 b.复合材料 c.无机材料
(2)“航母”升降机可由铝合金制造。用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到Al和O2,阳极区使用的石墨易消耗的原因是
(3)“航母”螺旋桨可由铜合金制造。铜合金比铜的硬度
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为
(5)碱式碳酸铝镁Mg6Al2(OH)12CO3•4H2O是一种新型塑料阻燃剂,其受热分解生成熔点较高的MgO和Al2O3,其阻燃原理是
(二)金属及其化合物的利用
聚合碱式氯化铝铁(简称PAFC)【化学式:[FeaAlb(OH)xCly]n】是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘为配料M(主要成分:Al2O3、Fe2O3,杂质FeO、二氧化硅等)为原料制取PAFC的实验流程如下:

(6)将配料粉碎的目的是
(7)“酸溶”时生成AlCl3的化学方程式为
(8)“转化”时加入NaClO3溶液使酸性溶液中的FeCl2转化为FeCl3,同时生成NaCl,该转化的化学方程式为
(9)“操作”包括过滤、洗涤、干燥,判断产品PAFC已洗涤干净的方法是
(三)[FeaAlb(OH)xCly]n的组成确定
资料:[FeaAlb(OH)xCly]n受热分解生成氧化铁、氧化铝、水和氯化氢。
取少量PAFC固体样品,用下图装置进行热分解实验。

表:装置B和C的质量变化
| 装置 | B | C |
| 反应前 | 100.00 | 100.00 |
| 反应后 | 100.18 | 102.92 |
(10)装配好实验装置后,先要
(11)反应前后均需要通入N2,反应后通入N2的目的是
(12)控制温度对A中固体加热至反应完全
①测得B、C装置质量变化如上表所示。
②取出A中固体,向其中加入足量稀盐酸,完全溶解后,向其中加入过量NaOH溶液,得红褐色沉淀,过滤、洗涤,在空气中充分灼烧得红棕色固体0.80g。
结论:①[FeaAlb(OH)xCly]n中,x︰y=
②完全反应后A中生成氧化铝的质量为
您最近一年使用:0次
【推荐3】为了人类共同生活的家园,垃圾分类从我做起。某校社会实践小组的同学们对垃圾的类别、分类回收及危害产生了浓厚的兴趣并开启了项目式学习之旅。

任务一:了解垃圾分类的意义
(1)学会识图分拣垃圾:塑料瓶应投入的垃圾箱是______ (填字母序号)。垃圾的综合化分类具体可得到金属、塑料和纸屑等可再利用的资源。
任务二:学习垃圾分类处理的方法
【参观学习】小组同学在技术人员的指导下,了解到垃圾回收处理的过程如下:分类收集→运输→垃圾处理厂筛分→分类处理→最终处置
【小组交流】
(2)垃圾筛分时,可根据______ 区分铜和铁。
任务三:探究垃圾焚烧产生的气体成分
【查阅资料】
①SO2能使品红溶液褪色,常用于检验SO2
②紫红色酸性高锰酸钾溶液可与SO2反应而褪色,常用于除去SO2
③SO2也能使澄清石灰水变浑浊
④氢氧化钠溶液可以吸收二氧化碳
【提出问题】塑料垃圾焚烧后的生成物中除了CO2是否含有SO2、 CO ?同学们利用废旧矿泉水瓶燃烧后的气体设计了如图所示的实验。

【实验步骤】
①先点燃G处的酒精灯。
②然后向A中通入燃烧后的气体。
③一段时间后,点燃E处的酒精灯,观察现象。
④实验结束后,先熄灭E处的酒精灯,再停止通入气体,最后熄灭G处的酒精灯。
【实验现象】
(3)①观察到A、B中溶液均不褪色。
②C、 F处澄清石灰水均变浑浊。
③E处_______ 。
【实验结论】
(4)燃烧后的气体中含有_______ ,装置C处发生反应的化学方程式为_______ 。
【反思评价】
(5)小组同学通过一定手段,测得焚烧垃圾产生的气体中CO体积分数变化如下图所示,t1~t2时间段内CO体积分数出现异常的原因是_______ 。

任务四:探究废旧矿泉水瓶是否含有氧元素。
同学们设计了下图所示装置进行实验,将19.2 g 废旧矿泉水瓶碎片在足量的干燥O2中完全燃烧后,称量B装置增重了7.2 g,C装置增重了44 g,回答下列问题:
已知:浓硫酸有吸水性,装置中溶液均足量。

(6)该废旧矿泉水瓶中______ (填“含”或“不含”)氧元素。

任务一:了解垃圾分类的意义
(1)学会识图分拣垃圾:塑料瓶应投入的垃圾箱是
任务二:学习垃圾分类处理的方法
【参观学习】小组同学在技术人员的指导下,了解到垃圾回收处理的过程如下:分类收集→运输→垃圾处理厂筛分→分类处理→最终处置
【小组交流】
(2)垃圾筛分时,可根据
任务三:探究垃圾焚烧产生的气体成分
【查阅资料】
①SO2能使品红溶液褪色,常用于检验SO2
②紫红色酸性高锰酸钾溶液可与SO2反应而褪色,常用于除去SO2
③SO2也能使澄清石灰水变浑浊
④氢氧化钠溶液可以吸收二氧化碳
【提出问题】塑料垃圾焚烧后的生成物中除了CO2是否含有SO2、 CO ?同学们利用废旧矿泉水瓶燃烧后的气体设计了如图所示的实验。

【实验步骤】
①先点燃G处的酒精灯。
②然后向A中通入燃烧后的气体。
③一段时间后,点燃E处的酒精灯,观察现象。
④实验结束后,先熄灭E处的酒精灯,再停止通入气体,最后熄灭G处的酒精灯。
【实验现象】
(3)①观察到A、B中溶液均不褪色。
②C、 F处澄清石灰水均变浑浊。
③E处
【实验结论】
(4)燃烧后的气体中含有
【反思评价】
(5)小组同学通过一定手段,测得焚烧垃圾产生的气体中CO体积分数变化如下图所示,t1~t2时间段内CO体积分数出现异常的原因是

任务四:探究废旧矿泉水瓶是否含有氧元素。
同学们设计了下图所示装置进行实验,将19.2 g 废旧矿泉水瓶碎片在足量的干燥O2中完全燃烧后,称量B装置增重了7.2 g,C装置增重了44 g,回答下列问题:
已知:浓硫酸有吸水性,装置中溶液均足量。

(6)该废旧矿泉水瓶中
您最近一年使用:0次



