某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:

查阅资料:硫酸铜的溶解度如下表:
【产品制备】
(1)流程图中X的化学式
(2)反应②在80℃条件下制备硫酸铜,其化学方程式为_____ 。操作A将CuSO4溶液进行蒸发浓缩、 _____ 、过滤、洗涤等操作即得到硫酸铜晶体。
【组成测定】
小组同学为测定石青的组成,称取了一定质量的石青样品,用如图装置进行实验。
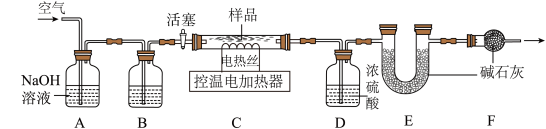
查阅资料:
①石青的化学式可表示为aCuCO3•bCu(OH)2
②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2 CuO+H2O;
CuO+H2O;
CuCO3在200℃~220℃完全分解:CuCO3 CuO+CO2↑
CuO+CO2↑
③CuSO4固体为白色,CuSO4•5H2O固体为蓝色
实验步骤:①连接仪器,并____,准确称取69.2gaCuCO3•bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞,____;⑤冷却后,称量,装置D增重3.6g,装置E增重17.6g。
(3)完善上述实验步骤中的填空:①_____ ;④ _____ 。
(4)洗气瓶A中氢氧化钠溶液的作用是_____ ;B中所装液体为 _____ (填名称)。
(5)试确定石青的化学式_____ (请写出计算过程)。
(6)若缺少F装置,测得的a:b的值将_____ (选填“偏大”、“偏小”、“不变”)。
【脱水探究】
硫酸铜晶体受热会逐步失去结晶水。取纯净的CuSO4•5H2O固体2.50g,放在上图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示。
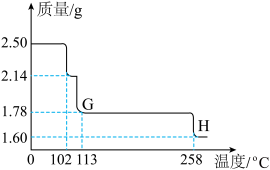
(7)G点固体的化学式是_____ ;H点固体的颜色是 _____ 。
(8)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_____ 。

查阅资料:硫酸铜的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
(1)流程图中X的化学式
(2)反应②在80℃条件下制备硫酸铜,其化学方程式为
【组成测定】
小组同学为测定石青的组成,称取了一定质量的石青样品,用如图装置进行实验。

查阅资料:
①石青的化学式可表示为aCuCO3•bCu(OH)2
②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2
 CuO+H2O;
CuO+H2O;CuCO3在200℃~220℃完全分解:CuCO3
 CuO+CO2↑
CuO+CO2↑③CuSO4固体为白色,CuSO4•5H2O固体为蓝色
实验步骤:①连接仪器,并____,准确称取69.2gaCuCO3•bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞,____;⑤冷却后,称量,装置D增重3.6g,装置E增重17.6g。
(3)完善上述实验步骤中的填空:①
(4)洗气瓶A中氢氧化钠溶液的作用是
(5)试确定石青的化学式
(6)若缺少F装置,测得的a:b的值将
【脱水探究】
硫酸铜晶体受热会逐步失去结晶水。取纯净的CuSO4•5H2O固体2.50g,放在上图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示。

(7)G点固体的化学式是
(8)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:
更新时间:2019-05-14 00:17:30
|
相似题推荐
综合应用题
|
较难
(0.4)
解题方法
【推荐1】化学是一门以实验为基础的科学实验室,选用以下装置制取CO2。

(1)A中反应的化学方程式为___________ ;
(2)若将A,B连接,A中产生的气体并不能使B中的溶液变浑浊,请写出原因:_____________ 。
(3)实验室要制备并收集纯净干燥的二氧化碳气体,所选装置接口的连接顺序为:a接顺序为__________________________
(4)相比如图中的G装置,A装置的优点是________________ ;为了解装置具有该优点的原因,在装置A中连接压强传感器(如图H),从而测定实验中试管内气体压强变化的情况(如图L)。ab段试管中液面逐渐___________ (填“上升”或“下降”),c点对应的操作是___________ 。

(5)某化学兴趣小组同学对此反应后的溶液产生兴趣,他们取一定量反应后的液体,过滤,向所得滤液中逐滴滴入碳酸钠溶液(碳酸钠溶液显碱性),并用pH传感器连续监测,得到如图曲线图(横坐标为时间,纵坐标为pH)。

①请分析图像,写出AB段内发生反应的化学方程式______________ 。
②你认为图中CD段上升的原因是__________________ 。
(6)取氯化钙和碳酸钙的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示。

①稀盐酸中溶质质量分数为______ 。
②恰好完全反应时,所得不饱和溶液中溶质的质量分数______ (写出计算过程,计算结果精确到0.1%)。

(1)A中反应的化学方程式为
(2)若将A,B连接,A中产生的气体并不能使B中的溶液变浑浊,请写出原因:
(3)实验室要制备并收集纯净干燥的二氧化碳气体,所选装置接口的连接顺序为:a接顺序为
(4)相比如图中的G装置,A装置的优点是

(5)某化学兴趣小组同学对此反应后的溶液产生兴趣,他们取一定量反应后的液体,过滤,向所得滤液中逐滴滴入碳酸钠溶液(碳酸钠溶液显碱性),并用pH传感器连续监测,得到如图曲线图(横坐标为时间,纵坐标为pH)。

①请分析图像,写出AB段内发生反应的化学方程式
②你认为图中CD段上升的原因是
(6)取氯化钙和碳酸钙的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示。

①稀盐酸中溶质质量分数为
②恰好完全反应时,所得不饱和溶液中溶质的质量分数
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】生活中铜制品长期露置在潮湿空气中会锈蚀生成碱式碳酸铜【Cu2(OH)2CO3】。某研究性学习小组为探究某锈蚀铜样品中单质铜的质量分数,并回收铜。
【查阅资料】①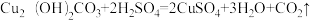
(2)
【实验设计】取锈蚀铜样品(假设除铜和碱式碳酸铜外,不含其它物质)均分为两等份,设计甲、乙两方案。

(1)方案甲中操作I的名称为__________ ;滤液中的阳离子有__________ (填离子符号)。
(2)方案乙中步骤I碱式碳酸铜受热分解生成黑色固体A、CO2和H2O,该步骤中还有另一个化合反应也生成固体A,该化合反应的化学方程式为__________ 。
【实验结果】
(3)方案甲所得固体经洗涤、干燥后,称得质量为6.4g。则该锈蚀铜样品中单质铜的质量分数为________ 。
(4)方案乙中,所得铜的质量__________ (填“>”、“<”或“=”)6.4g。
【实验反思】
(5)方案甲中,若需对所得滤液中的铜元素进行回收,则可以加入一种稍过量的金属,该反应的化学方程式可能为___________ 。
(6)方案乙与方案甲相比,方案乙的缺点有__________ (任写一个)。
【拓展延伸】
(7)指导老师指出,方案乙最终所得铜中可能含有Cu2O(也为红色),请为该小组设计检验是否含有Cu2O的实验方案(写出操作、现象、结论)___________ 。
(8)查阅资料发现,古代青铜器除锈蚀生成碱式碳酸铜外,在氯离子等作用下,会生成氯化亚铜(CuC1),CuC1易与O2、H2O反应生成氯化氢和碱式氯化铜【Cu2(OH)3C1】,该化学方程式为__________ 。
【查阅资料】①
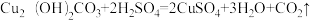
(2)

【实验设计】取锈蚀铜样品(假设除铜和碱式碳酸铜外,不含其它物质)均分为两等份,设计甲、乙两方案。

(1)方案甲中操作I的名称为
(2)方案乙中步骤I碱式碳酸铜受热分解生成黑色固体A、CO2和H2O,该步骤中还有另一个化合反应也生成固体A,该化合反应的化学方程式为
【实验结果】
(3)方案甲所得固体经洗涤、干燥后,称得质量为6.4g。则该锈蚀铜样品中单质铜的质量分数为
(4)方案乙中,所得铜的质量
【实验反思】
(5)方案甲中,若需对所得滤液中的铜元素进行回收,则可以加入一种稍过量的金属,该反应的化学方程式可能为
(6)方案乙与方案甲相比,方案乙的缺点有
【拓展延伸】
(7)指导老师指出,方案乙最终所得铜中可能含有Cu2O(也为红色),请为该小组设计检验是否含有Cu2O的实验方案(写出操作、现象、结论)
(8)查阅资料发现,古代青铜器除锈蚀生成碱式碳酸铜外,在氯离子等作用下,会生成氯化亚铜(CuC1),CuC1易与O2、H2O反应生成氯化氢和碱式氯化铜【Cu2(OH)3C1】,该化学方程式为
您最近一年使用:0次
【推荐3】铜是人类使用最早、应用广泛的金属。
(一)对古代铜制品认识
(1)出土的古代青铜器能保存至今的原因可能是___________ (选填序号)。
a.铜的活泼性弱,不易生锈 b.深埋于地下,隔绝空气
(2)《吕氏春秋·别类篇》载有“金柔锡柔,合两柔则刚”,表明我们的祖先已认识到铜合金的硬度比纯铜___________ (填“大”或“小”)。
(二)铜的化合物制备
用辉铜矿(主要成分为Cu2S,还含有少量Fe2O3、SiO2杂质)制备铜绿流程如图:(已知:氧化硅不溶于水,也不溶于酸)

(3)反应池中发生的有关反应: 、
、___________ 。滤渣的成分一定有___________ 。
(4)部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示。调节pH,使Fe3+完全沉淀而Cu2+不沉淀,则pH的范围应控制在__________ 。
(5)结晶池中温度须控制在70℃-80℃,如果出现_________ (填写实验现象),说明温度过高。
(二)碱式碳酸铜的热分解实验
(6)探究碱式碳酸铜的组成:某碱式碳酸铜成分可表示为Cua(OH)b(CO3)c,某化学兴趣小组的同学们使用如下图所示的装置进行实验探究。

实验步骤:
①组装好置后,检查装置的气密性。
②将称好的3.46g的碱式碳酸铜样品放入硬质玻璃管中,再分别称量装置C和装置D的质量。
③先打开活塞K1、K2,关闭活塞K3,缓缓鼓入空气数分钟。
④再打开活塞_________ ,关闭活塞_________ ,点燃酒精灯加热至B中固体全部变黑。
⑤打开活塞K1缓缓鼓入空气数分钟,然后拆下装置,称量洗气瓶C和U形管D的质量如下表:
计算a:b:c=_________ 。若缺少E装置,b:c的比值会_________ (填“偏大”、“偏小”或“无影响”)
(7)将上述实验所得黑色固体继续加强热,观察到黑色固体又变成了红色。
【提出问题】红色固体的成分是什么?
资料:Cu和Cu2O均为红色固体, 。
。
【猜想】红色固体可能是:猜想I:Cu: 猜想Ⅱ:Cu2O: 猜想Ⅲ:_________ 。
【实验】
①称量B中得到红色剩余固体质量为2.16g。
②再向红色固体中加入足量稀硫酸,观察到_________ (填现象),则猜想I错误。请结合以上数据,计算红色固体的成分_________ 。(写出计算过程)
(一)对古代铜制品认识
(1)出土的古代青铜器能保存至今的原因可能是
a.铜的活泼性弱,不易生锈 b.深埋于地下,隔绝空气
(2)《吕氏春秋·别类篇》载有“金柔锡柔,合两柔则刚”,表明我们的祖先已认识到铜合金的硬度比纯铜
(二)铜的化合物制备
用辉铜矿(主要成分为Cu2S,还含有少量Fe2O3、SiO2杂质)制备铜绿流程如图:(已知:氧化硅不溶于水,也不溶于酸)

(3)反应池中发生的有关反应:
 、
、(4)部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示。调节pH,使Fe3+完全沉淀而Cu2+不沉淀,则pH的范围应控制在
| 氢氧化物 | Mn (OH)2 | Fe (OH)3 | Cu (OH)2 |
| 开始沉淀的pH | 8.3 | 2.7 | 4.4 |
| 完全沉淀的pH | 9.8 | 3.7 | 6.4 |
(5)结晶池中温度须控制在70℃-80℃,如果出现
(二)碱式碳酸铜的热分解实验
(6)探究碱式碳酸铜的组成:某碱式碳酸铜成分可表示为Cua(OH)b(CO3)c,某化学兴趣小组的同学们使用如下图所示的装置进行实验探究。

实验步骤:
①组装好置后,检查装置的气密性。
②将称好的3.46g的碱式碳酸铜样品放入硬质玻璃管中,再分别称量装置C和装置D的质量。
③先打开活塞K1、K2,关闭活塞K3,缓缓鼓入空气数分钟。
④再打开活塞
⑤打开活塞K1缓缓鼓入空气数分钟,然后拆下装置,称量洗气瓶C和U形管D的质量如下表:
| C装置 | D装置 | |
| 反应前 | 87.7g | 74.7g |
| 反应后 | 87.88g | 75.58g |
(7)将上述实验所得黑色固体继续加强热,观察到黑色固体又变成了红色。
【提出问题】红色固体的成分是什么?
资料:Cu和Cu2O均为红色固体,
 。
。【猜想】红色固体可能是:猜想I:Cu: 猜想Ⅱ:Cu2O: 猜想Ⅲ:
【实验】
①称量B中得到红色剩余固体质量为2.16g。
②再向红色固体中加入足量稀硫酸,观察到
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】镁是一种银白色的金属,但拿出的镁条总是有一层灰黑色的“外衣"。
【提出问题】这层灰黑色的“外衣”是什么物质呢?
【提出猜想】小组同学认为该固体不可能是MgO,他们的理由是______ ;由铜生锈会产生Cu2(OH)2CO3,联想到灰黑色的物质可能是Mg2(OH)2CO3。
【查阅资料】Mg2(OH)2CO3 2MgO + H2O + CO2↑
2MgO + H2O + CO2↑
【实验分析】按图所示装置进行实验:

观察到如下现象:______ ,证明灰黑色的“外衣”是Mg2(OH)2CO3。
由此可知:灰黑色的“外衣”是镁与空气中氧气、______ 等物质作用,发生一系列化学反应形成的。
【组成测定】小组同学称取2.5g有“外衣”的样品,按如下装置进行实验:

装置A中发生的的化学方程式为:
反应I:Mg2(OH)2CO3 + 2H2SO4=2MgSO4 +3H2O + CO2↑
反应II:Mg + H2SO4=MgSO4+ H2↑
实验结束后,装置D内生成氢气体积为2.24L。请回答:(该条件下氢气密度为0.09g/L)
(1)装置B中发生反应的化学方程式为______ 。
(2)装置C的作用是______ 。
(3)装置D内所得氢气的质量=______ 。(结果精确到0.1g)
(4)“样品”中金属单质镁的质量分数。______ (列式计算)。
【提出问题】这层灰黑色的“外衣”是什么物质呢?
【提出猜想】小组同学认为该固体不可能是MgO,他们的理由是
【查阅资料】Mg2(OH)2CO3
 2MgO + H2O + CO2↑
2MgO + H2O + CO2↑【实验分析】按图所示装置进行实验:

观察到如下现象:
由此可知:灰黑色的“外衣”是镁与空气中氧气、
【组成测定】小组同学称取2.5g有“外衣”的样品,按如下装置进行实验:

装置A中发生的的化学方程式为:
反应I:Mg2(OH)2CO3 + 2H2SO4=2MgSO4 +3H2O + CO2↑
反应II:Mg + H2SO4=MgSO4+ H2↑
实验结束后,装置D内生成氢气体积为2.24L。请回答:(该条件下氢气密度为0.09g/L)
(1)装置B中发生反应的化学方程式为
(2)装置C的作用是
(3)装置D内所得氢气的质量=
(4)“样品”中金属单质镁的质量分数。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解。现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3,某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案。
方案一:样品 测定生成CO2的质量。
测定生成CO2的质量。

(1)本实验采用如图所示的装置,C中盛放的物质是_____________ 。
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,_________ (填“能”或“不能”)准确测定样品中NaHCO3的质量分数。
方案二:样品 测定剩余固体质量。
测定剩余固体质量。
具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是__________ 。
(4)根据题意,计算样品中NaHCO3的质量分数,写出计算过程。
(已知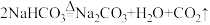 )
)
方案一:样品
 测定生成CO2的质量。
测定生成CO2的质量。
(1)本实验采用如图所示的装置,C中盛放的物质是
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,
方案二:样品
 测定剩余固体质量。
测定剩余固体质量。具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是
(4)根据题意,计算样品中NaHCO3的质量分数,写出计算过程。
(已知
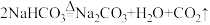 )
)
您最近一年使用:0次
综合应用题
|
较难
(0.4)
真题
解题方法
【推荐3】“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水。兴趣小组对其进行以下探究:
[性质探究]
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡。将带火星木条伸入试管,木条_______ ,说明有O2生成。
(2)取实验(1)中上层清液,测得溶液PH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有_________ 生成。
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
[工业制备]

(3)稳定剂的作用是_____________ ;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为 ______________________ 。
(4)浊液中加入异丙醇的作用是_____________________ 。
(5)操作Ⅱ中洗涤晶体的试剂最好选用__________ (填字母)。
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是________ ℃。
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数。
[组成测定]利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响)。

查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品。
②过碳酸钠能与酸反应放出CO2和O2。
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是________________________ 。
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值_______ (填“偏大”或“偏小”)。
(9)装置B的作用是_______ (填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g。该产品中活性氧含量为_____ %;属于 _______ (填“一等品”或“合格品”);x:y= _______ 。
[性质探究]
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡。将带火星木条伸入试管,木条
(2)取实验(1)中上层清液,测得溶液PH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
[工业制备]

(3)稳定剂的作用是
(4)浊液中加入异丙醇的作用是
(5)操作Ⅱ中洗涤晶体的试剂最好选用
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数。
[组成测定]利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响)。

查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品。
②过碳酸钠能与酸反应放出CO2和O2。
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值
(9)装置B的作用是
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g。该产品中活性氧含量为
您最近一年使用:0次
【推荐1】根据所学,回答问题。
(1)实验室有两瓶未贴标签的试剂,一瓶是氢氧化钠溶液,一瓶是稀硫酸。某化学兴趣小组利用这两瓶试剂进行了如下探究:
①区分两瓶试剂。下列药品中能成功达到实验目的的是______ 。
A.氯化钠溶液B.酚酞试液C.铁粉D.氧化铜
②经过区分后,兴趣小组向氢氧化钠溶液中加入了过量的稀盐酸,发现有少量气泡冒出,则该气泡的主要成分为________ 。兴趣小组据此得出结论,该氢氧化钠溶液已经变质。请写出变质的原因:_______ (用化学方程式表示)。
(2)有某固体混合物,已知该混合物中可能含有FeCl3、Na2SO4、NH4NO3、CuSO4四种物质中的两种或多种。某化学兴趣小组按如图所示进行实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应)。

试根据实验过程和发生的现象填写以下空白:
①气体A的化学式为______ ,它能使紫色石蕊试液变_____ 色。
②生成蓝色沉淀C的化学方程式为______ 。
③固体混合物里,上述四种物质中,肯定不存在的物质是______ ,理由是______ 。
④实验证明,在溶液D中,肯定存在的酸根离子是(写离子符号)_____ 。
⑤实验过程②中发生反应的化学方程式为_____ 。
(1)实验室有两瓶未贴标签的试剂,一瓶是氢氧化钠溶液,一瓶是稀硫酸。某化学兴趣小组利用这两瓶试剂进行了如下探究:
①区分两瓶试剂。下列药品中能成功达到实验目的的是
A.氯化钠溶液B.酚酞试液C.铁粉D.氧化铜
②经过区分后,兴趣小组向氢氧化钠溶液中加入了过量的稀盐酸,发现有少量气泡冒出,则该气泡的主要成分为
(2)有某固体混合物,已知该混合物中可能含有FeCl3、Na2SO4、NH4NO3、CuSO4四种物质中的两种或多种。某化学兴趣小组按如图所示进行实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应)。

试根据实验过程和发生的现象填写以下空白:
①气体A的化学式为
②生成蓝色沉淀C的化学方程式为
③固体混合物里,上述四种物质中,肯定不存在的物质是
④实验证明,在溶液D中,肯定存在的酸根离子是(写离子符号)
⑤实验过程②中发生反应的化学方程式为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______ g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________ (填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________ 。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
步骤I:查阅资料,得到氯化铜溶解度数据如下
| 温度(℃) | 0 | 20 | 25 | 40 | 50 | 60 | 80 |
| 溶解度(g) | 69.2 | 74.5 | 76.4 | 81.8 | 85.5 | 89.4 | 98.0 |
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是
②将称取的CuCl2固体和20mL水倒入烧杯中,
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】工业上常用电解饱和食盐水的方法制取烧碱,某化学兴趣小组为了探究久置的工业烧碱的成分,进行了如下实验:
(1)取少量样品于烧杯中,向其中加入过量稀盐酸,观察到有气泡产生,说明样品中含有_________ ,接着又向烧杯中继续加入硝酸银溶液,出现了白色沉淀(已知氯化银是白色沉淀),得出结论:样品中____________ (填“一定”或“不一定”)含有氯化钠。
(2)丙同学认为除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠,于是,大家又进行了以下实验:
①另取少量样品溶解于水,向其中加入过量硝酸钙溶液,产生白色沉淀,然后过滤、洗涤;
②取少量滤液滴入酚酞,溶液变红;
③向滤液中加入足量稀硝酸,再滴入硝酸银溶液后产生白色沉淀;
由此判断,实验中滤渣的成分是_________ (填化学式)。
(3)根据以上实验,得出的结论正确的是________ (填序号)。
A、样品中无NaCl
B、样品中只有NaOH和Na2CO3
C、样品中无NaOH
D、样品中有Na2CO3、NaOH和NaCl
(4)配制100mL质量分数10%的氢氧化钠溶液(密度1.11g/mL),需要质量分数40%的氢氧化钠溶液(1.43g/mL)_________ mL,水________ mL。(计算结果精确到0.1)
(1)取少量样品于烧杯中,向其中加入过量稀盐酸,观察到有气泡产生,说明样品中含有
(2)丙同学认为除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠,于是,大家又进行了以下实验:
①另取少量样品溶解于水,向其中加入过量硝酸钙溶液,产生白色沉淀,然后过滤、洗涤;
②取少量滤液滴入酚酞,溶液变红;
③向滤液中加入足量稀硝酸,再滴入硝酸银溶液后产生白色沉淀;
由此判断,实验中滤渣的成分是
(3)根据以上实验,得出的结论正确的是
A、样品中无NaCl
B、样品中只有NaOH和Na2CO3
C、样品中无NaOH
D、样品中有Na2CO3、NaOH和NaCl
(4)配制100mL质量分数10%的氢氧化钠溶液(密度1.11g/mL),需要质量分数40%的氢氧化钠溶液(1.43g/mL)
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
【探究一】向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和盐酸(如图所示):

(1)蜡烛燃烧变化的现象是:________ 。
(2)根据该实验现象推测碳酸钠与盐酸反应产生的气体可用于________ (写出用途)。
【探究二】利用碳酸钠与盐酸的反应,可否用于验证质量守恒定律进行了探究,实验如下,如图所示,

在(吸滤)瓶中加入适量的碳酸钠粉末,在小试管中加入盐酸。将小试管放入吸滤瓶中,并用止水夹夹住支管处的橡皮管。称量整个装置的质量,记录读数。将吸滤瓶倾斜,使小试管中的盐酸倾倒入瓶中,与碳酸钠粉末反应。可观察到如图二所示的现象。再次称量整个装置的质量,记录读数。
两次读数____ (填“是”或“否”)相等。理由是 _________________ 。
【探究三】碳酸钠与盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
【探究四】某兴趣小组同学向盛有6.0g纯碱样品的烧杯里加入40.0g盐酸,实验测定完全反应后烧杯中剩余物的质量为43.8g,且溶液显酸性。(假设纯碱样品中的杂质不与盐酸反应)求:
(1)产生的二氧化碳的质量为________ g。
(2)纯碱样品中碳酸钠的质量(写出计算过程)。________
【探究一】向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和盐酸(如图所示):

(1)蜡烛燃烧变化的现象是:
(2)根据该实验现象推测碳酸钠与盐酸反应产生的气体可用于
【探究二】利用碳酸钠与盐酸的反应,可否用于验证质量守恒定律进行了探究,实验如下,如图所示,

在(吸滤)瓶中加入适量的碳酸钠粉末,在小试管中加入盐酸。将小试管放入吸滤瓶中,并用止水夹夹住支管处的橡皮管。称量整个装置的质量,记录读数。将吸滤瓶倾斜,使小试管中的盐酸倾倒入瓶中,与碳酸钠粉末反应。可观察到如图二所示的现象。再次称量整个装置的质量,记录读数。
两次读数
【探究三】碳酸钠与盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加 | 试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液 |
(1)产生的二氧化碳的质量为
(2)纯碱样品中碳酸钠的质量(写出计算过程)。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】空气是人类最宝贵的自然资源。空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程。请按要求回答下列问题:

(1)步骤①中可利用氮气和氧气的______ 不同分离出氮气和氧气。
(2)写出步骤②中发生反应的化学式表达式______ 。
(3)图2 是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是______ (填字母)。
A.易溶于水 B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%,化肥中碳酸氢铵的含量是多少?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
【查找资料】①碱石灰能够吸收水和CO2,但是不吸收NH3。
②浓硫酸能吸收NH3但是不吸收CO2。
③氨气溶于水形成氨水。
【性质探究】该同学设计了如下的实验装置:

①用A 装置给碳酸氢铵加热,装药品前,必须进行的一步操作是______ 。
②取适量碳酸氢铵加入试管,连接A、C、E 装置,加热,E 中的现象是______ 。
③连接A、B 装置,继续加热,观察到试管口的现象是______ ,B 中的现象是______ ,写出出现此现象的化学式表达式______ 。
④碳酸氢铵在受热时发生反应的化学式表达式是______ 。
【含量分析】将装置A、C、D 依次连接,加入10g 化肥样品,加热至A 中固体完全消失。
她称量装置D 的质量如表:
⑤由此分析得知:反应中产生氨气的质量为______ g。
⑥通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素质量分数为______ 。
⑦请计算此化肥中碳酸氢铵的纯度______ 。
⑧______ g的硝酸铵(NH4NO3)和20g这种化肥的含氮元素质量相等。

(1)步骤①中可利用氮气和氧气的
(2)写出步骤②中发生反应的化学式表达式
(3)图2 是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是
A.易溶于水 B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%,化肥中碳酸氢铵的含量是多少?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
【查找资料】①碱石灰能够吸收水和CO2,但是不吸收NH3。
②浓硫酸能吸收NH3但是不吸收CO2。
③氨气溶于水形成氨水。
【性质探究】该同学设计了如下的实验装置:

①用A 装置给碳酸氢铵加热,装药品前,必须进行的一步操作是
②取适量碳酸氢铵加入试管,连接A、C、E 装置,加热,E 中的现象是
③连接A、B 装置,继续加热,观察到试管口的现象是
④碳酸氢铵在受热时发生反应的化学式表达式是
【含量分析】将装置A、C、D 依次连接,加入10g 化肥样品,加热至A 中固体完全消失。
她称量装置D 的质量如表:
| 实验前D 装置的质量 | 149g |
| 实验后D 装置的质量 | 150.7g |
⑥通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素质量分数为
⑦请计算此化肥中碳酸氢铵的纯度
⑧
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】碳还原氧化铜的实验装置如图甲、乙所示,已知浓硫酸具有吸水性。
I、甲图中酒精灯上网罩的作用是____________ 。
【作出猜想】猜想Ⅰ:CO;猜想Ⅱ:CO2;猜想Ⅲ:①_______________ 。
【设计方案】实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。
方案一:从定性观察角度判断
②实验时装置A处的现象是___________ 。
③若B中无明显现象,D处的气体能点燃,则猜想_________ (填序号)成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
④若猜想Ⅱ成立,则理论上(m4-m3)_____ (m1-m2)(填“>““<”或“=”)。
⑤若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的炭粉的质量m的取值范围是_________ 。
【交流反思】实验开始前缓缓通入氮气的目的是________ 。
II、天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
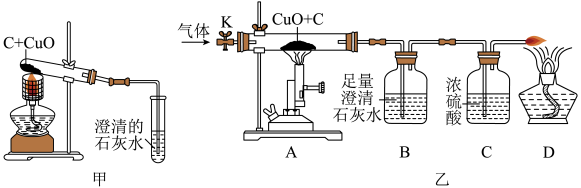
工业上以CH4为原料生产H2,制取原理如图所示:
已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O CO2+H2,CO2+H2O═H2CO3。
CO2+H2,CO2+H2O═H2CO3。
(1)“转化炉”中有H2和CO产生,写出转化炉中发生的反应方程式________ ;
(2)“转化炉”参加反应的CH4与H2O的质量比 =
=________ 。(最简整数比)
(3)若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得________ g H2。(写出计算步骤)
I、甲图中酒精灯上网罩的作用是
【作出猜想】猜想Ⅰ:CO;猜想Ⅱ:CO2;猜想Ⅲ:①
【设计方案】实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。

方案一:从定性观察角度判断
②实验时装置A处的现象是
③若B中无明显现象,D处的气体能点燃,则猜想
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
| 反应前的质量 | 反应后的质量 | |
| A(玻璃管+固体) | m1 | m2 |
| B+C(广口瓶+混合液) | m3 | m4 |
⑤若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的炭粉的质量m的取值范围是
【交流反思】实验开始前缓缓通入氮气的目的是
II、天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
工业上以CH4为原料生产H2,制取原理如图所示:

已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O
 CO2+H2,CO2+H2O═H2CO3。
CO2+H2,CO2+H2O═H2CO3。(1)“转化炉”中有H2和CO产生,写出转化炉中发生的反应方程式
(2)“转化炉”参加反应的CH4与H2O的质量比
 =
=(3)若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得
您最近一年使用:0次



