菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究。取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表
说明:菱镁矿中的杂质不溶于水,不与酸发生反应
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____。
(2)计算该菱镁矿中镁元素的质量分数____________。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是_____。
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____。
(2)计算该菱镁矿中镁元素的质量分数____________。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是_____。
更新时间:2019-06-24 14:05:30
|
相似题推荐
计算题
|
较难
(0.4)
【推荐1】现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。计算:
(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)______;
(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)______。
(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)______;
(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)______。
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉反应的先后顺序为:2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu。加入铁粉质量与反应后溶液中剩余固体质量的关系如图所示。_____ (填化学式)。
(2)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数(写出计算过程)。

(2)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数(写出计算过程)。
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】某同学用锌和稀硫酸制取氢气。向气体发生装置中加入一定量锌粒,将15g稀硫酸溶液分三次加入,每次生成气体的质量如下表,相关反应的化学方程为:Zn+H2SO4=ZnSO4+H2↑。
请计算:
(1)共制得氢气_____ g。
(2)所用稀硫酸的溶质质量分数。(请写出详细计算步骤)
| 次数 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸质量/g | 5 | 5 | 5 |
| 生成氢气质量/g | 0.02 | 0.02 | 0.01 |
请计算:
(1)共制得氢气
(2)所用稀硫酸的溶质质量分数。(请写出详细计算步骤)
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】学校化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铜和铜粉混合而成。他们称取了 20g 固体样品,用下图所示的装置继续实验,至反应完全测定的部分数据如下图所示。据图解决有关问题∶

(1)图中 M点表示反应___________ (填"进行中"或"结束")。
(2)计算样品中氧化铜的质量分数是多少?

(1)图中 M点表示反应
(2)计算样品中氧化铜的质量分数是多少?
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】为了探究石灰石的纯度。(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分4份(编号为①②③④)),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的1/4于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关沉淀质量的变化如图所示,请回答下列问题:

(1)该石灰石样品的纯度为________;
(2)盐酸溶液的溶质质量分数?
(3)求编号③所用稀盐酸的质量m的值是____?
| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 25g | 50g |  | 150g |
| 剩余固体的质量 | 7.5g | 5g | 2g | 2g |

(1)该石灰石样品的纯度为________;
(2)盐酸溶液的溶质质量分数?
(3)求编号③所用稀盐酸的质量m的值是____?
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图1所示实验方案:

【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)生成气体的质量为______.(只写结果)
(2)混合溶液中CaCl2的质量分数为___?(写出计算过程)
(3)若在100g混合溶液中不断加入10.6%的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图(图2).

【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)生成气体的质量为______.(只写结果)
(2)混合溶液中CaCl2的质量分数为___?(写出计算过程)
(3)若在100g混合溶液中不断加入10.6%的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图(图2).
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】某同学将CO和CO2的合气体20g通入186.8g某氢氧化钠溶液中,恰好完全反应后发现溶液质量增加13.2g。试计算:(温馨提示:该反应的化学方程式为 )
)
(1)原混合气体中CO2的质量分数。
(2)恰好完全反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
 )
)(1)原混合气体中CO2的质量分数。
(2)恰好完全反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】某化学兴趣小组对某铜锌合金样品进行探究实验。
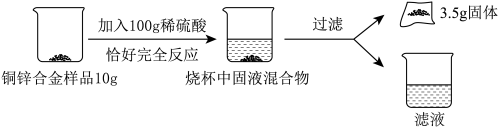
(1)写出题中发生反应的化学方程式___________ ;
(2)根据已知条件列出求解硫酸溶质质量(X)的比例式___________ ;
(3)则生成气体的质量是___________ ;
(4)铜锌合金中,Zn的质量分数是___________ ;
(5)向所得滤液加入54.7g水后得到溶液的溶质质量分数为___________ 。

(1)写出题中发生反应的化学方程式
(2)根据已知条件列出求解硫酸溶质质量(X)的比例式
(3)则生成气体的质量是
(4)铜锌合金中,Zn的质量分数是
(5)向所得滤液加入54.7g水后得到溶液的溶质质量分数为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】某硫酸铜样品中含有不溶性杂质(杂质不溶于水,不含铜元素,不与其他物质发生反应),兴趣小组同学欲测定硫酸铜的含量。进行了如下实验:①取样品20g加入81.8g足量的水搅拌充分溶解后,向其中加入56g氢氧化钾溶液,充分反应后过滤,得到8.9g不溶于水的物质和滤液a;②再向上述滤液a中继续加入56g氢氧化钾溶液,充分反应后过滤,又得到4.9g不溶于水的物质和只含一种溶质的滤液b。请计算:
(1)样品中硫酸铜的质量分数;______________
(2)最后所得滤液b中溶质的质量分数。________________
(1)样品中硫酸铜的质量分数;______________
(2)最后所得滤液b中溶质的质量分数。________________
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐3】某补钙剂(有效成分为碳酸钙,其他成分不含钙元素)的说明书的部分信息如图所示。为了检验该产品,现将20片该药剂制成的粉末,放入40g稀盐酸中HCl与补钙品有效成分刚好完全反应(其他成分不与盐酸反应),反应后称得剩余物的质量为55.6g。试计算:

(1)生成二氧化碳气体的质量是_____;
(2)该品牌补钙剂每片含的CaCO3质量为_______;(写出计算过程)
(3)通过计算分析。该补钙剂说明书中“含钙量”的数值________(填“符合”、“不符合”)标示,若不符合,应将“含钙量”的数值修改为__________。

(1)生成二氧化碳气体的质量是_____;
(2)该品牌补钙剂每片含的CaCO3质量为_______;(写出计算过程)
(3)通过计算分析。该补钙剂说明书中“含钙量”的数值________(填“符合”、“不符合”)标示,若不符合,应将“含钙量”的数值修改为__________。
您最近一年使用:0次



