云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题
云南
高一
开学考试
2022-12-25
70次
整体难度:
适中
考查范围:
常见无机物及其应用、物质结构与性质、认识化学科学、化学与STSE、化学实验基础
一、单选题 添加题型下试题
| A.Na2O2是淡黄色固体, Na2O 是白色固体, 二者都能与水反应生成 NaOH |
| B.Na和O2在加热时反应生成 Na2O2,在常温下反应生成 Na2O |
| C.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2 |
| D.2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g |
【知识点】 过氧化钠 过氧化钠与水的反应解读 过氧化钠和二氧化碳反应解读
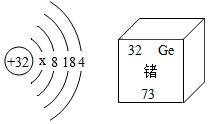
| A.x=2 |
| B.锗元素与碳元素位于同一族,属于ⅣA族 |
| C.锗位于元素周期表第4周期,原子半径大于碳的原子半径 |
| D.距离锗原子核较远区域内运动的电子能量较低 |
【知识点】 元素周期律的应用 核外电子运动 基态核外电子排布规律
| A.原子最外层电子数随核电荷数的增加而增多 |
| B.离子的还原性:F-<Cl-<Br-<I- |
| C.单质沸点最高的为F2 |
| D.单质氧化性随核电荷数的增加而增强 |
| A.铝片表面的氧化膜能保护铝片不受腐蚀,故铁丝表面氧化膜也能保护 |
| B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 |
| C.钠与氧气、水等反应时均作还原剂,金属单质参与化学反应时均作还原剂 |
| D.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 |
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | Fe3+、Cl-、Na+、 | 氨水 | Fe3++3OH-=Fe(OH)3↓ |
| B | H+、Mg2+、 、Cl- 、Cl- | BaCl2溶液 | Ba2++  =BaCO3↓ =BaCO3↓ |
| C | Na+、Cu2+、Cl-、 | KOH溶液 | Cu2++2OH-=Cu(OH)2↓ |
| D | Na+、K+、 、Cl- 、Cl- | CH3COOH溶液 |  +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| A.A | B.B | C.C | D.D |
【知识点】 离子方程式的正误判断解读 离子共存
| A.澄清石灰水和硝酸 | B.醋酸和氢氧化钠溶液 |
| C.氢氧化钡和硫酸氢钠溶液 | D.氢氧化镁和盐酸 |
【知识点】 离子反应的发生及书写
| A.Cl- | B.N2 | C. | D.N2和CO2 |
| A.若X、Y均为金属元素,则X的金属性强于Y |
| B.若X、Y均为金属元素,则X的阳离子的氧化性比Y的阳离子的氧化性强 |
| C.若X、Y均为非金属元素,则Y的非金属性比X的强 |
| D.若X、Y均为非金属元素,则最高价氧化物对应水化物的酸性Y强于X |
【知识点】 元素周期律的应用
| A.元素原子的电子层数等于其所在周期的周期序数 |
| B.元素周期表是按相对原子质量逐渐增大的顺序依次排列 |
| C.元素原子的最外层电子数等于其所在族的族序数 |
| D.元素周期表共有18个纵行,8个主族,10个副族 |
| A.原子序数之差为2的两种元素不可能位于同一主族 |
| B.D-核外有36个电子,则元素D位于第四周期第ⅦA族 |
| C.位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 |
| D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |
选项 | A | B | C | D |
物质 | 液氧、空气、Cl2、铜丝 | HCl、H2SO4、H2O、HNO3 | NaCl溶液、盐酸、CuSO4·5H2O | NH3、NaOH、BaSO4固体 |
分类标准 | 单质 | 酸 | 混合物 | 电解质 |
不属于该 类的物质 | 空气 | H2O | 盐酸 | NH3 |
| A.A | B.B | C.C | D.D |
【知识点】 无机物质的分类
 +Fe2++H+=Mn2++Fe3++H2O;下列说法不正确的是
+Fe2++H+=Mn2++Fe3++H2O;下列说法不正确的是A. 是氧化剂,Fe3+是氧化产物 是氧化剂,Fe3+是氧化产物 |
| B.Mn2+的还原性弱于Fe2+ |
| C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4 |
| D.生成1mol水时,转移2.5mol电子 |
| A.Cl2+H2=2HCl |
B.CuO+CO Cu+CO2 Cu+CO2 |
C.3S +6NaOH 2Na2S +Na2SO3 + 3H2O 2Na2S +Na2SO3 + 3H2O |
| D.2Na+2H2O=2NaOH+H2↑ |
【知识点】 氧化还原反应基本概念
| A.CO2、NH3、HCl | B.H2SO4、HNO3、BaCl2 |
| C.H3PO4、H2O、Cu | D.液态KNO3、NaOH溶液、C2H5OH |
【知识点】 非电解质、电解质物质类别判断解读

| A.离子反应 | B.氧化还原反应 | C.置换反应 | D.三者都可以 |
【知识点】 四种基本反应类型与氧化还原反应的关系解读
| A.1∶1 | B.2∶1 | C.1∶2 | D.3∶1 |
| A.Fe(OH)3中铁元素化合价为+3,只有氧化性 |
| B.反应中NaClO是氧化剂,NaCl是氧化产物 |
| C.Na2FeO4具有强氧化性,能消毒杀菌 |
| D.生成1molNa2FeO4,有6mol电子转移 |
【知识点】 氧化还原反应的规律解读 基于氧化还原反应守恒规律的计算解读
二、未知 添加题型下试题
| A.0.05 mol | B.0.075 mol | C.0.15 mol | D.0.2 mol |
三、单选题 添加题型下试题
| A.化合物电离时,生成的阳离子有氢离子的是酸 |
| B.化合物电离时,生成的阴离子有氢氧根离子的是碱 |
| C.化合物电离时,生成金属阳离子和酸根离子的是盐 |
D.NH4Cl电离的电离方程式是:NH4Cl=NH +Cl-,所以NH4Cl不是盐 +Cl-,所以NH4Cl不是盐 |
【知识点】 酸、碱、盐、氧化物的概念及其相互联系解读 电解质的电离
| A.0.10mol/L | B.0.20mol/L | C.0.50mol/L | D.1.00mol/L |
| A.NH4Cl | B.NO | C.N2 | D.NO2 |
【知识点】 氧化还原反应基本概念 氧化还原反应方程式的配平解读
A.Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++SO =BaSO4↓+H2O =BaSO4↓+H2O |
| B.氢氧化铜加到盐酸中:OH-+H+=H2O |
| C.锌和硝酸银溶液反应:Zn+Ag+=Ag+Zn2+ |
| D.FeCl3和NaOH溶液反应:Fe3++3OH-=Fe(OH)3↓ |
【知识点】 离子方程式的正误判断解读
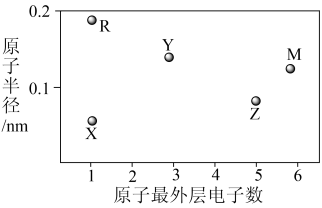
| A.简单离子半径:R>M |
| B.气态氢化物的稳定性:Z<M |
| C.M和Z两种元素可以共存于同一种离子化合物中 |
| D.最高价氧化物对应水化物的碱性:Y>R |
| A.共价化合物含共价键,也可能含离子键 |
| B.酸性:H2CO3<H2SO3,故非金属性:C<S |
| C.由分子组成的化合物中一定存在共价键 |
| D.由非金属元素组成的化合物一定是共价化合物 |
| A.通过物理变化使铁制品表面生成致密的氧化膜,可以防止生锈 |
| B.常见的合金钢主要有硅钢、锰钢、钨钢和不锈钢 |
| C.氧化物只能作氧化剂,不能作还原剂 |
| D.生铁中的球墨铸铁,没有机械强度,所以在什么场合都不可以代替钢 |
选项 | 事实 | 推测 |
A | CaCO3 和 BaCO3 都难溶于水 | SrCO3 也难溶于水 |
B | Si 是半导体材料,同族的 Ge 也是半导体材料 | 第ⅣA 族的元素的单质都可作半导体材料 |
C | HCl 在 1 500℃时分解,HI 在 230℃时分解 | HBr 的分解温度介于二者之间 |
D | Si 与 H2 高温时反应,S 与 H2 加热能反应 | P 与H2 在高温时能反应 |
| A.A | B.B | C.C | D.D |
| A.从左到右原子半径逐渐减小 |
| B.从左到右非金属性逐渐增强 |
| C.从左到右金属元素的最高价氧化物的水化物的碱性逐渐减弱 |
| D.从左到右非金属元素的氧化物的水化物的酸性逐渐增强 |
| A.K层 | B.L层 | C.M层 | D.N层 |
【知识点】 基态核外电子排布规律
| A.118号Og的同族的上一周期元素的原子序数为86 |
| B.117号Ts的最低化合价为-1 |
| C.115号Mc在周期表的第7周期VB族 |
| D.113号Nh的最外层电子数为3 |
四、计算题 添加题型下试题
(1)反应中消耗HCl的物质的量为
(2)该混合物中铝,铁的物质的量分别为
【知识点】 化学方程式中物质的量的运用解读 物质的量浓度的基础计算解读 铝 铁
五、填空题 添加题型下试题
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)氧化性强弱顺序为
(2)反应①中氧化产物和还原产物的质量之比为
(3)反应②中浓盐酸表现出的性质是
A.还原性 B.酸性 C.氧化性
六、解答题 添加题型下试题
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
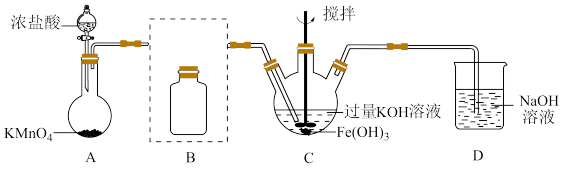
①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案: Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
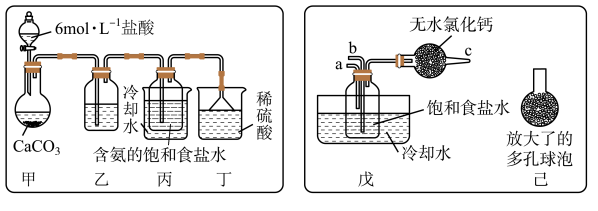
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
七、单选题 添加题型下试题
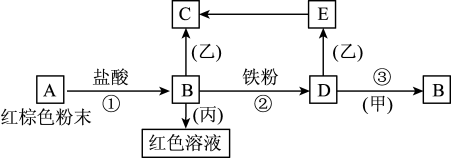
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:
A
(2)写出E→C反应的化学方程式:
【知识点】 无机综合推断 与“铁三角”有关的推断解读
试卷分析
试卷题型(共 35题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 过氧化钠 过氧化钠与水的反应 过氧化钠和二氧化碳反应 | |
| 2 | 0.85 | 元素周期律的应用 核外电子运动 基态核外电子排布规律 | |
| 3 | 0.85 | 同主族元素性质递变规律 元素周期律的应用 同主族元素性质递变规律理解及应用 | |
| 4 | 0.94 | 钠的化学性质 铝与氧气的反应 铁 | |
| 5 | 0.65 | 离子方程式的正误判断 离子共存 | |
| 6 | 0.85 | 离子反应的发生及书写 | |
| 7 | 0.65 | 氧化还原反应的几组概念 常见氧化剂与还原剂 氧化还原反应的规律 | |
| 8 | 0.85 | 元素周期律的应用 | |
| 9 | 0.85 | 元素周期表结构 元素周期表结构分析 | |
| 10 | 0.65 | 元素周期律、元素周期表的推断 元素周期表结构分析 同周期元素性质递变规律 “位构性”关系理解及应用 | |
| 11 | 0.85 | 无机物质的分类 | |
| 12 | 0.65 | 氧化还原反应的几组概念 氧化性、还原性强弱的比较 氧化还原反应有关计算 氧化还原反应方程式的配平 | |
| 13 | 0.65 | 氧化还原反应基本概念 | |
| 14 | 0.85 | 非电解质、电解质物质类别判断 | |
| 15 | 0.85 | 四种基本反应类型与氧化还原反应的关系 | |
| 16 | 0.65 | 氧化还原反应的几组概念 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 | |
| 17 | 0.65 | 氧化还原反应的规律 基于氧化还原反应守恒规律的计算 | |
| 19 | 0.85 | 酸、碱、盐、氧化物的概念及其相互联系 电解质的电离 | |
| 20 | 0.85 | 物质的量浓度的计算 化学方程式计算中物质的量的运用 依据物质的量浓度公式的基础计算 | |
| 21 | 0.65 | 氧化还原反应基本概念 氧化还原反应方程式的配平 | |
| 22 | 0.94 | 离子方程式的正误判断 | |
| 23 | 0.65 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 由元素性质的递变规律进行相关推断 根据原子结构进行元素种类推断 | |
| 24 | 0.65 | 元素非金属性强弱的比较方法 化学键与物质类别关系的判断 | |
| 25 | 0.85 | 铁合金 金属材料的性质及利用 金属与合金性能比较 常见合金的组成 | |
| 26 | 0.65 | 元素周期律的应用 同主族元素性质递变规律理解及应用 类比预测在推断中的应用 | |
| 27 | 0.85 | 同周期元素性质递变规律 同周期元素性质递变规律理解及应用 | |
| 28 | 0.94 | 基态核外电子排布规律 | |
| 29 | 0.85 | 碳酸钠 碳酸氢钠 | |
| 30 | 0.65 | 元素周期表结构分析 原子相关微粒的数值与元素性质的关系 | |
| 35 | 0.65 | 无机综合推断 与“铁三角”有关的推断 | |
| 二、未知 | |||
| 18 | 0.85 | 化学方程式计算中物质的量的运用 铁与非氧化性酸的反应 | 未知 |
| 三、计算题 | |||
| 31 | 0.65 | 化学方程式中物质的量的运用 物质的量浓度的基础计算 铝 铁 | |
| 四、填空题 | |||
| 32 | 0.65 | 氧化还原反应的几组概念 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 | |
| 五、解答题 | |||
| 33 | 0.65 | 氯气的实验室制法 物质性质的探究 物质制备的探究 | 实验探究题 |
| 34 | 0.65 | 碳酸氢钠 物质制备的探究 | 实验探究题 |

 固体中少量
固体中少量 的最佳方法是
的最佳方法是


