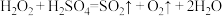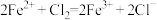鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
全国
高一
单元测试
2020-01-29
210次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础
鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
全国
高一
单元测试
2020-01-29
210次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列反应中,发生电子转移的是( )
①3Cl2+6KOH=5KCl+KClO3+3H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
③SnCl4+2H2O=SnO2+4HCl
④NaOH+HCl=H2O+NaCl
①3Cl2+6KOH=5KCl+KClO3+3H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
③SnCl4+2H2O=SnO2+4HCl
④NaOH+HCl=H2O+NaCl
| A.①② |
| B.②③ |
| C.①③ |
| D.③④ |
您最近一年使用:0次
2020-01-28更新
|
76次组卷
|
5卷引用:贵州省息烽县一中2018-2019学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
2. 在反应3S+6KOH=2K2S+K2SO3+3H2O中,被还原的硫与被氧化的硫的质量比为
| A.2:1 | B.1:2 | C.3:1 | D.1:3 |
【知识点】 氧化还原反应的几组概念解读 氧化还原反应有关计算
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
3. 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
| A.NaOH |
| B.KMnO4 |
| C.KSCN |
| D.铁 |
您最近一年使用:0次
2020-01-28更新
|
139次组卷
|
3卷引用:鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
单选题
|
较易(0.85)
名校
4. 下列离子方程式正确的是( )
| A.氢氧化镁与稀盐酸反应:OH-+H+=H2O |
| B.醋酸溶液与水垢中的碳酸钙反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C.向碳酸氢钠溶液中滴加盐酸:CO32-+2H+=H2O+CO2↑ |
| D.向碳酸钠溶液中加过量盐酸:CO32-+2H+=H2O+CO2↑ |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
您最近一年使用:0次
2018-12-24更新
|
335次组卷
|
10卷引用:云南省巧家县四中2018-2019学年高一上学期12月份考试化学试题
云南省巧家县四中2018-2019学年高一上学期12月份考试化学试题云南省建水县第二中学2019-2020学年高二上学期开学考试化学试题云南省文山州广南一中2019-2020学年高一上学期期中考试化学试题鲁教版高中化学必修1第二章《元素与物质世界》测试卷1云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题山东省济宁市鱼台县第一中学2019-2020学年高一上学期第一次月考(9月)化学试题云南省永胜县第一中学2020-2021学年高一下学期6月份考试化学试题北京海淀教师进修学校2022-2023年高一上学期期中考试化学试题湖北省武汉市黄陂区部分学校 2022-2023学年高一上学期期中考试化学试题黑龙江省哈尔滨市第九中学校2023-2024学年高一上学期9月月考化学试题
5. 氧化铁和氧化铜的固体混合粉末Xg,高温下用足量的一氧化碳还原,得到金属混合物2.4 g,将生成的二氧化碳气体用足量的澄清石灰水吸收后,产生5 g白色沉淀,则X的值为( )
| A.2.45 |
| B.3.20 |
| C.4.00 |
| D.7.40 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
您最近一年使用:0次
2020-01-07更新
|
105次组卷
|
2卷引用:云南省临沧市耿马县民族中学2019-2020学年高一上学期12月月考化学试题
单选题
|
适中(0.65)
7. 被称为万能还原剂的NaBH4溶于水,并和水反应NaBH4+2H2O===NaBO2+4H2↑,下列说法中正确的是(NaBH4中氢元素为-1价)
| A.NaBH4既是氧化剂又是还原剂 | B.NaBH4是还原剂,H2O是氧化剂 |
| C.硼元素被氧化,氢元素被还原 | D.被氧化的元素与被还原的元素的质量比为2∶1 |
【知识点】 氧化还原反应的几组概念解读 氧化还原反应有关计算
您最近一年使用:0次
2020-01-14更新
|
113次组卷
|
5卷引用:2010—2011学年江苏省扬州市安宜高中高一上学期期末考试化学试卷
(已下线)2010—2011学年江苏省扬州市安宜高中高一上学期期末考试化学试卷云南省文山壮族苗族自治州富宁县第二中学2019-2020学年高一上学期期末考试化学试题云南省文山马关实验高级中学2019-2020学年高一期末考试化学试题鲁教版高中化学必修1第二章《元素与物质世界》测试卷1苏教版高中化学必修1专题2《从海水中获得的化学物质》测试卷
单选题
|
适中(0.65)
8. 在100mL含等物质的量HBr和H2SO3的溶液中通入0.01molCl2,有一半Br-变为Br2(已知Cl2既能把H2SO3氧化成H2SO4,又能把Br-氧化成Br2,且Br2能氧化H2SO3),原溶液中HBr和H2SO3的浓度都等于( )
| A.0.0075mol·L-1 | B.0.4mol·L-1 |
| C.0.075mol·L-1 | D.0.08mol·L-1 |
【知识点】 基于氧化还原反应守恒规律的计算解读
您最近一年使用:0次
2019-10-21更新
|
118次组卷
|
3卷引用:云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题
单选题
|
较易(0.85)
名校
9. 下列叙述正确的是( )
| A.固体氯化钠不导电,所以氯化钠不是电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.氯化氢水溶液能导电,所以氯化氢是电解质 |
| D.二氧化碳的水溶液能导电,所以二氧化碳是电解质 |
您最近一年使用:0次
2019-05-18更新
|
260次组卷
|
14卷引用:2015-2016学年浙江省余姚中学高一上10月月考化学试卷
2015-2016学年浙江省余姚中学高一上10月月考化学试卷2015-2016学年辽宁省大连二十中学高一上学期期中测试化学试卷2015-2016学年江苏省盐城市第四中学高一上学期期中考试化学试卷湖南省浏阳二中、五中、六中三校2017-2018学年高一期中联考化学试题浙江省嘉兴市第一中学2017-2018学年高一上学期期中考试化学试题四川外语学院重庆第二外国语学校2017-2018学年高一上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一上学期第二次月考化学试题四川省宜宾县第一中学校2018-2019学年高一上学期12月份考试化学试题步步为赢 初高中衔接教材化学暑假作业:第9课时 电解质、非电解质新疆维吾尔自治区且末县第二中学2018-2019学年高一上学期期末考试化学试题辽宁省六校协作体2019-2020学年高一上学期入学考试化学试题云南省丽江市玉龙纳西族自治县田家炳民族中学高一上学期期中考试化学试题福建省莆田第七中学2019-2020学年高一上学期期中考试化学试题鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
二、未知 添加题型下试题
三、单选题 添加题型下试题
单选题
|
容易(0.94)
解题方法
您最近一年使用:0次
2019-12-03更新
|
301次组卷
|
8卷引用:云南省昭通市盐津县水田新区中学2018-2019学年高一上学期11月份考试化学试题
云南省昭通市盐津县水田新区中学2018-2019学年高一上学期11月份考试化学试题黑龙江省哈尔滨市阿城区龙涤中学校2019-2020学年高一上学期期中考试化学试题鲁教版高中化学必修1第二章《元素与物质世界》测试卷1山西省河津市第二中学2019-2020学年高一上学期12月月考化学试题四川省宜宾市叙州区第二中学校2019-2020学年高一下学期第一次在线月考化学试题安徽省安庆市2019-2020学年高一下学期期末测试化学试卷(已下线)1.1.2 胶体的性质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)黑龙江省哈尔滨市宾县第二中学2020-2021学年高一上学期第一次月化学试题
四、未知 添加题型下试题
五、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
13. 下列叙述正确的是( )
| A.分散质微粒直径介于1~10 nm之间的分散系称为胶体 |
| B.Fe(OH)3胶体是纯净物 |
| C.利用丁达尔现象可以区别溶液与胶体 |
| D.胶体微粒不能透过滤纸 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
14. 下列各组物质中,依次属于单质、酸、盐的一组是( )
| A.干冰、石灰石、氧化钙 |
| B.氧气、硫酸、熟石灰 |
| C.水、烧碱、食盐 |
| D.液氯、硝酸、纯碱 |
您最近一年使用:0次
单选题
|
容易(0.94)
15. 有下列氧化物:①FeO、②Fe2O3、③Fe3O4、④CuO,其中颜色相同的是( )
| A.①②③ | B.①②④ | C.②③④ | D.①③④ |
【知识点】 铁的氧化物 几种铁的氧化物的物理性质及用途解读 氧化铜解读
您最近一年使用:0次
2019-01-04更新
|
529次组卷
|
5卷引用:云南省宜良县一中2018-2019学年高一上学期12月份考试化学试题
六、填空题 添加题型下试题
16. 有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)氧化性强弱顺序为_______ ,还原性强弱顺序为_______ 。
(2)反应①中氧化产物和还原产物的质量之比为_______ 。
(3)反应②中浓盐酸表现出的性质是_______ 。
A.还原性 B.酸性 C.氧化性
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)氧化性强弱顺序为
(2)反应①中氧化产物和还原产物的质量之比为
(3)反应②中浓盐酸表现出的性质是
A.还原性 B.酸性 C.氧化性
您最近一年使用:0次
2021-08-26更新
|
1342次组卷
|
12卷引用:鲁科版(2019)新教材化学同步2.3.2 氧化还原反应的应用 练习
鲁科版(2019)新教材化学同步2.3.2 氧化还原反应的应用 练习山东省滨州市邹平双语学校2019年高一上学期《氧化还原专题》检测鲁教版高中化学必修1第二章《元素与物质世界》测试卷1(已下线)2.3.2 氧化还原反应的应用 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)1.3.2 氧化剂还原剂(精练)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)第2课时 氧化剂和还原剂(课中)——课前、课中、课后同步专题精编(人教版2019必修第一册)(已下线)衔接点12 氧化剂和还原剂-2022年初升高化学无忧衔接?湖北省十堰市区县普通高中联合体2021-2022学年高一上学期期中联考化学试题黑龙江省海林林业局第一中学2021-2022学年高一上学期第一次月考化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第2课时 氧化剂和还原剂湖南省衡阳市衡阳县第四中学2023-2024学年高一上学期11月期中考试化学试题
填空题
|
适中(0.65)
17. 某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(要求配平)_____ 。
(2)反应中,被还原的物质是____ ,Cr2(SO4)3是___ 剂。
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为______ 。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(要求配平)
(2)反应中,被还原的物质是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为
您最近一年使用:0次
2019-09-30更新
|
376次组卷
|
4卷引用:2012届福建省福州三中高三上学期第三次月考化学试卷
(已下线)2012届福建省福州三中高三上学期第三次月考化学试卷第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)鲁教版高中化学必修1第二章《元素与物质世界》测试卷1(已下线)第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)
填空题
|
较易(0.85)
解题方法
18. 实验室常用硫酸亚铁晶体配制硫酸亚铁溶液,回答下列问题:
(1)配制时所需的蒸馏水常采用__________ 的方法除去溶解的氧气;
(2)配制的硫酸亚铁溶液防止Fe2+被氧化,需加入的试剂是__________ ;
(3)硫酸亚铁可作治疗______ 的药剂,医疗上防止硫酸亚铁被氧化采取的措施是_____ 。
(1)配制时所需的蒸馏水常采用
(2)配制的硫酸亚铁溶液防止Fe2+被氧化,需加入的试剂是
(3)硫酸亚铁可作治疗
您最近一年使用:0次
七、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
19. 某小组取一定质量的硫酸亚铁固体,利用下图装置进行实验。
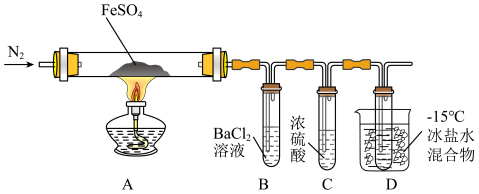
实验过程及现象如下:
①通一段时间氮气后加热,A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体;
②用带火星的木条靠近装置D的导管口,木条复燃;
③充分反应后停止加热,冷却后取A中固体,加盐酸,固体溶解,溶液呈黄色;
④将③所得溶液滴入D试管中,溶液变为浅绿色。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是__________ 。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______ 气体,依据是_________ 。
(3)实验④反应的离子方程式是_________ 。

实验过程及现象如下:
①通一段时间氮气后加热,A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体;
②用带火星的木条靠近装置D的导管口,木条复燃;
③充分反应后停止加热,冷却后取A中固体,加盐酸,固体溶解,溶液呈黄色;
④将③所得溶液滴入D试管中,溶液变为浅绿色。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有
(3)实验④反应的离子方程式是
您最近一年使用:0次
2020-01-28更新
|
45次组卷
|
3卷引用:鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
八、填空题 添加题型下试题
20. 实验室里迅速制备少量氯气可利用如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应不需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是________ ,还原剂是________ 。
(2)当参加反应的氧化剂的物质的量是1mol时,被氧化的还原剂的物质的量是________ ,产生的氯气在标准状况下的体积为________ ,电子转移数目为________ 。
(3)氯化氢在该反应过程中表现出的化学性质有________ 。
A 酸性B 还原性C 氧化性D 挥发性
(1)该反应中,氧化剂是
(2)当参加反应的氧化剂的物质的量是1mol时,被氧化的还原剂的物质的量是
(3)氯化氢在该反应过程中表现出的化学性质有
A 酸性B 还原性C 氧化性D 挥发性
您最近一年使用:0次
2020-01-28更新
|
112次组卷
|
3卷引用:鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
九、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
21. 某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。
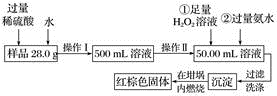
(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有____ (填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________ 。
(3)检验沉淀中 是否洗涤干净的操作是
是否洗涤干净的操作是_______________________________________ 。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________ 。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为__ 。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________ (填“可行”或“不可行”)。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有
(2)反应①中加入足量H2O2溶液,反应的离子方程式:
(3)检验沉淀中
 是否洗涤干净的操作是
是否洗涤干净的操作是(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?
您最近一年使用:0次
2018-05-06更新
|
307次组卷
|
11卷引用:贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题
贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省大关县一中2018-2019学年高一上学期12月考试化学试题云南省武定县一中2018-2019学年高一上学期12月份考试化学试题贵州省从江县民中2018-2019学年高一上学期期末考试化学试题鲁教版高中化学必修1第二章《元素与物质世界》测试卷1云南省巧家县第三中学2019-2020学年高一上学期期末考试化学试题贵州省惠水县第一高级中学2019-2020学年高一上学期期末考试化学试题贵州省黔南布依族苗族自治州龙里中学2019-2020学年高一上学期期末考试化学试题广西河池市都安县第二高级中学2019-2020学年高一上学期期末考试化学试题四川省宜宾市叙州区第二中学校2019-2020学年高一下学期期中考试化学试题河南省许昌市长葛市第一高级中学2019-2020学年高二质量检测化学试题
十、计算题 添加题型下试题
22. 铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s)__________ g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)_____ mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。
计算:
ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度____ (溶液体积变化忽略不计)。
②推算该产品的化学式____ (写出推算过程)。
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s)
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。
计算:
ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度
②推算该产品的化学式
【知识点】 化学方程式计算中物质的量的运用解读 氧化还原反应有关计算
您最近一年使用:0次
2015-07-29更新
|
593次组卷
|
4卷引用:2014-2015学年江西省南昌市第十九中学高二下学期期末化学试卷
计算题
|
适中(0.65)
解题方法
23. 标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________ ?
(2)参加反应的铁的质量是多少________ ?
(3)标况下生成氢气的体积是多少________ ?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________ ?
(1)所得盐酸溶液的物质的量浓度是多少
(2)参加反应的铁的质量是多少
(3)标况下生成氢气的体积是多少
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少
您最近一年使用:0次
2020-01-28更新
|
125次组卷
|
5卷引用:鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
十一、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
24. 稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是____________ ,还原剂是______________ ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为____________ 。
您最近一年使用:0次
2020-01-28更新
|
169次组卷
|
5卷引用:鲁教版高中化学必修1第二章《元素与物质世界》测试卷1
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学实验基础
试卷题型(共 24题)
题型
数量
单选题
13
未知
2
填空题
5
解答题
2
计算题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 氧化还原反应基本概念 单线桥、双线桥分析氧化还原反应 氧化还原反应的应用 氧化还原反应的规律 | |
| 2 | 0.65 | 氧化还原反应的几组概念 氧化还原反应有关计算 | |
| 3 | 0.85 | Fe2+的鉴别及其应用 铁盐的检验 铁盐与亚铁盐鉴别试剂的选择 物质的检验 | |
| 4 | 0.85 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 5 | 0.65 | 化学方程式计算中物质的量的运用 铁及铁的氧化物混合物反应的相关计算 探究物质组成或测量物质的含量 | |
| 6 | 0.85 | 无机物质的分类 分散系概念及其分类 电解质与非电解质 | |
| 7 | 0.65 | 氧化还原反应的几组概念 氧化还原反应有关计算 | |
| 8 | 0.65 | 基于氧化还原反应守恒规律的计算 | |
| 9 | 0.85 | 电解质与非电解质 电解质、非电解质概念 非电解质、电解质物质类别判断 物质水溶液的导电性 | |
| 11 | 0.94 | 胶体的制备 物质的分离、提纯 | |
| 13 | 0.85 | 胶体 胶体的定义及分类 胶体的性质和应用 | |
| 14 | 0.85 | 树状分类法 分类方法的应用 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 | |
| 15 | 0.94 | 铁的氧化物 几种铁的氧化物的物理性质及用途 氧化铜 | |
| 二、未知 | |||
| 10 | 0.65 | 过氧化钠与水的反应 氢氧化亚铁的还原性 | 未知 |
| 12 | 0.85 | 氧化性、还原性强弱的比较 | 未知 |
| 三、填空题 | |||
| 16 | 0.65 | 氧化还原反应的几组概念 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 | |
| 17 | 0.65 | 氧化还原反应有关计算 氧化还原反应方程式的配平 氧化还原反应的规律 | |
| 18 | 0.85 | Fe2+的鉴别及其应用 Fe2+的还原性 亚铁盐溶液的配制与保存 | |
| 20 | 0.65 | 单线桥、双线桥分析氧化还原反应 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律 | |
| 24 | 0.65 | 氧化还原反应的应用 氧化还原反应在生活、生产中的应用 氧化还原反应的规律 与氧化剂、还原剂有关的计算 | |
| 四、解答题 | |||
| 19 | 0.65 | 化学实验探究 化学实验方案的设计与评价 物质性质的探究 物质性质实验方案的设计 | 实验探究题 |
| 21 | 0.65 | 铁的氧化物 亚铁盐 物质含量的测定 综合实验设计与评价 | 实验探究题 |
| 五、计算题 | |||
| 22 | 0.4 | 化学方程式计算中物质的量的运用 氧化还原反应有关计算 | |
| 23 | 0.65 | 物质的量有关计算 物质的量浓度的计算 化学方程式计算中物质的量的运用 物质的量浓度计算-溶液配制有关计算 | |

 、
、 、
、 、
、 和
和 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: ,则下列反应不能发生的是
,则下列反应不能发生的是