浙江省丽水外国语学校高中部2021-2022学年高二下学期第一次阶段性考试(3月)化学试题
浙江
高二
阶段练习
2022-12-28
172次
整体难度:
适中
考查范围:
物质结构与性质、有机化学基础、化学反应原理、认识化学科学
一、单选题 添加题型下试题
| A.3f | B.2d | C.4s | D.2f |
【知识点】 能层与能级
| A.节日里燃放的焰火 | B.钢铁长期使用后生锈 |
| C.金属导线可以导电 | D.卫生球久置后消失 |
【知识点】 核外电子运动
| A.硒元素位于元素周期表中第15列 | B.硒元素原子的价电子排布式为4s24p4 |
| C.硒的氧化物只有一种 | D.基态原子核外电子排布中共有7个能级 |
| A.24Cr 的外围电子排布式:3d44s2 |
B.CO2的立体结构模型 |
C.基态碳原子的价电子排布图为 |
D.N2的电子式: |

A.电负性: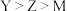 |
B.离子半径: |
C.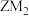 分子中各原子的最外层均满足8电子稳定结构 分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子排布图为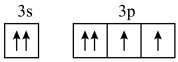 |
【知识点】 元素周期表结构 核外电子排布的表示形式 电负性
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |

| A.分子中每个原子最外层均达到8电子稳定结构 |
| B.P4S3中硫元素为-2价,磷元素为+3价 |
| C.一个P4S3分子中含有三个非极性共价键 |
| D.热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol |
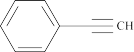
| A.该分子有8个σ键,5个π键 |
| B.该分子中碳原子有sp和sp2杂化 |
| C.该分子存在非极性键 |
| D.该分子中有8个碳原子在同一平面上 |
【知识点】 有机官能团的性质及结构 共价键 共价键的形成及主要类型解读 杂化轨道理论
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于分子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤具有离子键的化合物是离子化合物
| A.②⑤ | B.①③ | C.①④ | D.④⑤ |
【知识点】 不同晶体的结构微粒及微粒间作用的区别解读
A.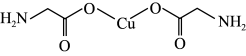 的分子式为CuC4H4N2O4 的分子式为CuC4H4N2O4 |
| B.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
| C.Na、P、Cl的电负性依次增大 |
| D.CH3CH(OH)COOH分子中有手性碳原子 |
| A.CCl4、MgCl2、Si3N4的熔点依次升高 |
| B.Rb、K、Na、Li的沸点依次降低 |
| C.晶体硅、碳化硅、金刚石的熔点依次降低 |
| D.HF、HCl、HBr的沸点依次升高 |

| A.靛蓝由碳、氢、氧、氮四种元素组成 |
| B.它的分子式是C16H10N2O2 |
| C.该物质属于芳香化合物 |
| D.它含有碳碳双键和酯基 |
【知识点】 有机物的结构特点

| A.8∶6∶1 | B.4∶3∶1 | C.1∶6∶1 | D.1∶1∶3 |
【知识点】 根据晶胞结构确定晶体化学式解读 晶胞的有关计算解读

| A.它的一氯代物只有一种 | B.它的二氯代物有两种 |
| C.它的核磁共振氢谱图上只有一组峰 | D.它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |

| A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
| B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质 |
| C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 |
| D.在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键 |
| A.此配合物中存在离子键、配位键、极性键、非极性键 |
| B.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N |
| C.1mol配合物中σ键数目为12NA |
| D.该配合物为离子化合物,易电离,1mol配合物电离共得到3NA阴阳离子 |
【知识点】 物质结构与性质综合考查解读 配合物的结构与性质解读
| 选项 | A | B | C | D |
| 被提纯物质 | 酒精(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
| 除杂试剂 | 生石灰 | 氢氧化 钠溶液 | 酸性高锰 酸钾溶液 | KI溶液 |
| 分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
| A.A | B.B | C.C | D.D |
【知识点】 有机物分离提纯的几种常见操作 有机物蒸馏解读
I1=578kJ·mol—1 I2=1817kJ·mol一1 I3=2745kJ·mol一1
I4=11575kJ·mol一1 I5=14830kJ·mol一1 I6=18376kJ·mol—1。
以下说法正确的是
| A.X原子的最外层只有1个电子 |
| B.元素X常见化合价为+3 |
| C.X原子核外有3个未成对电子 |
| D.元素X最高价氧化物的水合物为强碱 |
| A.键角:BF3>CH4>H2O>NH3 |
| B.CO2、HClO、HCHO分子中一定既有σ键又有π 键 |
| C.已知二茂铁【Fe(C5H5)2】熔点是173℃(在100 ℃时开始升华),沸点是249℃,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,C5H5-与Fe2+之间是以离子键相结合 |
D.在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同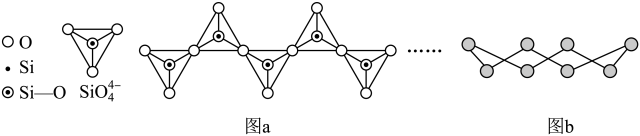 |
 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气 :
: ,下列说法不正确的有
,下列说法不正确的有

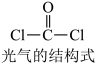
A. 分子为含极性键的非极性分子 分子为含极性键的非极性分子 |
B. 分子中含有3个 分子中含有3个 键、一个 键、一个 键,中心C原子采用 键,中心C原子采用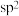 杂化 杂化 |
C. 分子中所有原子的最外层电子都满足8电子稳定结构 分子中所有原子的最外层电子都满足8电子稳定结构 |
| D.使用前可用硝酸银稀溶液检验氯仿是否变质 |
| A.简单离子的半径Y>Z>W |
| B.最高价氧化物对应水化物的酸性W>Z>X |
| C.W和T的单质混合加热可得化合物T2W |
| D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸 |
【知识点】 元素周期律、元素周期表的推断
A.2个甲基,能生成4种一氯代物  | B.4个甲基,能生成1种一氯代物 |
C.3个甲基,能生成5种一氯代物  | D.4个甲基,能生成4种一氯代物 |
二、填空题 添加题型下试题
A.
 B.
B. C.
C.
D.
 E.
E. F.
F.
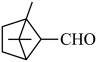
(1)A物质中含有的官能团名称为
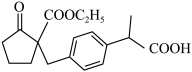
(2)B的分子式为
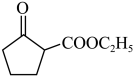
(3)D的一氯代物最多有
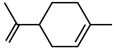
(4)上述化合物中互为同分异构体的是
【知识点】 同系物的判断解读 同分异构体的数目的确定解读
三、解答题 添加题型下试题
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ·mol-1;I2=1451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(2)B元素的电负性
(3)下列关于F原子的价层电子轨道表示式正确的是
A.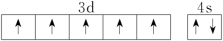 | B.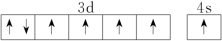 |
C. | D.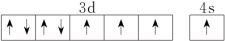 |
(5)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是
(6)B原子核外有
(7)As的卤化物的熔点如表:
| 物质 | AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
(8)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是

(1)E的元素名称为
(2)元素B、C、D第一电离能由大到小的顺序为
(3)BC
 的空间结构为
的空间结构为(4)与同族其他元素X形成的XA3相比,BA3易液化的原因是
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为apm,则晶体的密度为
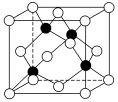
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是

(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 能层与能级 | |
| 2 | 0.85 | 核外电子运动 | |
| 3 | 0.94 | 电子排布式 | |
| 4 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 | |
| 5 | 0.85 | 有机物常见分类 烃、烷烃的概念 | |
| 6 | 0.94 | 核外电子排布规律 电子排布式 轨道表示式 价层电子对互斥理论的应用 | |
| 7 | 0.65 | 元素周期表结构 核外电子排布的表示形式 电负性 | |
| 8 | 0.65 | 同主族元素性质递变规律 元素金属性与非金属性递变规律的理解及应用 | |
| 9 | 0.65 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 共价键概念及判断 | |
| 10 | 0.65 | 有机官能团的性质及结构 共价键 共价键的形成及主要类型 杂化轨道理论 | |
| 11 | 0.65 | 不同晶体的结构微粒及微粒间作用的区别 | |
| 12 | 0.4 | 分子的手性 电离能对物质某些性质的影响 元素性质与电负性的关系 | |
| 13 | 0.65 | 分子的手性 | |
| 14 | 0.65 | ||
| 15 | 0.64 | 有机物的结构特点 | |
| 16 | 0.65 | 根据晶胞结构确定晶体化学式 晶胞的有关计算 | |
| 17 | 0.65 | 有机物的结构式、结构简式、比例模型、球棍模型、最简式 核磁共振氢谱 同分异构现象、同分异构体的概念 同分异构体的数目的确定 | |
| 18 | 0.65 | 分子晶体 原子晶体(旧教材) 常见离子晶体的结构 | |
| 19 | 0.65 | 物质结构与性质综合考查 配合物的结构与性质 | |
| 20 | 0.65 | 有机物分离提纯的几种常见操作 有机物蒸馏 | |
| 21 | 0.85 | 电离能变化规律 | |
| 22 | 0.4 | 利用杂化轨道理论判断化学键杂化类型 配合物的结构与性质 | |
| 23 | 0.65 | 物质结构中化学键数目的计算 利用杂化轨道理论判断化学键杂化类型 极性分子和非极性分子 | |
| 24 | 0.65 | 元素周期律、元素周期表的推断 | |
| 25 | 0.85 | 同分异构体书写 根据要求书写同分异构体 同分异构体的数目的确定 | |
| 二、填空题 | |||
| 26 | 0.65 | 同系物的判断 同分异构体的数目的确定 | |
| 三、解答题 | |||
| 27 | 0.4 | 根据原子结构进行元素种类推断 电子排布式 轨道表示式 元素性质与电负性的关系 | 无机推断题 |
| 28 | 0.4 | “位构性”关系理解及应用 电离能变化规律 利用杂化轨道理论判断分子的空间构型 晶胞的有关计算 | 无机推断题 |
| 29 | 0.65 | 有机物分子式的确定 有机物结构式的确定 质谱图辨认 结合有机物性质推断有机物的结构简式 | 有机推断题 |

 、
、 、
、 同属于环烷烃
同属于环烷烃