河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题
河南
高一
期末
2018-03-24
583次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、常见无机物及其应用
河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题
河南
高一
期末
2018-03-24
583次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
适中(0.64)
名校
1. 如果你家里的食盐不小心混入了大量的泥沙,利用你所学的知识,最简便的分离方法是
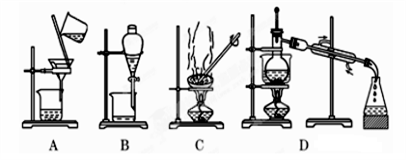

| A.A | B.B | C.C | D.D |
【知识点】 化学实验基础
您最近一年使用:0次
2011-03-26更新
|
167次组卷
|
30卷引用:2011-2012学年辽宁省沈阳四校协作体高一上学期期中联考化学试卷
(已下线)2011-2012学年辽宁省沈阳四校协作体高一上学期期中联考化学试卷(已下线)2012-2013学年云南省滇池中学高一下学期期末考试化学试卷(已下线)2012-2013学年新疆兵团农二师华山中学高一上学期期末考试化学试卷2014-2015辽宁省实验分校高一上学期期末化学(理)试卷2014-2015四川省邛崃市高埂中学高二下学期第一次月考化学试卷2015-2016学年山西省怀仁一中高一上期中考试化学试卷2015-2016学年广东省广州培正中学高一上学期期中测试化学试卷2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷2015-2016学年重庆市第一中学高一上期中测试化学试卷2015-2016学年吉林省实验中学高一上期末文化学试卷2015-2016学年宁夏育才中学高一上期末考试化学试卷2015-2016学年内蒙古巴彦淖尔一中高一上期末化学试卷12016届山西省平遥中学高三第二轮限时训练四化学试卷2016-2017学年甘肃省武威六中高一上第一次学段考试化学卷2016-2017学年安徽马鞍山二中高一10月阶段测化学卷2016-2017学年宁夏育才中学高一上学期期中化学卷2016-2017学年江西省南昌市第十中学高一上学期期末考试化学试卷安徽省淮北市濉溪中学2017-2018学年高二上学期开学考试化学试题河南省张家口市涿鹿中学2017-2018学年高一10月化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高一上学期第一次月考化学试题山东省锦泽技工学校2017-2018学年高一10月月考化学试题甘肃省兰州市第一中学2017-2018学年高一上学期期中考试化学试题四川省乐山沫若中学2017-2018学年高一上学期第二次月考(12月)化学试题河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高一上学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高一上学期10月考试化学试题四川省宜宾市南溪区第二中学2018-2019学年高一上学期9月月考化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高一上学期期中考试化学试题陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题甘肃省嘉峪关市一中2017-2018学年高一上学期期中考试化学试题
单选题
|
适中(0.64)
名校
2. 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.在常温常压下,1 mol氦气含有的原子数为NA |
| B.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
| C.常温常压下,氧气和臭氧(O3)的混合物32 g中含有NA个氧原子 |
| D.物质的量浓度为1 mol·L-1的K2SO4溶液中,含2 NA个K+ |
【知识点】 化学计量
您最近一年使用:0次
2016-12-09更新
|
212次组卷
|
3卷引用:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷
单选题
|
较易(0.85)
名校
3. 下列叙述正确的是
| A.硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价) 用氧化物形式表示:BaO·CuO·SiO2 |
| B.向氯化铁溶液中加入氢氧化钠溶液来制备Fe(OH)3胶体 |
| C.用丁达尔现象实验可以区分食盐水和淀粉溶液 |
| D.某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 |
您最近一年使用:0次
2018-03-21更新
|
299次组卷
|
5卷引用:河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题
单选题
|
较易(0.85)
名校
您最近一年使用:0次
2018-03-21更新
|
186次组卷
|
2卷引用:河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和“气体密度相等时,下列说法正确的是( )
| A.两种气体的压强相等 | B.O2比O3质量小 |
| C.两种气体的分子数目相等 | D.两种气体的氧原子数目相等 |
您最近一年使用:0次
2020-11-09更新
|
2060次组卷
|
97卷引用:2010届湖北省黄冈中学高三11月月考化学测试卷
(已下线)2010届湖北省黄冈中学高三11月月考化学测试卷(已下线)2012届浙江省杭州市西湖高级中学高三上学期开学考试化学试卷(已下线)2012届浙江省衢州高级中学高三上学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳四校协作体高一上学期期中联考化学试卷(已下线)2011-2012学年江西省高安中学高一上学期期中考试化学试卷(已下线)2012届陕西省西安市第一中学高三上学期期中考试化学试卷(已下线)2011-2012学年广西桂林中学高一下学期期中考试化学试卷(已下线)2012-2013学年河南省扶沟县高级中学高一第三次考试化学试卷(已下线)2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷(已下线)2013届上海市青浦区高三上学期期末教学质量调研化学试卷(已下线)2014高考名师推荐化学气体摩尔体积(已下线)2014高考名师推荐化学Vm与它的推论应用(已下线)2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(已下线)2014-2015学年湖北省黄冈中学高一上学期期中化学试卷(已下线)2015届陕西省西安一中高三上学期第二次模考试化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年湖北武汉华中师大一附中高一上期中化学卷2015-2016学年浙江嘉兴一中高一上10月阶段测化学卷 2015-2016学年湖北省荆州中学高一上学期期末化学试卷2015-2016学年湖南省常德一中高一上学期期末化学试卷2015-2016学年安徽省合肥一中等三校高一上期末化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2016-2017学年甘肃省天水一中高一上第一次月考化学试卷2016-2017学年浙江省嘉兴一中高一上期中化学试卷2016-2017学年河北省武邑中学高一上期中化学卷2016-2017学年四川省绵阳南山中学高一上期中化学卷2016-2017学年河南省南阳市高一上学期期中化学试卷2016-2017学年湖南省株洲长鸿实验学校等三校高一12月联考化学卷广西钦州市钦州港经济技术开发区中学2017-2018学年高二上学期开学考试化学试题2017-2018学年高一人教版必修一:5 气体摩尔体积课时训练化学试题河南省南阳市七校2017-2018学年高一上学期第一次联考化学试题山东省寿光现代中学2017-2018学年高一10月月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一9月月考化学试题河北省邢台三中2017-2018学年高一9月月考化学试 卷宁夏银川九中2017-2018学年高一上学期期中考试化学试题甘肃省兰州第一中学2017-2018学年高一上学期期末考试化学试题甘肃省兰州一中2017-2018学年高一上学期期末考试化学试题河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题(已下线)第12天 阿伏加德罗定律——《每日一题·2018快乐暑假》高一化学山东省菏泽市第一中学老校区2018-2019学年高一上学期10月月考化学试题江西省奉新县第一中学2018-2019学年高一上学期第一次月考化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高一上学期期中化学试题【全国百强校】福建省师范大学附属中学2019届高三上学期期中考试化学试题(已下线)2018年12月21日 《每日一题》人教必修1-阿伏加德罗定律及其应用百所名校联考-从实验学化学甘肃省武威第一中学2019-2020学年高一10月月考化学试题云南省鲁甸县一中2019-2020学年高一10月月考化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题福建省漳州市华安一中、龙海二中2020届高三上学期第一次联考化学试题青海省海东市第二中学2019-2020学年高一上学期期中考试化学试题内蒙古翁牛特旗乌丹第一中学2019-2020学年高一上学期期中考试化学试题吉林省长春市九台区第四中学2019-2020学年高一上学期第一次月考化学试题浙江省浙东北联盟(ZDB)2019-2020学年高一上学期期中考试化学试题福建省莆田第七中学2020届高三上学期期中复习检测化学试题2广东省梅州市兴宁一中2019-2020学年高一上学期期中考试化学试题人教版高中化学必修1第一章《从实验学化学》测试卷2广西田林县高级中学2019-2020学年高一上学期期末考试化学试题(已下线)上海市青浦区2013年高考一模(即期末)化学试题(已下线)1.2.2 气体摩尔体积 练习(1)——《高中新教材同步备课》(苏教版 必修第一册)海南省琼海市嘉积中学2019-2020学年高一上学期段考(期中)化学试题(已下线)1.2.2气体摩尔体积(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)2.3.2 气体摩尔体积-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)人教版(2019)高一必修第一册 第二章 海水中的重要元素 第三节 物质的量河南省淮阳县陈州高级中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】7(已下线)2.3.2 气体摩尔体积(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)云南省保山市第九中学2021届高三上学期阶段测试化学试题安徽省蚌埠第三中学2020-2021学年高一上学期第一次月考化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高一上学期第三次月考化学试题浙江省温州中学2020-2021学年高一上学期期中考试化学试题新疆北屯高级中学2020-2021学年高一上学期10月月考化学试题广东省梅州市2020-2021学年高一上学期期末考试化学试题云南省保山市第九中学2021届高三上学期期中考试化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题(已下线)第01讲 物质的量 气体摩尔体积(精讲)-2022年一轮复习讲练测(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)上海市青浦高级中学2019年TI数理实验班选拔测试化学试题(已下线)第01讲 物质的量 气体摩尔体积(练) — 2022年高考化学一轮复习讲练测(新教材新高考)四川省南充市白塔中学2021-2022学年高一上学期第一次月考化学试题山西省晋中市新一双语学校2021-2022学年高三上学期8月月考化学试题上海市曹杨第二中学2021-2022学年高一上学期期中考试化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)安徽省皖北县中联盟2021-2022学年高一上学期12月联考化学试题湖北省十堰市2016-2017学年高一上学期期末调研考试化学试题黑龙江省大庆外国语学校2021-2022学年高一上学期期中考试化学试题湖南省临澧县第一中学2021-2022学年高一下学期第三次阶段性考试化学试题黑龙江省大庆外国语学校2020-2021学年高二下学期第二次月考化学试题上海市第三女子中学2022-2023学年高一上学期阶段测试化学试题山东省青岛第二中学2021-2022学年高一上学期期中考试化学试题上海市行知中学2022-2023学年高一上学期期中考试化学试题上海市徐汇区西南位育中学2022-2023学年高一上学期10月月考化学试题(已下线)化学(上海B卷)-学易金卷:2023年高考第一次模拟考试卷浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题(已下线)第04讲 气体摩尔体积-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)天津市实验中学滨海学校2022-2023学年高一上学期期中质量调查化学试题浙江省绍兴市第一中学2023-2024学年高一上学期11月期中考试(平行班)化学试题
单选题
|
适中(0.65)
名校
6. 下列根据实验操作和现象所得出的结论不正确的是
| 实验操作 | 实验现象 | 结论 | |
| A | 向硅酸钠溶液中滴加1滴酚酞,再逐滴加入稀盐酸至红色褪去 | 试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| C | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 向某无色溶液中先滴加氯水,再加少量CCl4,振荡,静置 | 溶液分层,下层为橙红色 | 溶液中含有Br- |
| A.A | B.B | C.C | D.D |
【知识点】 铝与氧气的反应解读 Fe2+的鉴别及其应用解读
您最近一年使用:0次
2015-04-28更新
|
502次组卷
|
4卷引用:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷
单选题
|
较难(0.4)
名校
7. 下列离子方程式书写不正确的是
A.Cu在加热时溶于过量浓硫酸:Cu+4H++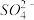  Cu2++SO2↑+2H2O Cu2++SO2↑+2H2O |
| B.Na2O2与H2O反应制备O2:2Na2O2+2H2O=4Na++4OH-+O2↑ |
C.向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++4OH-+2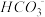 =Mg(OH)2↓+2H2O+2 =Mg(OH)2↓+2H2O+2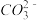 |
| D.向FeI2溶液中加入过量溴水:2Fe2++4I-+3Br2=2Fe3++2I2+6Br- |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
8. 在使紫色石蕊试剂变红的溶液中,能大量共存的离子是
| A.Na+、Ba2+、NO3-、SO42- | B.Al3+、Fe3+、I-、SO42- |
| C.K+、Na+、Cl-、HCO3- | D.Mg2+、Fe2+、SO42-、Cl- |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
9. 下列实验目的可以用如图所示装置达到的是
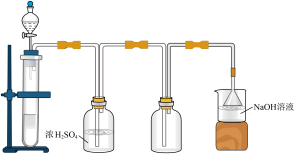

| A.以MnO2、浓盐酸为原料,制备、干燥、收集Cl2 |
| B.以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备、干燥、收集SO2 |
| C.以浓氨水、生石灰为原料,制备、干燥、收集NH3 |
| D.以Cu、稀硝酸为原料,制备、干燥、收集NO |
您最近一年使用:0次
2021-05-29更新
|
1260次组卷
|
33卷引用:河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题
河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题步步为赢 高一化学寒假作业:作业十六 阶段检测(四)天津市静海县第一中学2019-2020学年高一3月学生学业能力调研考试化学试题湖北省鄂东南联盟2019-2020学年高一下学期期中联考化学试题四川省遂宁市2019-2020学年高一下学期期末考试化学试题(已下线)第28讲 物质的制备-2021年高考化学一轮复习名师精讲练(已下线)练习16 生活中的含氮化合物-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)云南省昭通市昭阳区第一中学2019-2020学年高一6月月考化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(一)化学试题天津市实验中学滨海学校2020-2021学年高一下学期期中化学试题云南省梁河县第一中学2020-2021学年高一下学期第一次月考化学试题吉林省辽源市友好学校2020-2021学年高一下学期期末联考化学试题重庆市清华中学2020-2021学年高一下学期第一次月考化学试题(已下线)广西南宁市银海三美学校 2020-2021学年高一下学期5月月考化学试题湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题广东省顶级名校2021-2022学年高二上学期入学考试化学试题广东省东莞市第四高级中学2021-2022学年高三上学期期中考试化学试题河南省信阳市罗山县高级中学2021-2022学年高一下学期3月月考化学试题山东省济宁市兖州区第一中学2021-2022学年高一下学期3月考试化学试题黑龙江省佳木斯市第一中学2021-2022学年高一下学期期末考试化学(理)试题云南省昆明光华学校2021-2022学年高一3月月考化学试题湖南师范大学附属中学2020-2021学年高一下学期入学自主检测化学试卷山东师范大学附属中学 2022-2023 学年高一上学期学科水平自我诊断化学试题陕西省西安市铁一中学2022-2023学年高一下学期期中考试化学试题陕西省西安市大联考2022-2023学年高一下学期4月期中考试化学试题广东省湛江市部分学校20222-2023学年高一下学期期中考试化学试题河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题陕西省西安市蓝田县城关中学玉山中学大学区联考2022-2023学年高一下学期4月期中考试化学试题微专题(九) 气体制备与性质的综合陕西省西安市蓝田县大联考2022-2023学年高一下学期4月期中化学试题云南省开远市第一中学校2022-2023学年高一下学期5月月考化学试题陕西省蓝田县城关中学大学区联考2022-2023学年高一下学期6月期末考试化学试题湖南省长沙市实验中学2022-2023学年高二上学期入学考试化学试题
单选题
|
适中(0.64)
名校
10. R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2016-12-09更新
|
1041次组卷
|
21卷引用:2010年株洲市二中下学期高一年级期中考试化学试题
(已下线)2010年株洲市二中下学期高一年级期中考试化学试题(已下线)2010—2011学年广西南宁沛鸿民族中学高二下学期期中考试化学试卷(已下线)2011-2012学年广西北海市合浦县教育局高一下学期期中化学试卷 2014-2015河南省许昌市四校高一上学期第三次联考化学试卷2015-2016学年湖北省枣阳市高级中学高一上学期期中考试化学试卷2015-2016学年广东省普宁英才华侨中学高一上学期月考化学试卷2017届甘肃省定西市通渭二中高三上学期第一次月考化学试卷甘肃省临夏中学2018届高三上学期期中考试化学试题安徽省淮北市临涣中学2018届高三第二次月考化学试题安徽省蚌埠市第二中学2017-2018学年高一上学期期中考试化学试题湖北省华中师范大学第一附属中学2017-2018学年高一上学期期中考试化学试题安徽省淮南市第二中学2017-2018学年高一上学期第二次月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【押题专练】江苏省东台市创新学校2019届高三上学期9月月考化学试题天津市杨村第一中学2020届高三上学期第一次月考化学试题辽宁省沈阳铁路实验中学2019-2020学年高一10月月考化学试题山西省应县第一中学校2019-2020学年高一上学期第三次月考化学试题黑龙江省大庆市东风中学2019-2020学年高一上学期期末考试化学试题福建省泉州第五中学高中化学必修1【专题练习】氧化还原反应新疆乌鲁木齐八一中学2023-2024学年高一上学期期中考试化学试卷
单选题
|
适中(0.65)
名校
解题方法
11. 下列各组物质中,满足表中图示物质在通常条件下能一步转化的组合只有
| 序号 | X | Y | Z | W |  |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A.①②③ | B.①③④ | C.②③ | D.①②④ |
【知识点】 物质的转化 含硫化合物之间的转化解读
您最近一年使用:0次
2015-07-10更新
|
249次组卷
|
4卷引用:2014-2015浙江省永嘉县楠江中学高二下学期期中考试化学试卷
单选题
|
适中(0.65)
名校
12. 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是
| A.该合金中铜与镁的物质的量之比是1∶2 |
| B.该浓硝酸中HNO3的物质的量浓度是13.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
13. 下列说法或做法正确的是
| A.硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 |
| B.金属钠着火燃烧时,用水灭火 |
| C.铝比铁活泼,所以铝比铁更容易被腐蚀 |
| D.赏心悦目的雕花玻璃是用烧碱对玻璃进行刻蚀而制成的 |
【知识点】 自然界中硅元素的存在解读 二氧化硅的化学性质解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
14. 有Mg、Al、Fe、Cu四种金属,若两两混合,取混合物26g与足量稀硫酸反应产生标准状况下氢气11.2L,则此混合物的可能组合最多有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
您最近一年使用:0次
2020-09-08更新
|
251次组卷
|
15卷引用:2012届安徽省淮北一中高三第三次月考化学试卷
(已下线)2012届安徽省淮北一中高三第三次月考化学试卷(已下线)2012届安徽省无为县大江、开城中学高三上学期联考化学试卷(已下线)2013-2014学年江西省南昌市四校高一上学期期末联考化学试卷2014-2015学年湖南省益阳市箴言中学高一12月月考化学试卷2014-2015河南省许昌市四校高一上学期第三次联考化学试卷2014-2015学年山东省菏泽市单县五中高一上学期实验班考试化学试卷2015-2016学年山西省怀仁一中高一上期中考试化学试卷河南省商丘市第一高级中学2017-2018学年高一上学期第一次月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题吉林省实验中学2019-2020学年高一上学期第二次月考化学试题(已下线)【南昌新东方】南昌三中2019-2020 高一(上)期末人教版(2019)高一必修第一册 第三章 专题3 金属与酸、碱反应的计算高一必修第一册(苏教2019版)专题2 易错疑难集训(二)河北省石家庄市藁城区第一中学2019-2020学年高一上学期第二次月考化学试题江西省抚州市金溪县第一中学2020-2021学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
15. 下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
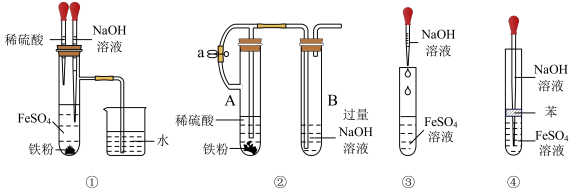
| A.①②④ | B.①②③ | C.①② | D.②③④ |
您最近一年使用:0次
2016-12-09更新
|
346次组卷
|
3卷引用:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷
单选题
|
适中(0.64)
名校
16. 下列有关溶液的说法正确的是
| A.将质量分数为40%(密度为1.43 g·cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% |
| B.要配制浓度为0.25 mol·L-1的NaOH溶液480 mL,应称量4.8 g NaOH在250 mL的烧杯中溶解,冷却,再转移到500 mL容量瓶中,洗涤、转移、定容 |
| C.配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 |
| D.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
2卷引用:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷
单选题
|
较难(0.4)
名校
17. 将一定质量的Mg和Al混合物投入到200 mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法错误的是
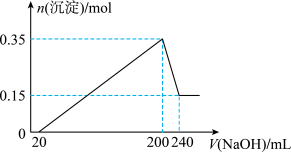

| A.最初20 mL NaOH溶液用于中和过量的稀硫酸 |
B.NaOH溶液物质的量浓度为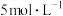 |
| C.Mg和Al的总质量为9g |
| D.生成的氢气在标准状况下的体积为11.2 L |
您最近一年使用:0次
2019-10-12更新
|
699次组卷
|
15卷引用:2012-2013学年天津市天津一中高一上学期期末考试化学试卷
(已下线)2012-2013学年天津市天津一中高一上学期期末考试化学试卷河南省商丘市第一高级中学2017-2018学年高一上学期期末考试化学试题福建省莆田第九中学2017-2018学年高一下学期第一次月考化学试题(已下线)2018年10月11日 《每日一题》人教必修1-铝与氢氧化钠溶液的反应河南省封丘县一中2018-2019学年高一上学期12月月考化学试题(已下线)2019年10月10日 《每日一题》必修1—— 铝与氢氧化钠溶液的反应吉林省油田第十一中学2020届高三上学期第一次阶段考试化学试题2019年陕西省安康市高三第一次调研考试化学试题江西省宜春市靖安中学2019-2020学年高一上学期第二次月考化学试题(已下线)【南昌新东方】2019 莲塘一中 高一上第二次月考江西省会昌中学2020-2021学年高一上学期第二次月考化学试题广西百色市2020-2021学年高一上学期期末教学质量调研测试化学试题 安徽省舒城中学2021-2022学年高一下学期第一次月考化学试题(已下线)铁 金属材料——课时3 金属材料与合金安徽工业大学附属中学2020-2021学年高一下学期(高二文理分科考试)化学试题
单选题
|
适中(0.65)
名校
18. 向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是
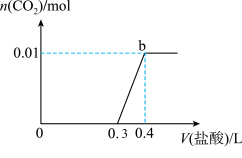

| A.原溶液中溶质为Na2CO3和NaHCO3 |
| B.原溶液中溶质为NaOH和Na2CO3 |
| C.原溶液中溶质为Na2CO3 |
| D.原溶液中溶质为NaHCO3 |
您最近一年使用:0次
2016-12-09更新
|
337次组卷
|
3卷引用:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷
二、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
19. 写出下面反应的离子方程式:
(1)SO2气体通入氯水后,漂白性消失,反应的离子方程式是_____________ .
(2)除去铁粉中混有铝粉的离子方程式为___________________________ 。
(3)向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至Al3+ 恰好完全沉淀,离子方程式___________________
(4)澄清石灰水和少量小苏打反应的离子方程式________________________________________
(1)SO2气体通入氯水后,漂白性消失,反应的离子方程式是
(2)除去铁粉中混有铝粉的离子方程式为
(3)向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至Al3+ 恰好完全沉淀,离子方程式
(4)澄清石灰水和少量小苏打反应的离子方程式
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
名校
解题方法
20. A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
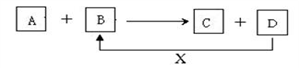
(1)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式_________ ,并写出偏铝酸钠溶液中通入过量二氧化碳的离子方程式________________________
(2)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式__________________ 。

(1)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式
(2)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式
您最近一年使用:0次
四、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
21. 黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2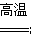 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________ (填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________ mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________ ,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________ 。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为___________________
② 证明炉渣中含有FeO的实验现象为_____________________
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,① 反应中被还原的元素是
② 生成1 mol Fe2O3时转移电子的物质的量为
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为
② 证明炉渣中含有FeO的实验现象为
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
22. 下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
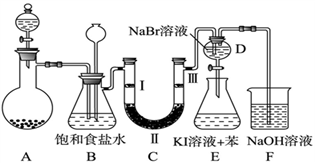
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:______ 。装置B中饱和食盐水的作用是________________ ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______ 。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
23. FeCl2是一种重要的污水处理剂,具有易与水反应、易被氧化的性质。某兴趣小组在实验室中制备无水FeCl2并测定其纯度,设计了如下实验(夹持装置已略去,I中各装置不重复使用)。
Ⅰ.FeCl2的制备
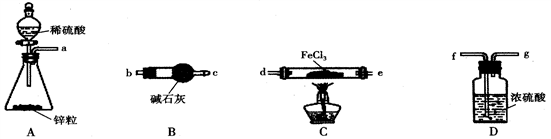
(1)加热条件下,H2与FeCl3制备无水FeCl2的化学方程式为______________________ 。
(2)按气流从左到右的方向,上图中装置合理的连接顺序为_________________ (用仪器接口处的字母表示)。
(3)装置B的作用为____________ 。
(4)反应结束后,应先熄灭C处的酒精灯还是先关闭A处分液漏斗的活塞_______________ (填“熄灭酒精灯”或“关闭活塞”)。
Ⅱ.FeCl2的纯度测定
已知:①实验得到固体的成分为FeCl2和FeCl3。
②Fe3+与K3[Fe(CN)6]不反应,3Fe2++2 [Fe(CN)6]3- Fe3[Fe(CN)6]2↓。
Fe3[Fe(CN)6]2↓。
该兴趣小组设计了如下实验测定得到的FeCl2和FeCl3混合物中FeCl2的纯度。
(i)称取m g反应后的固体溶于过量盐酸中,再将所得溶液加水稀释到200 mL。
(ii)准确量取20 mL上述溶液于烧杯中,加入过量的K3[Fe(CN)6]溶液,有蓝色的Fe3[Fe(CN)6]2沉淀生成。
(iii)过滤、洗涤、干燥后进行称量,得到W g蓝色固体。
(5)产品中FeCl2的质量分数为____________________________ (用含有m和ω的式子表示)。甲同学认为按照上述方案测得的FeCl2的质量分数偏低,他的理由为______________________
Ⅰ.FeCl2的制备

(1)加热条件下,H2与FeCl3制备无水FeCl2的化学方程式为
(2)按气流从左到右的方向,上图中装置合理的连接顺序为
(3)装置B的作用为
(4)反应结束后,应先熄灭C处的酒精灯还是先关闭A处分液漏斗的活塞
Ⅱ.FeCl2的纯度测定
已知:①实验得到固体的成分为FeCl2和FeCl3。
②Fe3+与K3[Fe(CN)6]不反应,3Fe2++2 [Fe(CN)6]3-
 Fe3[Fe(CN)6]2↓。
Fe3[Fe(CN)6]2↓。该兴趣小组设计了如下实验测定得到的FeCl2和FeCl3混合物中FeCl2的纯度。
(i)称取m g反应后的固体溶于过量盐酸中,再将所得溶液加水稀释到200 mL。
(ii)准确量取20 mL上述溶液于烧杯中,加入过量的K3[Fe(CN)6]溶液,有蓝色的Fe3[Fe(CN)6]2沉淀生成。
(iii)过滤、洗涤、干燥后进行称量,得到W g蓝色固体。
(5)产品中FeCl2的质量分数为
【知识点】 探究物质组成或测量物质的含量解读
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学实验基础、认识化学科学、常见无机物及其应用
试卷题型(共 23题)
题型
数量
单选题
18
填空题
2
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 化学实验基础 | |
| 2 | 0.64 | 化学计量 | |
| 3 | 0.85 | 胶体的性质和应用 胶体的制备 硅酸盐组成的表示方法 焰色试验 | |
| 4 | 0.85 | 氯水的性质 二氧化硫的漂白性 过氧化钠的强氧化性 | |
| 5 | 0.65 | 阿伏加德罗定律及其推论 根据n=m/M进行相关计算 以N=m·NA/M为中心的有关基本粒子的推算 | |
| 6 | 0.65 | 铝与氧气的反应 Fe2+的鉴别及其应用 | |
| 7 | 0.4 | 离子方程式的正误判断 | |
| 8 | 0.85 | 限定条件下的离子共存 | |
| 9 | 0.65 | 氯气的实验室制法 氨气的实验室制法 一氧化氮 二氧化硫的制备 | |
| 10 | 0.64 | 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 基于氧化还原反应守恒规律的计算 | |
| 11 | 0.65 | 物质的转化 含硫化合物之间的转化 | |
| 12 | 0.65 | 硝酸的强氧化性 | |
| 13 | 0.85 | 自然界中硅元素的存在 二氧化硅的化学性质 | |
| 14 | 0.65 | 化学方程式计算中物质的量的运用 铝与酸溶液反应 铁与非氧化性酸的反应 | |
| 15 | 0.65 | 氢氧化亚铁的制备 氢氧化亚铁的还原性 化学实验方案的设计与评价 | |
| 16 | 0.64 | 化学计量 仪器使用与实验安全 | |
| 17 | 0.4 | 物质的量有关计算 化学方程式计算中物质的量的运用 镁 铝盐与强碱溶液反应 | |
| 18 | 0.65 | 物质的量有关计算 依据物质的量浓度公式的基础计算 碳酸钠与盐酸的反应 氢氧化钠、碳酸钠混合溶液与盐酸反应相关考查 | |
| 二、填空题 | |||
| 19 | 0.85 | 离子方程式的书写 | |
| 21 | 0.65 | 氧化还原反应的几组概念 与氧化剂、还原剂有关的计算 Fe2+的鉴别及其应用 | |
| 三、解答题 | |||
| 20 | 0.65 | 离子方程式的书写 氢氧化铝与强碱反应 偏铝酸钠与二氧化碳的反应 印刷电路板 | 无机推断题 |
| 22 | 0.65 | 氯气的制法 氯气的化学性质 | 实验探究题 |
| 23 | 0.65 | 探究物质组成或测量物质的含量 | 实验探究题 |



