陕西省西安市远东第一中学2018-2019学年高二上学期期中考试化学试题
陕西
高二
期中
2018-11-15
369次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学
一、单选题 添加题型下试题
| A.增大反应物浓度 | B.加压 | C.升温 | D.加催化剂 |
【知识点】 影响化学反应速率的因素
| A.化学反应速率发生了改变 |
| B.有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C.可逆反应达到平衡,使用了催化剂 |
| D.由于某一条件的改变,使正、逆反应速率不再相等 |
【知识点】 化学平衡的移动及其影响因素
 N2(g)+4CO2(g),在不同条件下的化学反应速率最快的是
N2(g)+4CO2(g),在不同条件下的化学反应速率最快的是| A.v(CO)=1.5mol•L-1•min-1 | B.v(NO2)=0.7mol•L-1•min-1 |
| C.v(N2)=0.4mol•L-1•s-1 | D.v(CO2)=1.1mol•L-1•min-1 |
【知识点】 化学反应的速率 化学反应速率与化学计量数之间的关系解读
| A.等质量的O2比O3的能量低,由O2变为O3是吸热反应 |
| B.等质量的O2比O3的能量高,由O2变为O3是放热反应 |
| C.O3比O2稳定,由O2变为O3是吸热反应 |
| D.O2比O3稳定,由O2变为O3是放热反应 |
| A.CH3OH(l)+3/2O2(g)==CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1451.6 kJ/mol |
| C.CH3OH(l)+3/2O2(g)==CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol |
| D.2CH3OH(g)+3O2(g)==2CO2(g)+4H2O(l) ΔH=-1451.6 kJ |
【知识点】 表示燃烧热的热化学方程式书写解读
| A.1mol固体S单质燃烧放出的热量大于293.23kJ |
| B.1mol气体S单质燃烧放出的热量小于293.23kJ |
| C.1molSO2(g)的键能总和大于1molS(l)和1molO2(g)的键能之和 |
| D.1molSO2(g)的键能总和小于1molS(l)和1molO2(g)的键能之和 |
【知识点】 化学键与化学反应中的能量关系解读 吸热反应和放热反应解读
| A.25% | B.80% | C.10% | D.20% |
【知识点】 转化率的相关计算及判断解读

| A.反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B.反应物的分子的每次碰撞都能发生化学反应 |
| C.活化分子具有比普通分子更高的能量 |
| D.活化能是活化分子的能量与分子平均能量之差,如图所示正反应的活化能为E-E1 |
【知识点】 活化能及其对反应速率的影响解读
 nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则| A.平衡向逆反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.m 小于n |
【知识点】 压强对化学平衡移动的影响解读
 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
【知识点】 影响化学反应速率的外因
| A.NaHCO3=Na++H+ +CO32- | B.NaHSO4=Na+ +H+ +SO42- |
| C.MgCl2=Mg2++2Cl- | D.Ba(OH)2=Ba2+ +2OH- |
| A.1mol/L的醋酸溶液中H+浓度约为10-3mol/L |
| B.醋酸能与水以任意比互溶 |
| C.10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 |
| D.醋酸是共价化合物 |
【知识点】 强电解质和弱电解质的判断
①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)
| A.①② | B.②③ | C.③④ | D.②④ |
【知识点】 浓度对化学反应速率的影响解读
 NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是| A.温度、容积不变时,通入HCl气体 | B.分离出一部分NH3 |
| C.容器体积不变,充入氮气 | D.保持压强不变,充入氮气 |
 ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是
ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 | A.温度不变,缩小体积,ClF的转化率增大 |
| B.温度不变,增大体积,ClF3产率提高 |
| C.升高温度,增大体积,有利于平衡向正反应方向移动 |
| D.降低温度,体积不变,F2转化率降低 |
二、未知 添加题型下试题
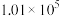 Pa时,
Pa时,
 ,该反应能自发进行的原因是
,该反应能自发进行的原因是| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于焓效应 |
【知识点】 反应进行方向判据的应用解读
三、单选题 添加题型下试题
 PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是| A.M>N | B.M=N | C.M<N | D.无法比较 |
【知识点】 化学平衡的移动解读 等效平衡理论的综合应用解读
 3C(g)+D(g),若反应开始时充入2 mol A和1 mol B,达到平衡时C的浓度为 a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是
3C(g)+D(g),若反应开始时充入2 mol A和1 mol B,达到平衡时C的浓度为 a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是| A.4 mol A+2 mol B | B.2 mol A+1 mol B+3 mol C+1 mol D |
| C.3 mol C+1 mol D+1 mol B | D.3 mol C+1 mol D |

| A.反应达平衡时,正反应速率和逆反应速率相等 |
| B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ |
| C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ |
| D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等 |
【知识点】 化学平衡的移动及其影响因素 化学平衡图像分析 化学平衡建立的过程解读
 C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是
C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是
| A.A、B、C、D都是气体 |
| B.C、D都是气体,A、B中有一种是气体 |
| C.A、B都不是气体,C、D中有一种是气体 |
| D.A、B都是气体,C、D中有一种是气体 |
【知识点】 化学平衡
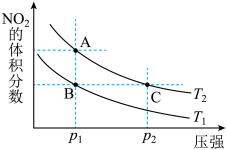
| A.A、C两点的反应速率:A>C |
| B.A、C两点气体的颜色:A深,C浅 |
| C.由状态B到状态A,可以用加热的方法 |
| D.若p2>p1,则化学平衡常数KA>KC |
| A.该反应是熵增大的反应 |
| B.该反应不能自发进行,因此需要合适的催化剂 |
| C.该反应常温下能自发进行,催化剂条件只是加快反应的速率 |
| D.该反应常温下能自发进行,因为正反应是吸热反应 |
【知识点】 化学反应进行方向的判据
CO(g)+H2S(g)
 COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
 ;
; 若起始时E浓度为a
若起始时E浓度为a  ,F、G浓度均为0,达平衡时E浓度为 0.5a
,F、G浓度均为0,达平衡时E浓度为 0.5a ;若E的起始浓度改为 2a
;若E的起始浓度改为 2a  ,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是| A.升高温度时,正反应速率加快、逆反应速率减慢 |
B.若 ,容器体积保持不变,新平衡下E的体积分数为 ,容器体积保持不变,新平衡下E的体积分数为 |
C.若 ,容器体积保持不变,新平衡下F的平衡浓度小于 ,容器体积保持不变,新平衡下F的平衡浓度小于  |
D.若 ,容器压强保持不变,新平衡下E的物质的量为a mol ,容器压强保持不变,新平衡下E的物质的量为a mol |
【知识点】 化学平衡的移动及其影响因素 等效平衡理论的综合应用解读
四、填空题 添加题型下试题
请回答下列问题(填序号):
(1)以上物质能导电的是
(2)以上物质属于电解质的是
(3)以上物质中属于弱电解质的是
【知识点】 热化学方程式书写及正误判断解读 中和热概念解读
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=
【知识点】 化学平衡常数 化学平衡题中基于图表数据的相关计算解读
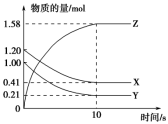
(1)从反应开始到10 s,用Z表示的反应速率为
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示:则下列说法符合该图象的是

A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
【知识点】 化学反应速率的图像解读 化学平衡的移动及其影响因素 化学平衡图像分析
 2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。(1)比较a
(2)若将反应温度升高到700 ℃,该反应的平衡常数将
(3)能说明该反应已经达到平衡状态的是
a.v(C3)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C3气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(1)该反应的化学方程式为
(2)能判断该反应一定达到平衡状态的是
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗nmol H2的同时消耗nmol CO
D.容器中物质的总物质的量不随时间改变
(3)该反应的v(正)随时间变化的关系如图,在t2min时改变了某种条件,改变的条件可能是
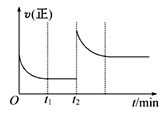
【知识点】 化学平衡状态 化学反应速率与化学平衡的综合应用解读
 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。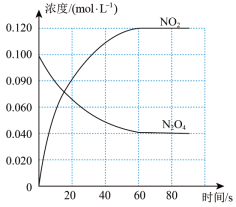
回答下列问题:
(1)反应的△H
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向
试卷分析
试卷题型(共 31题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 影响化学反应速率的因素 | |
| 2 | 0.85 | 化学平衡的移动及其影响因素 | |
| 3 | 0.94 | 化学反应的速率 化学反应速率与化学计量数之间的关系 | |
| 4 | 0.65 | 化学反应热的计算 化学能与物质稳定性之间的关系 吸热反应和放热反应 | |
| 5 | 0.65 | 表示燃烧热的热化学方程式书写 | |
| 6 | 0.65 | 化学键与化学反应中的能量关系 吸热反应和放热反应 | |
| 7 | 0.85 | 转化率的相关计算及判断 | |
| 8 | 0.65 | 活化能及其对反应速率的影响 | |
| 9 | 0.65 | 压强对化学平衡移动的影响 | |
| 10 | 0.65 | 影响化学反应速率的外因 | |
| 11 | 0.65 | 电离的定义 电离方程式 | |
| 12 | 0.85 | 强电解质和弱电解质的判断 | |
| 13 | 0.85 | 浓度对化学反应速率的影响 | |
| 14 | 0.65 | 勒夏特列原理的应用 | |
| 15 | 0.65 | 化学平衡的移动及其影响因素 温度对化学平衡移动的影响 化学平衡常数的概念及表达方式 | |
| 17 | 0.65 | 化学平衡的移动 等效平衡理论的综合应用 | |
| 18 | 0.65 | 等效平衡 等效平衡概念 等效平衡的建立 等效平衡理论的综合应用 | |
| 19 | 0.85 | 化学平衡的移动及其影响因素 化学平衡图像分析 化学平衡建立的过程 | |
| 20 | 0.64 | 化学平衡 | |
| 21 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学平衡常数的影响因素及应用 产物的物质的量与温度、压强的图像关系分析 | |
| 22 | 0.85 | 化学反应进行方向的判据 | |
| 23 | 0.65 | 化学平衡的移动及其影响因素 化学平衡的有关计算 转化率的相关计算及判断 | |
| 24 | 0.65 | 化学平衡的移动及其影响因素 等效平衡理论的综合应用 | |
| 二、未知 | |||
| 16 | 0.65 | 反应进行方向判据的应用 | 未知 |
| 三、填空题 | |||
| 25 | 0.85 | 电解质、非电解质概念 物质水溶液的导电性 强电解质和弱电解质的判断 | |
| 26 | 0.65 | 热化学方程式书写及正误判断 中和热概念 | |
| 27 | 0.65 | 化学平衡常数 化学平衡题中基于图表数据的相关计算 | |
| 28 | 0.65 | 化学反应速率的图像 化学平衡的移动及其影响因素 化学平衡图像分析 | |
| 29 | 0.65 | 热化学方程式含义 化学平衡的移动及其影响因素 化学平衡状态的判断方法 化学平衡常数的影响因素及应用 | |
| 30 | 0.65 | 化学平衡状态 化学反应速率与化学平衡的综合应用 | |
| 31 | 0.65 | 化学平衡的移动及其影响因素 化学平衡常数 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | |



