四川省泸州市泸县第一中学2019-2020学年高一上学期期中考试化学试题
四川
高一
期中
2020-01-11
217次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、常见无机物及其应用、化学反应原理
一、单选题 添加题型下试题
| A.实验剩余的药品不能放回原试剂瓶 |
| B.可燃性气体的验纯 |
| C.气体实验装置在实验前进行气密性检查 |
| D.滴管不能交叉使用 |
| A.硫酸钠溶液能导电,所以它是电解质 | B.电解质在熔融状态下都能导电 |
| C.水溶液能导电的化合物不一定是电解质 | D.难溶物质肯定不是电解质 |
【知识点】 电解质、非电解质概念解读 物质水溶液的导电性解读
| A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B.碳酸镁中滴加稀盐酸:MgCO3+2H+=Mg2++CO2↑+H2O |
| C.向碳酸氢钠溶液中滴加稀盐酸:CO32-+2H+=H2O+CO2↑ |
| D.向碳酸氢钠溶液中加入少量的澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
| A.在某无色透明溶液中:K+、NH4+、Cl-、Fe3+ |
| B.有SO42-存在的溶液中:Mg2+、Br-、Ca2+、Cl- |
| C.在强碱溶液中:NO3-、K+、CO32-、Na+ |
| D.在石蕊试液变红的溶液中:Na+、HCO3-、Cl-、NO3- |
【知识点】 离子反应的发生条件解读 限定条件下的离子共存解读
| A.K+、Cu2+、NO3-、SO42- | B.Na+、Cl-、CO32-、SO42- |
| C.Ca2+、Ba2+、Cl-、NO3- | D.Mg2+、Fe3+、OH-、NO3- |
【知识点】 限定条件下的离子共存解读
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | BaSO4 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | CCl4 | 酒精 | H2O |
| A.A | B.B | C.C | D.D |
【知识点】 电解质与非电解质 强电解质和弱电解质的判断 强电解质与弱电解质解读
| A.2W-+Z2=2Z-+W2 | B.2X-+Z2=2Z-+X2 |
| C.2W-+Y2=2Y-+W2 | D.2Z-+X2=2X-+Z2 |
【知识点】 氧化性、还原性强弱的比较解读 氧化还原反应的应用
| A.将40 g NaOH溶于1 L水所得的溶液 |
| B.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水所得的溶液 |
| C.将31 g Na2O 溶于水并配成1 L的溶液 |
| D.含K+为1mol·L-1的K2SO4溶液 |
【知识点】 物质的量浓度概念、含义解读 物质的量浓度的计算
二、 添加题型下试题
A. L L | B. L L | C.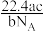 L L | D. L L |
三、单选题 添加题型下试题
| A.Br2+2HI=I2+2HBr |
| B.2FeCl2+Cl2=2FeCl3 |
| C.2FeCl2+2HCl+I2=2FeCl3+2HI |
| D.Cl2通入NaBr和NaI的混合溶液中:I-先被氧化 |
【知识点】 氧化性、还原性强弱的比较解读
| A.4 | B.5 | C.6 | D.7 |
【知识点】 基于氧化还原反应守恒规律的计算解读
 2NO.在某容积恒定的的密闭容器中,充入x mol的N2和ymol的O2,升高温度使二者发生反应。则在反应过程中,与反应前相比,下列物理量发生改变的是
2NO.在某容积恒定的的密闭容器中,充入x mol的N2和ymol的O2,升高温度使二者发生反应。则在反应过程中,与反应前相比,下列物理量发生改变的是| A.气体的分子总数 | B.气体的密度 |
| C.气体的平均相对分子质量 | D.气体产生的压强 |
| A.136: 213 | B.213: 136 | C.3:8 | D.213: 34 |
【知识点】 氧化还原反应基本概念 氧化还原反应的应用
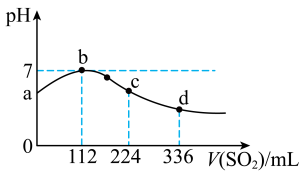
| A.a点对应溶液的导电性比d点强 |
| B.氢硫酸的酸性比亚硫酸的酸性强 |
| C.向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀 |
| D.H2S饱和溶液的物质的量浓度为0.05 mol·L-1 |
【知识点】 二氧化硫 含硫化合物之间的转化解读 硫化氢解读
四、计算题 添加题型下试题
(2)同温同压下,同体积的甲烷和氢气分子数之比为
(3)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、Al2(SO4)3三种溶液中的SO42-都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为
五、解答题 添加题型下试题
(1)实验室里欲用KMnO4固体来配制240mL 0.1 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②配制过程中玻璃棒所起的作用是
③下列操作对实验结果的影响偏小的是
a.加水定容时俯视刻度线 b.容量瓶内壁附有水珠而未干燥处理
c.若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
d. 颠倒摇匀后发现凹液面低于刻度线又加水补上
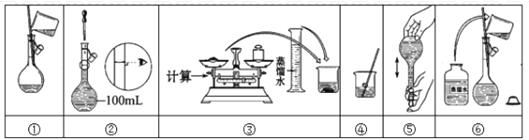
④下列为打乱了的操作示意图,请按先后顺序正确排序
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:
②该反应中的氧化剂是
③若消耗3.16gKMnO4,则该反应转移的电子数目为
(3)已知反应:①Cl2+2KBr=2KCl+Br2,②2KMnO4+16HCl(浓) =2KCl + 2MnCl2+ 5Cl2↑+8H2O,③Br2+K2S=2KBr+S。
①下列说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KMnO4>Cl2>Br2>S
C.反应②中还原剂与氧化剂的物质的量之比为8:1
D.反应③中1mol还原剂被氧化则转移电子的物质的量为2mol
②用单线桥法标出反应②中电子转移的方向和数目

可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的

(2)配制稀硫酸时,除玻璃棒外还缺少的仪器是
(3)经计算,配制95mL1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为
A.10 mL B.50 mL C.100 mL D.200mL
(4)取25 mL1 mol·L-1的硫酸,向其中加入一定量的氧化铜,充分反应后制得硫酸铜溶液。用该溶液制取CuSO4·5H2O,所需要的主要玻璃仪器除酒精灯、玻璃棒外,还缺少的仪器是
(5)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
试卷分析
试卷题型(共 18题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 仪器使用与实验安全 实验安全 | |
| 2 | 0.65 | 电解质、非电解质概念 物质水溶液的导电性 | |
| 3 | 0.65 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 4 | 0.65 | 离子反应的发生条件 限定条件下的离子共存 | |
| 5 | 0.85 | 硫酸根离子的检验 离子的检验 | |
| 6 | 0.85 | 限定条件下的离子共存 | |
| 7 | 0.85 | 电解质与非电解质 强电解质和弱电解质的判断 强电解质与弱电解质 | |
| 8 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的应用 | |
| 9 | 0.65 | 物质的量浓度概念、含义 物质的量浓度的计算 | |
| 11 | 0.85 | 氧化性、还原性强弱的比较 | |
| 12 | 0.65 | 基于氧化还原反应守恒规律的计算 | |
| 13 | 0.65 | 摩尔质量 阿伏加德罗定律 | |
| 14 | 0.65 | 氧化还原反应基本概念 氧化还原反应的应用 | |
| 15 | 0.4 | 二氧化硫 含硫化合物之间的转化 硫化氢 | |
| 二、 | |||
| 10 | 0.94 | 22.4L/mol适用条件 根据n=N/NA的相关计算 根据n=m/M的相关计算 | |
| 三、计算题 | |||
| 16 | 0.65 | 根据n=m/M进行相关计算 以N=m·NA/M为中心的有关基本粒子的推算 化学方程式计算中物质的量的运用 | |
| 四、解答题 | |||
| 17 | 0.65 | 氧化还原反应方程式的配平 基于氧化还原反应守恒规律的计算 配制一定物质的量浓度的溶液实验的仪器 | 实验探究题 |
| 18 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |



