氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)氨气在“氧化炉”中所发生反应的化学方程式为____________ 。
(2)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为________ 。
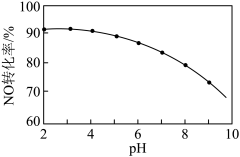
②NaClO溶液氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
I.在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO ,其离子方程式:
,其离子方程式:_________________ 。
II. NaClO溶液的初始pH越小,NO转化率越高。其原因是____________________ 。
(3)国家规定地下水中氮氧化物的排放标准不超过 400 mg∙L-1。氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为:NO+ Fe2+=Fe(NO)2+;NO2+ 3Fe2++ 2H+=2Fe3++ Fe(NO)2++ H2O。现测定某地下水脱硝过程中氮氧化物的排放量:收集500.00 mL排放的气体,缓慢通过250.00 mL 0.6240 mol∙L-1 酸性FeSO4溶液(过量),充分反应,量取吸收气体后的溶液25.00 mL置于锥形瓶中,用0.2000 mol∙L-1 酸性KMnO4溶液反应过量的Fe2+(还原产物为Mn2+),重复上述实验操作3次,平均消耗酸性KMnO4溶液的体积为15.00 mL。试通过计算分析地下水脱硝过程中氮氧化物的排放是否符合国家标准(写出计算过程)__________________________ 。(已知Fe(NO)2+与酸性KMnO4溶液不反应)

(1)氨气在“氧化炉”中所发生反应的化学方程式为
(2)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
②NaClO溶液氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
I.在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO
 ,其离子方程式:
,其离子方程式:II. NaClO溶液的初始pH越小,NO转化率越高。其原因是
(3)国家规定地下水中氮氧化物的排放标准不超过 400 mg∙L-1。氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为:NO+ Fe2+=Fe(NO)2+;NO2+ 3Fe2++ 2H+=2Fe3++ Fe(NO)2++ H2O。现测定某地下水脱硝过程中氮氧化物的排放量:收集500.00 mL排放的气体,缓慢通过250.00 mL 0.6240 mol∙L-1 酸性FeSO4溶液(过量),充分反应,量取吸收气体后的溶液25.00 mL置于锥形瓶中,用0.2000 mol∙L-1 酸性KMnO4溶液反应过量的Fe2+(还原产物为Mn2+),重复上述实验操作3次,平均消耗酸性KMnO4溶液的体积为15.00 mL。试通过计算分析地下水脱硝过程中氮氧化物的排放是否符合国家标准(写出计算过程)
更新时间:2023-03-30 16:23:16
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】写出下列反应的化学方程式,是离子反应的写离子方程式。
(1) 和
和 溶液的反应
溶液的反应_______ ;
(2) 和石灰乳的反应
和石灰乳的反应_______ ;
(3)把 通
通 溶液中
溶液中_______ ;
(4)将 和
和 混合通入
混合通入 中
中_______ ;
(5)将 通入氢硫酸溶液中
通入氢硫酸溶液中_______ ;
(6)将浓盐酸和 混合加热
混合加热_______ ;
(7)电解饱和食盐水_______ ;
(8)将浓盐酸与漂白液混合_______ ;
(9)向 固体滴加浓盐酸
固体滴加浓盐酸_______ ;
(10)向漂白粉溶液中通入少量 气体
气体_______ 。
(1)
 和
和 溶液的反应
溶液的反应(2)
 和石灰乳的反应
和石灰乳的反应(3)把
 通
通 溶液中
溶液中(4)将
 和
和 混合通入
混合通入 中
中(5)将
 通入氢硫酸溶液中
通入氢硫酸溶液中(6)将浓盐酸和
 混合加热
混合加热(7)电解饱和食盐水
(8)将浓盐酸与漂白液混合
(9)向
 固体滴加浓盐酸
固体滴加浓盐酸(10)向漂白粉溶液中通入少量
 气体
气体
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】离子反应与氧化还原反应在生活生产中用途广泛,请按要求完成方程式并配平。
(1)过氧化钠与二氧化碳反应的化学方程式__________________________ 。
(2)烧碱与小苏打溶液反应的化学方程式__________________ 。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式___________ ;如果病人同时患胃溃疡,为防止胃壁穿孔,此时其实最好服用含氢氧化铝的胃药(如胃舒平),写出该反应的离子方程式________________ 。
(4)离子的共存与溶液酸碱性密切相关。如S2-和SO32-在碱性条件下可以共存,但在酸性条件下,因反应生成淡黄色单质沉淀而不能大量共存。请写出S2-和SO32-在酸性环境中发生反应的离子方程式_____________________ 。
(5)高铁酸钠(Na2FeO4)有强氧化性,可以有效杀灭水中的细菌和病毒。已知湿法制备高铁酸钠的反应体系有六种微粒:Fe(OH)3、ClO-、H2O 、OH-、FeO42-、Cl-。写出制备高铁酸钠的离子方程式__________________________ 。
(1)过氧化钠与二氧化碳反应的化学方程式
(2)烧碱与小苏打溶液反应的化学方程式
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式
(4)离子的共存与溶液酸碱性密切相关。如S2-和SO32-在碱性条件下可以共存,但在酸性条件下,因反应生成淡黄色单质沉淀而不能大量共存。请写出S2-和SO32-在酸性环境中发生反应的离子方程式
(5)高铁酸钠(Na2FeO4)有强氧化性,可以有效杀灭水中的细菌和病毒。已知湿法制备高铁酸钠的反应体系有六种微粒:Fe(OH)3、ClO-、H2O 、OH-、FeO42-、Cl-。写出制备高铁酸钠的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO + Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
② MnO + CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是____ (选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S
d.生成2.24 L(标况下) SO2,转移电子的物质的量是0.6mol
(2)标出反应②中电子转移的方向和数目___ : MnO + CuS
+ CuS
Ⅱ.在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-→ 2H++O2↑
还原反应:MnO +5e-+8H+→Mn2++4H2O
+5e-+8H+→Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为_____ 。由上述反应得出的物质氧化性强弱的结论是_______ >_______ (填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是______ mol。
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO
 + Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)② MnO
 + CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S
d.生成2.24 L(标况下) SO2,转移电子的物质的量是0.6mol
(2)标出反应②中电子转移的方向和数目
 + CuS
+ CuSⅡ.在稀硫酸中,MnO
 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应氧化反应:H2O2-2e-→ 2H++O2↑
还原反应:MnO
 +5e-+8H+→Mn2++4H2O
+5e-+8H+→Mn2++4H2O(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为
(4)已知:2KMnO4+7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】《一种协同脱除VOCs和 的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除
的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除 是当前科学家研究的重要课题。
是当前科学家研究的重要课题。
(1) 对环境的一种危害是
对环境的一种危害是___________ 。
(2)碱性 氧化法可将
氧化法可将 进行脱除。
进行脱除。
① (NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整___________ 。
_____NO+_____ _____
_____
 ______
______ ____
____ ____
____
②下列叙述不正确的是___________ 填字时)。
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:
C.在不同酸碱性条件下, 发生氧化还原反应的产物可能不同
发生氧化还原反应的产物可能不同
③在实验室用 (NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为
(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为 ,理论上需要
,理论上需要 的质量为
的质量为___________ g( 靡尔质量为158
靡尔质量为158 )。
)。
(3)用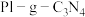 光催化氧化法脱除NO的过程如图所示。
光催化氧化法脱除NO的过程如图所示。

①该脱除过程中,太阳能转化为___________ 能。
②在酸性水溶液中,光催化脱除原理和电化学反应原理类似。 端的反应为
端的反应为
 ,P1端的反应为
,P1端的反应为___________ 。
 的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除
的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除 是当前科学家研究的重要课题。
是当前科学家研究的重要课题。(1)
 对环境的一种危害是
对环境的一种危害是(2)碱性
 氧化法可将
氧化法可将 进行脱除。
进行脱除。①
 (NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整_____NO+_____
 _____
_____
 ______
______ ____
____ ____
____
②下列叙述不正确的是
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:

C.在不同酸碱性条件下,
 发生氧化还原反应的产物可能不同
发生氧化还原反应的产物可能不同③在实验室用
 (NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为
(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为 ,理论上需要
,理论上需要 的质量为
的质量为 靡尔质量为158
靡尔质量为158 )。
)。(3)用
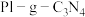 光催化氧化法脱除NO的过程如图所示。
光催化氧化法脱除NO的过程如图所示。
①该脱除过程中,太阳能转化为
②在酸性水溶液中,光催化脱除原理和电化学反应原理类似。
 端的反应为
端的反应为
 ,P1端的反应为
,P1端的反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。如图为“84”消毒液说明书。
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸共热制取氯气,该反应的离子方程式为___________ ,若含有 的浓盐酸与足量
的浓盐酸与足量 固体反应,产生
固体反应,产生 的分子数
的分子数___________  (填大于、等于或小于)。
(填大于、等于或小于)。
(2)若将 通入到热的
通入到热的 溶液中,可以得到
溶液中,可以得到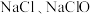 和
和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为
的个数比为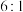 时,混合液中
时,混合液中 和
和 的个数比为
的个数比为___________ 。
(3)家庭用“84”消毒液用法强调,消毒马桶时,洁厕灵(主要成分是盐酸)与“84”消毒液不能混用,若混用会产生黄绿色的有毒气体,其反应的离子方程式为___________ 。
(4)某同学欲用 固体配制
固体配制 溶液,需要用托盘天平称量
溶液,需要用托盘天平称量 固体的质量为
固体的质量为___________ g;若所配得的 溶液在空气中经光照、久置后,溶液中
溶液在空气中经光照、久置后,溶液中 的物质的量浓度将
的物质的量浓度将___________ (填增大、减小或不变)。
 | 药品名称 | 84消毒液 |
| 主要成分 |  ,有效氯含量 ,有效氯含量 | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等 水溶液;餐饮具、瓜果等 水溶液;餐饮具、瓜果等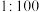 水溶液 水溶液 |
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸共热制取氯气,该反应的离子方程式为
 的浓盐酸与足量
的浓盐酸与足量 固体反应,产生
固体反应,产生 的分子数
的分子数 (填大于、等于或小于)。
(填大于、等于或小于)。(2)若将
 通入到热的
通入到热的 溶液中,可以得到
溶液中,可以得到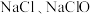 和
和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为
的个数比为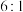 时,混合液中
时,混合液中 和
和 的个数比为
的个数比为(3)家庭用“84”消毒液用法强调,消毒马桶时,洁厕灵(主要成分是盐酸)与“84”消毒液不能混用,若混用会产生黄绿色的有毒气体,其反应的离子方程式为
(4)某同学欲用
 固体配制
固体配制 溶液,需要用托盘天平称量
溶液,需要用托盘天平称量 固体的质量为
固体的质量为 溶液在空气中经光照、久置后,溶液中
溶液在空气中经光照、久置后,溶液中 的物质的量浓度将
的物质的量浓度将
您最近一年使用:0次



