名校
1 . 镁及其化合物的用途很广,大量的镁是从海水中提取的,其中的主要步骤如下:

下列说法错误的是

下列说法错误的是
A.加入试剂①后可以通过过滤得到 沉淀 沉淀 |
B.为使 转化为 转化为 ,试剂①可用石灰乳以降低生产成本 ,试剂①可用石灰乳以降低生产成本 |
C.利用上述海水制取精盐,加入试剂的化学式依次为: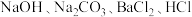 |
D.无水 在熔融状态下电解得到 在熔融状态下电解得到 的反应为: 的反应为: |
您最近一年使用:0次
2 . Ⅰ.硝酸钠在工农业生产中有着广泛的用途。现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
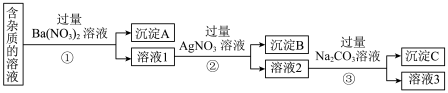
(1)沉淀A的主要成分是______ 、______ (填化学式)。
(2)③中反应的离子方程式是______ 。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是______ ,为了除去杂质,可向溶液3中加入适量的______ 。
Ⅱ.能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(4)下列装置中能够实现化学能转化为电能的是______ (填字母)。
(5)该装置正极材料为______ (填电极的化学式),发生了______ 反应(氧化或还原)。
(6)若装置中转移了0.2mol电子,负极减少的质量是______ 。
(7)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
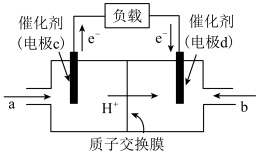
①电极d是______ (填“正极”或“负极”)。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______ L。

(1)沉淀A的主要成分是
(2)③中反应的离子方程式是
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是
Ⅱ.能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(4)下列装置中能够实现化学能转化为电能的是
A.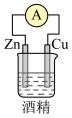 | B.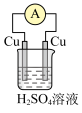 |
C.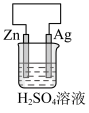 | D.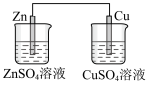 |
(6)若装置中转移了0.2mol电子,负极减少的质量是
(7)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:

①电极d是
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为
您最近一年使用:0次
解题方法
3 . 1,2-二溴乙烷用途广泛,可用作汽油抗震液中铅的消除剂和脂肪、树脂等的溶剂等。实验室用液溴和乙醇制备1,2-二溴乙烷的装置如图所示(加热装置和尾气处理装置省略):
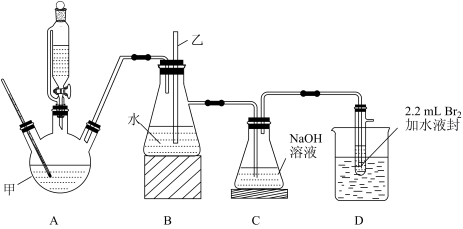
已知:1,2-二溴乙烷的沸点为131.4℃,熔点为9.3℃。液溴的沸点为58.8℃,熔点为-7.2℃。
(1)仪器甲的名称为____ ,装置A中制备乙烯的化学方程式为____ 。
(2)在此制备实验中,要把装置A的温度快速地提高到反应温度,最主要目的是____ (填标号)。
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)仪器乙是玻璃管,装置B的作用为____ 。
(4)如果没有装置C,则装置D中还可能发生反应的化学方程式为____ 。
(5)装置D中烧杯内盛装的是冷水,反应过程中冷水的温度不能过高也不能太低(如冰水混合物的温度)的主要原因是___ 。
(6)若产物中有少量未反应的Br2,最好用____ (填标号)洗涤除去。
a.水 b.Na2SO3溶液 c.碘化钠溶液 d.乙醇
(7)待装置D中颜色褪去,将粗产物依次用质量分数为10%的氢氧化钠溶液和水洗涤分液后,再向有机层中加入适量无水氯化钙,过滤,把滤液转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得列产品3.52g。已知反应前装置D的试管中加入的液溴为2.2mL(约为0.04mol),则该实验所得产品的产率为____ (保留三位有效数字)。

已知:1,2-二溴乙烷的沸点为131.4℃,熔点为9.3℃。液溴的沸点为58.8℃,熔点为-7.2℃。
(1)仪器甲的名称为
(2)在此制备实验中,要把装置A的温度快速地提高到反应温度,最主要目的是
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)仪器乙是玻璃管,装置B的作用为
(4)如果没有装置C,则装置D中还可能发生反应的化学方程式为
(5)装置D中烧杯内盛装的是冷水,反应过程中冷水的温度不能过高也不能太低(如冰水混合物的温度)的主要原因是
(6)若产物中有少量未反应的Br2,最好用
a.水 b.Na2SO3溶液 c.碘化钠溶液 d.乙醇
(7)待装置D中颜色褪去,将粗产物依次用质量分数为10%的氢氧化钠溶液和水洗涤分液后,再向有机层中加入适量无水氯化钙,过滤,把滤液转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得列产品3.52g。已知反应前装置D的试管中加入的液溴为2.2mL(约为0.04mol),则该实验所得产品的产率为
您最近一年使用:0次
名校
解题方法
4 . 氯化钠是自然界中常见的盐,在生产生活中有着广泛的用途。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:_______ 。
②海水晒制的粗盐中还含有泥沙、CaCl2、MgCl2以及可溶的硫酸盐等杂质,可以依次通过溶解、过滤、_________ (选填字母序号;所加试剂均过量)、结晶等一系列流程得到精盐。
a.加入Na2CO3溶液→加入NaOH溶液→加入BaCl2溶液→过滤→加入稀盐酸
b.加入NaOH溶液→加入BaCl2溶液→加入Na2CO3溶液→加入稀盐酸→过滤
c.加入BaCl2溶液→加入Na2CO3溶液→加入NaOH溶液→过滤→加入稀盐酸
③检验精盐中 是否除净的原理是
是否除净的原理是_______ (用离子方程式表示)
(2)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是_______ 。
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:_______ 。

③向一定体积一定物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到含有溶质M和N的溶液,则M和N不可能是_______  填序号
填序号 。
。
a.NaOH和Na2CO3 b. NaOH和NaHCO3 c.Na2CO3和NaHCO3
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:
②海水晒制的粗盐中还含有泥沙、CaCl2、MgCl2以及可溶的硫酸盐等杂质,可以依次通过溶解、过滤、
a.加入Na2CO3溶液→加入NaOH溶液→加入BaCl2溶液→过滤→加入稀盐酸
b.加入NaOH溶液→加入BaCl2溶液→加入Na2CO3溶液→加入稀盐酸→过滤
c.加入BaCl2溶液→加入Na2CO3溶液→加入NaOH溶液→过滤→加入稀盐酸
③检验精盐中
 是否除净的原理是
是否除净的原理是(2)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:

③向一定体积一定物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到含有溶质M和N的溶液,则M和N不可能是
 填序号
填序号 。
。a.NaOH和Na2CO3 b. NaOH和NaHCO3 c.Na2CO3和NaHCO3
您最近一年使用:0次
名校
5 . 钴的化合物用途广泛。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2·6H2O粗品的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:_____________________________ 。
(2)加入NaClO3的作用是______________________________ 。
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液II”中加入萃取剂的主要目的是___________________ ,使用萃取剂时最适宜的pH是_____ (填字母序号)。
A.2.0~2.5 B.3.0~3.5 C5.0~5.5 D.9.5~9.8

(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11 , Ksp(CaF2)=1.05×10-10 。 当加入过量NaF后,所得滤液c (Mg2+)/c (Ca2+)=________ 。
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是___________________________________________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:
(2)加入NaClO3的作用是
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液II”中加入萃取剂的主要目的是
A.2.0~2.5 B.3.0~3.5 C5.0~5.5 D.9.5~9.8

(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11 , Ksp(CaF2)=1.05×10-10 。 当加入过量NaF后,所得滤液c (Mg2+)/c (Ca2+)=
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是
您最近一年使用:0次
6 . 氯化亚铜是用途广泛的铜盐产品。CuCl晶体呈白色,微溶于水,不溶于乙醇和稀盐酸,溶于浓盐酸,见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl晶体,设计如下制备流程:

实验涉及的操作及装置如下:

已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq) [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)
③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是______
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞_____ (填“a”、“b”或“a和b”)。
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为______ 。
③判断反应完成的实验现象是________________ 。
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是___________
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是__________
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)

实验涉及的操作及装置如下:

已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq)
 [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为
③判断反应完成的实验现象是
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)
您最近一年使用:0次
名校
7 . 高铁酸钾(K2Fe04)是一种理想的绿色高效水处理剂。某学习小组用如图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2Fe04。
查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;
②在0-5℃、强碱性溶液中比较稳定;
③在Fe3+和Fe(OH)3催化作用下发生分解;
④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_____ 。
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0-5℃,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是_____ 。
(3)在搅拌条件下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2Fe04,写出该反应的化学方程式_____ ;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是_____ 。
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2Fe04粗产品溶于冷的3mol/LKOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2-3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)_____ 、_____ 。
②晶体用乙醇洗涤的原因是_____ 。

查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;
②在0-5℃、强碱性溶液中比较稳定;
③在Fe3+和Fe(OH)3催化作用下发生分解;
④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0-5℃,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是
(3)在搅拌条件下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2Fe04,写出该反应的化学方程式
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2Fe04粗产品溶于冷的3mol/LKOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2-3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)
②晶体用乙醇洗涤的原因是
您最近一年使用:0次
10-11高二·福建漳州·期末
8 . 下图是工业上从海水中提取Mg的流程,请回答有关问题:
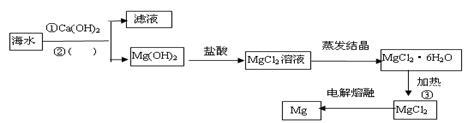
(1)②分离出Mg(OH)2的实验操作名称是______ ;
(2)写出Mg(OH)2与盐酸反应得到MgCl2溶液的离子方程式:_________________ ;
(3)③需要不断充入氯化氢气体,其目的是:________________ ;
(4)镁化合物具有广泛用途,请回答有关镁的下列问题:
①单质镁在空气中燃烧的主要产物是白色的_____ ,还生成少量的_______ (填化学式);
②CH3MgCl是一种重要的有机合成剂,其中镁的化合价是___________ 。

(1)②分离出Mg(OH)2的实验操作名称是
(2)写出Mg(OH)2与盐酸反应得到MgCl2溶液的离子方程式:
(3)③需要不断充入氯化氢气体,其目的是:
(4)镁化合物具有广泛用途,请回答有关镁的下列问题:
①单质镁在空气中燃烧的主要产物是白色的
②CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
您最近一年使用:0次



