名校
解题方法
1 . 高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
 。回答下列问题:
。回答下列问题:
(1)上述反应中的
_______ ,
_______ 。
(2)写出方程式,并用单线桥表示出电子转移方向_______ 。
(3)亚硝酸钠( )是一种工业盐,某化学兴趣小组设计实验探究
)是一种工业盐,某化学兴趣小组设计实验探究 的性质。请完善表格中的实验现象和结论(已知
的性质。请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
 )是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
 。回答下列问题:
。回答下列问题:(1)上述反应中的


(2)写出方程式,并用单线桥表示出电子转移方向
(3)亚硝酸钠(
 )是一种工业盐,某化学兴趣小组设计实验探究
)是一种工业盐,某化学兴趣小组设计实验探究 的性质。请完善表格中的实验现象和结论(已知
的性质。请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| ① | 取5  溶液于试管中,加入少量 溶液于试管中,加入少量 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有 具有 |
| ② | 取2  溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为 溶液,可观察到的实验现象为 |  具有还原性 具有还原性 |
| ③ |  固体与70%硫酸反应生成了 固体与70%硫酸反应生成了 和 和 两种气体 两种气体 |  具有 具有 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
2 . 根据所学知识回答下列问题:
(1)氢化钠(NaH)可在野外作生氢剂,NaH中氢元素显 价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。
价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。
①该反应中体现了H2O的_______ (填“氧化性”、“还原性”或“氧化性和还原性”)。
②用双线桥法表示该反应中电子转移的方向和数目:___________________ 。
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,反应原理为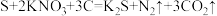 。
。
①该反应中,每生成0.5molN2,消耗S的质量为_______ g。
②氧化剂是_______ (填化学式)。
③若将生成的固体物质溶于水配成溶液,然后通入氯气,发生反应的离子方程式为___________ 。
(3)含重铬酸根离子( )的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为
)的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为 。
。
① 作用为
作用为_______ 。
②氧化性:Fe3+_______ (填“>”、“<”或“=”)  。
。
③该反应中,每生成0.6molFe3+,消耗FeSO4∙7H2O的物质的量为_______ 。
(1)氢化钠(NaH)可在野外作生氢剂,NaH中氢元素显
 价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。
价。NaH用作生氢剂时的化学反应原理为NaH+H2O=NaOH+H2↑。①该反应中体现了H2O的
②用双线桥法表示该反应中电子转移的方向和数目:
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,反应原理为
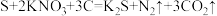 。
。①该反应中,每生成0.5molN2,消耗S的质量为
②氧化剂是
③若将生成的固体物质溶于水配成溶液,然后通入氯气,发生反应的离子方程式为
(3)含重铬酸根离子(
 )的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为
)的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾(FeSO4∙7H2O)作处理剂,发生反应的离子方程式为 。
。①
 作用为
作用为②氧化性:Fe3+
 。
。③该反应中,每生成0.6molFe3+,消耗FeSO4∙7H2O的物质的量为
您最近一年使用:0次
3 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)“维生素C可以将食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有_____ (填“氧化性”或“还原性”)。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:
_____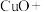 _____
_____
 _____
_____ _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应_____ 。
②该反应中,氧化剂是_____ (填化学式),被氧化的元素是_____ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为
的反应为
①该反应中的还原产物是_____ (写化学式),反应中每生成1个 分子,转移电子的数目为
分子,转移电子的数目为_____ 。
②用双线桥标出反应中电子转移的方向和数目_____ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是_____ (填序号)
A. B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为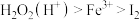 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为_____ 。
(1)“维生素C可以将食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:_____
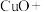 _____
_____
 _____
_____ _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为
的反应为
①该反应中的还原产物是
 分子,转移电子的数目为
分子,转移电子的数目为②用双线桥标出反应中电子转移的方向和数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为
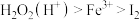 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
2023-07-05更新
|
445次组卷
|
2卷引用:新疆石河子第一中学2023-2024学年高一上学期9月月考化学试题
名校
4 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________ (填字母)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是( )
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________ 。
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是________ (填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________________________________ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为________ mol。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
2020-01-16更新
|
221次组卷
|
3卷引用:新疆哈密市第十五中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
5 . 实验室迅速制备少量氯气可利用如下反应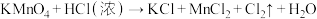 (未配平),此反应常温下就可以迅速进行.请回答下列问题:
(未配平),此反应常温下就可以迅速进行.请回答下列问题:
(1)上述反应中被氧化的元素是_________ ,盐酸在该反应中表现了___________ 性质,当生成6.72L(标准状况下) 时,转移电子的物质的量为
时,转移电子的物质的量为___________ 。
(2)实验室通常利用 与浓盐酸共热反应制得氯气,据此可知
与浓盐酸共热反应制得氯气,据此可知 、
、 、
、 三种物质的氧化性由强到弱的顺序为
三种物质的氧化性由强到弱的顺序为_______________________________ 。
(3)酸性 溶液与
溶液与 反应生成
反应生成 ,该反应的离子方程式是
,该反应的离子方程式是_______________________ 。
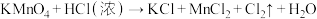 (未配平),此反应常温下就可以迅速进行.请回答下列问题:
(未配平),此反应常温下就可以迅速进行.请回答下列问题:(1)上述反应中被氧化的元素是
 时,转移电子的物质的量为
时,转移电子的物质的量为(2)实验室通常利用
 与浓盐酸共热反应制得氯气,据此可知
与浓盐酸共热反应制得氯气,据此可知 、
、 、
、 三种物质的氧化性由强到弱的顺序为
三种物质的氧化性由强到弱的顺序为(3)酸性
 溶液与
溶液与 反应生成
反应生成 ,该反应的离子方程式是
,该反应的离子方程式是
您最近一年使用:0次
6 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为N2,其化学方程式为:
还原为N2,其化学方程式为: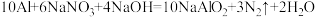 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。
(3)反应中每生成1个N2,转移___________ 个电子。
(4)请配平下列离子方程式___________ 。

(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为: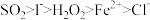 ,则下列反应不能发生的是___________。
,则下列反应不能发生的是___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为N2,其化学方程式为:
还原为N2,其化学方程式为: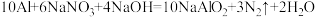 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素
(2)用“双线桥法”表示反应中电子转移的方向和数目:
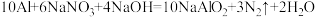
(3)反应中每生成1个N2,转移
(4)请配平下列离子方程式

(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:
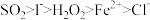 ,则下列反应不能发生的是___________。
,则下列反应不能发生的是___________。A.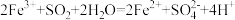 | B.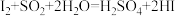 |
C.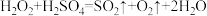 | D.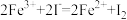 |
您最近一年使用:0次
2022-03-08更新
|
240次组卷
|
4卷引用:新疆乌苏市第一中学2021-2022学年高一下学期开学考试化学(A)试题
名校
7 . 已知H2O2参与的三个化学方程式如下:
①2H2O2=2H2O+O2↑;
②Ag2O+H2O2=2Ag+O2↑+H2O;
③3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O。
(1)已知H2O2是二元弱酸,写出其第一步电离方程式:___________ 。
(2)上述三个反应中,H2O2仅体现还原性的反应是___________ 。
(3)根据上述反应推出H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是___________ 。
(4)H2O2作反应物的某氧化还原反应,反应物和生成物共五种微粒:O2、H2O2、ClO 、H2O、Cl-。
、H2O、Cl-。
①写出上述反应的离子方程式:___________ 。
②如果上述反应中有13.44 L(标准状况)气体生成,转移的电子的物质的量为___________ 。
(5)H2O2可作为消除采矿业胶液中NaCN的试剂,反应的原理为NaCN+H2O2+H2O=A+NH3↑,其中A的化学式为___________ 。
(6)可用KClO3、H2C2O4和H2SO4制取新型水处理剂ClO2,反应的离子方程式:___________ 。
(7)向氯化铜溶液中通入SO2,加热生成CuCl白色沉淀,离子方程式:___________ 。
①2H2O2=2H2O+O2↑;
②Ag2O+H2O2=2Ag+O2↑+H2O;
③3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O。
(1)已知H2O2是二元弱酸,写出其第一步电离方程式:
(2)上述三个反应中,H2O2仅体现还原性的反应是
(3)根据上述反应推出H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是
(4)H2O2作反应物的某氧化还原反应,反应物和生成物共五种微粒:O2、H2O2、ClO
 、H2O、Cl-。
、H2O、Cl-。①写出上述反应的离子方程式:
②如果上述反应中有13.44 L(标准状况)气体生成,转移的电子的物质的量为
(5)H2O2可作为消除采矿业胶液中NaCN的试剂,反应的原理为NaCN+H2O2+H2O=A+NH3↑,其中A的化学式为
(6)可用KClO3、H2C2O4和H2SO4制取新型水处理剂ClO2,反应的离子方程式:
(7)向氯化铜溶液中通入SO2,加热生成CuCl白色沉淀,离子方程式:
您最近一年使用:0次
8 . 回答下列问题:
(1)写出下列反应的化学方程式,用双线桥标明电子转移的方向和数目,注明“被氧化”、“被还原”并指出氧化剂、还原剂。
①Fe2O3与CO在高温下的反应:_______ 。
②KClO3与MnO2加热条件下反应:_______ 。
(2)已知:
Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO +4H+
+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_______ 。
(1)写出下列反应的化学方程式,用双线桥标明电子转移的方向和数目,注明“被氧化”、“被还原”并指出氧化剂、还原剂。
①Fe2O3与CO在高温下的反应:
②KClO3与MnO2加热条件下反应:
(2)已知:
Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO
 +4H+
+4H+SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)化合价是学习氧化还原反应的基础。写出以下几种物质中加点元素 的化合价。
①Na2O 2_______ ② N H4NO3_______ ③H2C 2O4_______ ④HC lO_______
(2)实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为2KMnO4 K2MnO4+ MnO2+ O2↑,其中被氧化的元素是
K2MnO4+ MnO2+ O2↑,其中被氧化的元素是_______ (填元素符号),还原产物是_______ (填化学式)。
(3)下列反应方程式: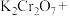 14HCl
14HCl 2
2 2
2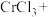 3
3 7
7 中还原剂是
中还原剂是_______ ,若反应中发生氧化反应的HCl个数为12,则反应中转移的电子数为_______ 。
(4)下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答下列有关问题:
I.反应②的离子方程式为_______
II.反应②中,氧化产物与还原产物的质量比为_______
III.已知反应④:4HCl+O2 2Cl2+2H2O(g),该反应也能制得氯气。提醒一下,反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气。提醒一下,反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______
(1)化合价是学习氧化还原反应的基础。写出以下几种物质中
①Na2
(2)实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为2KMnO4
 K2MnO4+ MnO2+ O2↑,其中被氧化的元素是
K2MnO4+ MnO2+ O2↑,其中被氧化的元素是(3)下列反应方程式:
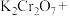 14HCl
14HCl 2
2 2
2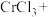 3
3 7
7 中还原剂是
中还原剂是(4)下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O ②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答下列有关问题:
I.反应②的离子方程式为
II.反应②中,氧化产物与还原产物的质量比为
III.已知反应④:4HCl+O2
 2Cl2+2H2O(g),该反应也能制得氯气。提醒一下,反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气。提醒一下,反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
您最近一年使用:0次
10 . Ⅰ.有下列三个在溶液中发生的氧化还原反应:
①
②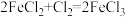
③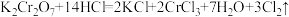
请根据上述反应分析推断后回答下列问题:
(1) 的氧化性由强到弱依次是
的氧化性由强到弱依次是_______ 。
(2) 在强酸性溶液中能否大量共存?
在强酸性溶液中能否大量共存?_______ (填“能”或“不能”),理由是_______ 。
Ⅱ. 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: 。
。
(3)反应中_______ 元素被氧化(填元素名称),_______ 是氧化剂(填化学式);
(4)用单线桥标出电子转移方向和数目:_______ 。
(5) 表现的性质是
表现的性质是_______ 。
(6)某厂废液中,含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是_______。
的是_______。
①

②
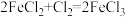
③
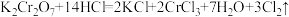
请根据上述反应分析推断后回答下列问题:
(1)
 的氧化性由强到弱依次是
的氧化性由强到弱依次是(2)
 在强酸性溶液中能否大量共存?
在强酸性溶液中能否大量共存?Ⅱ.
 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: 。
。(3)反应中
(4)用单线桥标出电子转移方向和数目:
(5)
 表现的性质是
表现的性质是(6)某厂废液中,含有2%~5%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是_______。
的是_______。A. | B.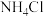 | C.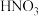 | D.浓 |
您最近一年使用:0次
2022-10-11更新
|
427次组卷
|
3卷引用:新疆大学附属中学2023-2024学年高一上学期期中考试化学试题



