1 . 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
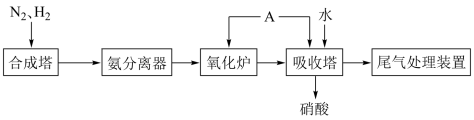
(1)写出氧化炉中发生反应的化学方程式________________ ,该反应在标况下消耗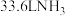 转移的电子为
转移的电子为________ mol。
(2)请思考 是什么物质
是什么物质________ ,以及向吸收塔中通入 的作用是
的作用是________________ 。
(3)工业生产中为了盛装大量浓硝酸,可选择________ 作为罐体材料。
a.铜 b.铂 c.铝 d.镁
(4)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的 溶液等吸收尾气,后者使用
溶液等吸收尾气,后者使用 或其他物质将氮氧化物还原为
或其他物质将氮氧化物还原为 。请以碱性的
。请以碱性的 溶液吸收尾气中的
溶液吸收尾气中的 处理为例,写出该反应的化学方程式,通过查阅资料,
处理为例,写出该反应的化学方程式,通过查阅资料, 溶液也能够吸收尾气
溶液也能够吸收尾气 ,写出涉及到的离子反应方程式
,写出涉及到的离子反应方程式________ 。

(1)写出氧化炉中发生反应的化学方程式
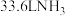 转移的电子为
转移的电子为(2)请思考
 是什么物质
是什么物质 的作用是
的作用是(3)工业生产中为了盛装大量浓硝酸,可选择
a.铜 b.铂 c.铝 d.镁
(4)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的
 溶液等吸收尾气,后者使用
溶液等吸收尾气,后者使用 或其他物质将氮氧化物还原为
或其他物质将氮氧化物还原为 。请以碱性的
。请以碱性的 溶液吸收尾气中的
溶液吸收尾气中的 处理为例,写出该反应的化学方程式,通过查阅资料,
处理为例,写出该反应的化学方程式,通过查阅资料, 溶液也能够吸收尾气
溶液也能够吸收尾气 ,写出涉及到的离子反应方程式
,写出涉及到的离子反应方程式
您最近一年使用:0次
名校
2 . 离子反应广泛用于化学研究、化工生产、医疗诊断和环境保护等各个领域。
(1)实验室中可利用Na2SO3粉末与质量分数为70%的硫酸反应制取少量SO2,反应的化学方程式_______ 。
(2)已知酸性高锰酸钾溶液可吸收SO2,则该反应的离子方程式为_______ 。
(3)某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,则其中所含SO2的物质的量为_______ 。现用含NaOH浓度为0.5mol·L-1的废碱液(假设其他成分不参与反应)进行处理,每天至少需要这种废碱液的体积为_______ L。
(4)某同学向BaCl2溶液中通入SO2,未观察到白色沉淀生成,由此可知酸性强H2SO3_______ HCl(填“>”或“<”)。取上述所得溶液进行下列操作,能观察到白色沉淀生成的_______ (填字母)。
A.滴加H2O2溶液 B.滴加稀盐酸 C.滴加NaOH溶液
(1)实验室中可利用Na2SO3粉末与质量分数为70%的硫酸反应制取少量SO2,反应的化学方程式
(2)已知酸性高锰酸钾溶液可吸收SO2,则该反应的离子方程式为
(3)某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,则其中所含SO2的物质的量为
(4)某同学向BaCl2溶液中通入SO2,未观察到白色沉淀生成,由此可知酸性强H2SO3
A.滴加H2O2溶液 B.滴加稀盐酸 C.滴加NaOH溶液
您最近一年使用:0次
名校
解题方法
3 . “84消毒液”是家居常用的防疫用品,某小组同学查看包装说明,得到如下信息:
该小组同学进行了如下实验。回答下列问题:
(1)稀释:将“84消毒液”原液稀释配制成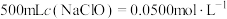 的溶液。
的溶液。
①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、__________ 、__________ 。
②稀释时,需要取用__________ mL“84消毒液”原液。
③下列操作会使溶液中 浓度偏高的是
浓度偏高的是__________ (填标号)。
A.取用久置的“84消毒液”原液进行稀释
B.定容时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图所示装置探究“84消毒液”与洁厕灵的反应:
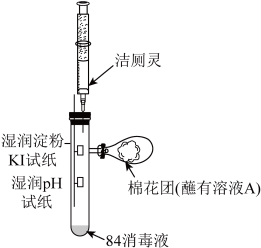
①将注射器中的洁厕灵注入试管中,可观察到试管内产生黄绿色气体,pH试纸__________ 。
②棉花团蘸取的溶液A是__________ ,其作用是__________ 。
③该小组查资料得:“84消毒液”也不能与双氧水混合,两者混合会产生一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式__________ 。
84消毒液 【有效成分】  【规格】  【浓度】 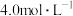 注:①按一定比例稀释后使用 ②不得与酸性产品(如洁厕灵)同时使用 |
(1)稀释:将“84消毒液”原液稀释配制成
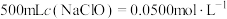 的溶液。
的溶液。①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
②稀释时,需要取用
③下列操作会使溶液中
 浓度偏高的是
浓度偏高的是A.取用久置的“84消毒液”原液进行稀释
B.定容时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图所示装置探究“84消毒液”与洁厕灵的反应:

①将注射器中的洁厕灵注入试管中,可观察到试管内产生黄绿色气体,pH试纸
②棉花团蘸取的溶液A是
③该小组查资料得:“84消毒液”也不能与双氧水混合,两者混合会产生一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式
您最近一年使用:0次
名校
4 . 根据题给信息,回答相关问题:
(1)FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为___________ 。
(2)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___________ 
(3)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为___________ 。
(4)请配平下列反应的化学方程式:___________
 NaBO2+
NaBO2+ SiO2+
SiO2+ Na+
Na+ H2―→
H2―→ NaBH4+
NaBH4+ Na2SiO3.
Na2SiO3.
(1)FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为(2)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:

(3)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为
(4)请配平下列反应的化学方程式:
 NaBO2+
NaBO2+ SiO2+
SiO2+ Na+
Na+ H2―→
H2―→ NaBH4+
NaBH4+ Na2SiO3.
Na2SiO3.
您最近一年使用:0次
名校
解题方法
5 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)制备 需要在
需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: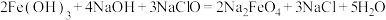 。
。
①该反应中氧化剂是_______ (用化学式表示,下同),氧化产物为_______ 。
②用单线桥法标出电子转移的方向和数目:_______ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气,  通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放  ,即可达到卫生标准 ,即可达到卫生标准…… |
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠
 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: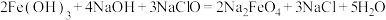 。
。①该反应中氧化剂是
②用单线桥法标出电子转移的方向和数目:
您最近一年使用:0次
名校
6 . 建筑工地常用的 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: 。已知
。已知 可以使淀粉变蓝。
可以使淀粉变蓝。
(1)将上述反应中的物质按树状分类法进行分类:_____ 。

属于电解质的是_____ 。
(2)已知 为强酸,写出上述反应的离子方程式:
为强酸,写出上述反应的离子方程式:_____ 。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别 和
和 ,可选用的物质有:①水②淀粉碘化钾试纸③淀粉④白酒⑤食醋,下列选项合适的是_____(填序号)。
,可选用的物质有:①水②淀粉碘化钾试纸③淀粉④白酒⑤食醋,下列选项合适的是_____(填序号)。
(4)某厂废液中含有 的
的 ,直接排放会造成污染,采用
,直接排放会造成污染,采用 ,能使
,能使 转化为不引起二次污染的
转化为不引起二次污染的 ,反应的化学方程式为
,反应的化学方程式为_____ 。
 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: 。已知
。已知 可以使淀粉变蓝。
可以使淀粉变蓝。(1)将上述反应中的物质按树状分类法进行分类:

属于电解质的是
(2)已知
 为强酸,写出上述反应的离子方程式:
为强酸,写出上述反应的离子方程式:(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别
 和
和 ,可选用的物质有:①水②淀粉碘化钾试纸③淀粉④白酒⑤食醋,下列选项合适的是_____(填序号)。
,可选用的物质有:①水②淀粉碘化钾试纸③淀粉④白酒⑤食醋,下列选项合适的是_____(填序号)。| A.③⑤ | B.①②④ | C.①②⑤ | D.①②③⑤ |
(4)某厂废液中含有
 的
的 ,直接排放会造成污染,采用
,直接排放会造成污染,采用 ,能使
,能使 转化为不引起二次污染的
转化为不引起二次污染的 ,反应的化学方程式为
,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-=2RO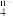 +3Cl-+5H2O。则RO
+3Cl-+5H2O。则RO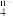 中n的值是
中n的值是
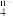 +3Cl-+5H2O。则RO
+3Cl-+5H2O。则RO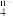 中n的值是
中n的值是| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
名校
解题方法
8 . 一种利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。下列说法错误的是
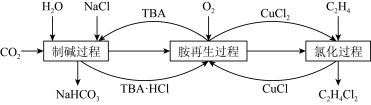

A.氯化过程每生成 ,总反应中消耗 ,总反应中消耗 |
B.胺再生过程的反应为 |
| C.整个工艺原子利用率为100%,符合绿色化学的要求 |
| D.TBA替代了侯德榜制碱法中的氨气 |
您最近一年使用:0次
名校
解题方法
9 . 氮氧化物对环境的污染及防治是化学研究的热点之一、请回答下列问题:
I:
(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:___________ 。
(2)用氨可将氮氧化物转化为无毒气体。如,4NH3+6NO 5N2+6H2O,写出氨气转化NO2的化学方程式:
5N2+6H2O,写出氨气转化NO2的化学方程式:___________ ,此反应中氧化产物与还原产物的质量之比为___________ 。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:___________ 。
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是___________ 。
II.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(4)X的化学式为___________ ,Y的化学式为___________ 。
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是___________(填字母)。
(6)将X与SO2混合可发生反应,该反应中氧化产物与还原产物的质量之比为___________ 。
I:
(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:
(2)用氨可将氮氧化物转化为无毒气体。如,4NH3+6NO
 5N2+6H2O,写出氨气转化NO2的化学方程式:
5N2+6H2O,写出氨气转化NO2的化学方程式:(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是
II.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(4)X的化学式为
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是___________(填字母)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
您最近一年使用:0次
名校
10 . 钴酸锂一般用作锂离子电池的正极材料,需求量大,而我国极度缺乏钴资源,主要依赖进口,因而从废旧电池中进行回收具有重要意义。以废旧钴酸锂电池材料(主要成分为LiCoO2,含单质Cu及为改善电池性能添加的单质Al等)回收钴酸锂的--种工艺流程如下:

回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解、粉碎预处理,粉碎的目的是_____ 。
(2)“碱浸”所得滤液中主要溶质的化学式为__________ 、NaOH。
(3)H2O2的电子式为________ 。“酸浸”时H2O2作还原剂,还原产物为Co2+,反应的离子方程式为_________ ;上述反应的氧化产物又将铜氧化而溶解浸出,该反应的化学方程式为____________ 。
(4)“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,萃取铜后的溶液需调pH至5.0以上将铝离子沉淀除去。若c(Co2+ ) =0.16mol·L-1,为避免析出Co(OH)2沉淀,则调pH不能超过___________ 。(已知K[Co(OH)2]=1.6×10-15)
(5)“钴、锂共沉淀”时析出CoCO3和li2CO3,经过滤、无水乙醇洗涤、80°C干燥后在750°C煅烧,反应的化学方程式为_________________ 。

回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解、粉碎预处理,粉碎的目的是
(2)“碱浸”所得滤液中主要溶质的化学式为
(3)H2O2的电子式为
(4)“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,萃取铜后的溶液需调pH至5.0以上将铝离子沉淀除去。若c(Co2+ ) =0.16mol·L-1,为避免析出Co(OH)2沉淀,则调pH不能超过
(5)“钴、锂共沉淀”时析出CoCO3和li2CO3,经过滤、无水乙醇洗涤、80°C干燥后在750°C煅烧,反应的化学方程式为
您最近一年使用:0次



