名校
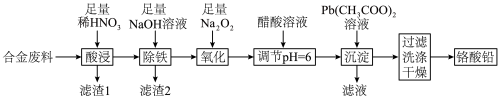
1 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
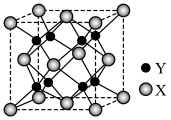
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近半年使用:0次
7日内更新
|
22次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
解题方法
2 . Ⅰ.为观察亚硫酸钠和浓硫酸的反应现象并探究 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:______ 。
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是____________ 。
(3)装置 产生的现象是
产生的现象是_________________________ ,其中 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为________________________ ,体现了的
______ 性。
(4) 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:____________ 。
Ⅱ.我国国家标准规定葡萄酒中的最大使用量为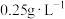 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与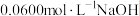 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:
(5)该葡萄酒中 的含量为
的含量为______  ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是________________________ 。
 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是
(3)装置
 产生的现象是
产生的现象是 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为
(4)
 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:Ⅱ.我国国家标准规定葡萄酒中的最大使用量为
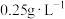 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与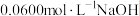 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:(5)该葡萄酒中
 的含量为
的含量为 ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是
您最近半年使用:0次
3 . 化学与生活、生产息息相关。请回答下列问题:
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有_______ (填序号,下同),属于非电解质的有_______ 。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为_______ 。
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为_______ 。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式_______ :
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为
您最近半年使用:0次
解题方法
4 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______ 。
(2)“滤液②”中含有的金属离子是______ 。
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为______ 。
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是______ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______ 。
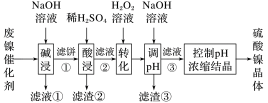

| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时 (c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时 (c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近半年使用:0次
解题方法
5 .  是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备
是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备 (夹持装置略)。
(夹持装置略)。 高温时能与
高温时能与 反应,其他相关信息如下表所示:
反应,其他相关信息如下表所示:
实验步骤为检查装置气密性并加入试剂后,先通 ,一段时间后再加热管式炉并改通
,一段时间后再加热管式炉并改通 ,……。
,……。
回答下列问题:
(1)仪器D的名称是_______ 。
(2)管式炉中除生成 外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为
外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为_______ 。
(3)D装置中碱石灰的作用是_______ 。
(4)E装置中多孔球泡的作用是_______ 。
(5)管式炉中还会发生副反应生成少量 ,则分离提纯C中所得
,则分离提纯C中所得 粗品应采取的实验操作名称是
粗品应采取的实验操作名称是_______ ; 沸点高于
沸点高于 的原因是
的原因是_______ 。
(6)利用如下图装置测定所得 的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待
的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴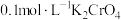 溶液作指示剂,用
溶液作指示剂,用 标准溶液滴定至终点,消耗标准溶液VmL。
标准溶液滴定至终点,消耗标准溶液VmL。
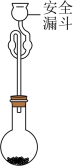
已知:常温下 ,
, ,
, 呈砖红色,
呈砖红色, 。
。_______ 。
②滴定终点的现象是_______ 。
③产品中 的纯度为
的纯度为_______ 。
 是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备
是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备 (夹持装置略)。
(夹持装置略)。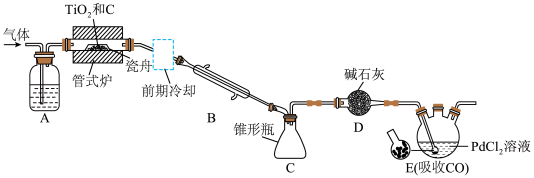
 高温时能与
高温时能与 反应,其他相关信息如下表所示:
反应,其他相关信息如下表所示:| 熔点/℃ | 沸点/℃ | 溶解性 | |
 | -24 | 136.4 | 易水解生成白色沉淀,能溶于有机溶剂 |
 | -23 | 76.8 | 难溶于水 |
 ,一段时间后再加热管式炉并改通
,一段时间后再加热管式炉并改通 ,……。
,……。回答下列问题:
(1)仪器D的名称是
(2)管式炉中除生成
 外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为
外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为(3)D装置中碱石灰的作用是
(4)E装置中多孔球泡的作用是
(5)管式炉中还会发生副反应生成少量
 ,则分离提纯C中所得
,则分离提纯C中所得 粗品应采取的实验操作名称是
粗品应采取的实验操作名称是 沸点高于
沸点高于 的原因是
的原因是(6)利用如下图装置测定所得
 的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待
的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴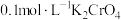 溶液作指示剂,用
溶液作指示剂,用 标准溶液滴定至终点,消耗标准溶液VmL。
标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下
 ,
, ,
, 呈砖红色,
呈砖红色, 。
。
②滴定终点的现象是
③产品中
 的纯度为
的纯度为
您最近半年使用:0次
2024-04-20更新
|
125次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
名校
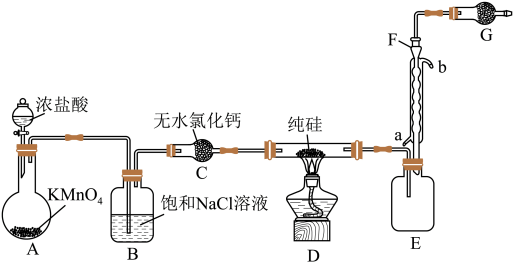
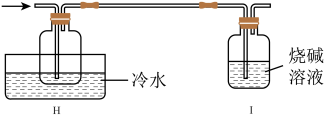
6 . 2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。
③电负性Cl>H>Si, 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
请回答下列问题:
(1)写出A中发生反应的离子方程式:______ 。
(2)装置B的作用是______ 。
(3)仪器F的名称是______ ,冷却水应从______ (填“a”或“b”)口通入。
(4)有同学设计如图装置H、I替代上述E、G装置;______ 。
(5)测定产品纯度。取mg 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为______ %(用含m、c和V的代数式表示)。若产品中溶有少量 ,则测定结果
,则测定结果______ (填“偏高”、“偏低”或“无影响”)
(6) 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为______ 。
①
 ,
,
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。③电负性Cl>H>Si,
 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。请回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)装置B的作用是
(3)仪器F的名称是
(4)有同学设计如图装置H、I替代上述E、G装置;
(5)测定产品纯度。取mg
 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为 ,则测定结果
,则测定结果(6)
 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
您最近半年使用:0次
2024-04-19更新
|
196次组卷
|
2卷引用:云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷
名校
解题方法
7 . 锡酸钠 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为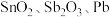 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体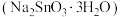 的工艺流程如下:
的工艺流程如下:
②锡酸钠晶体易溶于水,难溶于乙醇。
回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
(2)“高温真空蒸发”控制温度在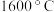 左右,目的是
左右,目的是___________ 。
(3)“高温碱熔”时,单质 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(4)已知“溶浸”后溶液中的阴离子主要为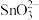 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为___________ 。
(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、___________ (填试剂名称)洗涤、___________ (填“低温”或“高温”)干燥。
(6)利用焦炭在 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为___________  。
。
 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为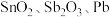 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体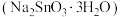 的工艺流程如下:
的工艺流程如下: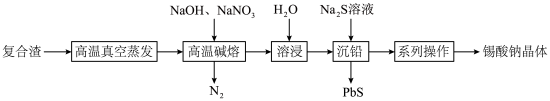
| 物质 |  |  |  |  |
沸点 | 1800 | 2260 | 1550 | 1740 |
回答下列问题:
(1)
 元素在周期表中的位置为
元素在周期表中的位置为(2)“高温真空蒸发”控制温度在
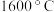 左右,目的是
左右,目的是(3)“高温碱熔”时,单质
 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为(4)已知“溶浸”后溶液中的阴离子主要为
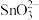 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、
(6)利用焦炭在
 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为 。
。
您最近半年使用:0次
2024-04-19更新
|
218次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
8 . 在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价—类”二维图。
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有______ ,______ (填化学式,任写两种)。
(2)写出Cu和Z的浓溶液发生反应的化学方程式__________________ 。
(3)将Y通入品红溶液中,可观察到的现象是______________________________ 。
(4)工业上处理废气时,通过步骤IⅡ和步骤w将Y转化为CaSO4再利用。
①实现步骤I的转化所加试剂是______ (写出一种即可)。
②实现步骤Ⅱ的转化可选择______ 试剂(填序号)。
A.O2 B.KI C.H2O2 D.Na2S
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
(6)将H2S与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为______ 。
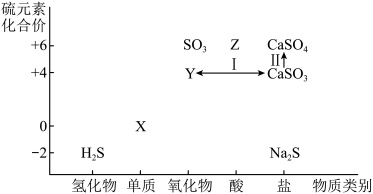
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有
(2)写出Cu和Z的浓溶液发生反应的化学方程式
(3)将Y通入品红溶液中,可观察到的现象是
(4)工业上处理废气时,通过步骤IⅡ和步骤w将Y转化为CaSO4再利用。
①实现步骤I的转化所加试剂是
②实现步骤Ⅱ的转化可选择
A.O2 B.KI C.H2O2 D.Na2S
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
(6)将H2S与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为
您最近半年使用:0次
9 . 以硫铁矿(主要成分为 ,还有少量
,还有少量 )为原料,制备硫酸亚铁晶体
)为原料,制备硫酸亚铁晶体 和软磁性材料
和软磁性材料 的工艺流程如图:
的工艺流程如图:
(1)焙烧后得到的固体主要成分为 ,写出焙烧过程主要反应的化学方程式
,写出焙烧过程主要反应的化学方程式_________________ 。
(2)试剂 是
是_________________ (填化学式)。
(3)焙烧产生的 会污染环境,可用足量氨水吸收,写出离子方程式
会污染环境,可用足量氨水吸收,写出离子方程式_________________ 。
(4)用如图所示装置可探究 的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通
的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图:_____________ , 图中②的曲线出现骤降,这是因为
图中②的曲线出现骤降,这是因为_____________ (用化学方程式表示)。
(5)取 粗产品
粗产品 ,加水完全溶解,滴加酸化的
,加水完全溶解,滴加酸化的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 (已知
(已知 被还原为
被还原为 ),则
),则 的纯度为
的纯度为_________________ 。
(6)“沉铁”操作时,将提纯后的 溶液与氨水
溶液与氨水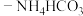 混合溶液反应,生成
混合溶液反应,生成 沉淀,生成
沉淀,生成 沉淀的离子方程式为
沉淀的离子方程式为_________________ 。
 ,还有少量
,还有少量 )为原料,制备硫酸亚铁晶体
)为原料,制备硫酸亚铁晶体 和软磁性材料
和软磁性材料 的工艺流程如图:
的工艺流程如图:
(1)焙烧后得到的固体主要成分为
 ,写出焙烧过程主要反应的化学方程式
,写出焙烧过程主要反应的化学方程式(2)试剂
 是
是(3)焙烧产生的
 会污染环境,可用足量氨水吸收,写出离子方程式
会污染环境,可用足量氨水吸收,写出离子方程式(4)用如图所示装置可探究
 的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通
的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图: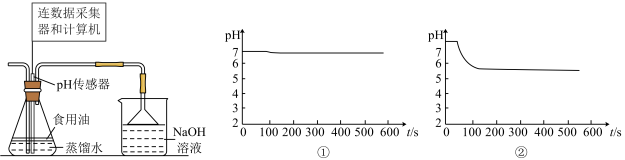
 图中②的曲线出现骤降,这是因为
图中②的曲线出现骤降,这是因为(5)取
 粗产品
粗产品 ,加水完全溶解,滴加酸化的
,加水完全溶解,滴加酸化的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 (已知
(已知 被还原为
被还原为 ),则
),则 的纯度为
的纯度为(6)“沉铁”操作时,将提纯后的
 溶液与氨水
溶液与氨水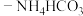 混合溶液反应,生成
混合溶液反应,生成 沉淀,生成
沉淀,生成 沉淀的离子方程式为
沉淀的离子方程式为
您最近半年使用:0次
解题方法
10 . 按要求完成下面小题。
(1)有以下转化关系:
反应①:___________
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是___________ (填序号)。
(2) 。该反应中,生成物M是
。该反应中,生成物M是___________ (填化学式)。
(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是___________ (填序号,下同)。
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为___________ 。
(5) 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:___________ 。
(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平___________ 。
(1)有以下转化关系:

反应①:
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是(2)
 。该反应中,生成物M是
。该反应中,生成物M是(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为
(5)
 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平
您最近半年使用:0次



