解题方法
1 . 一种利用废旧三元锂离子电池分步回收金属的实验流程如下:
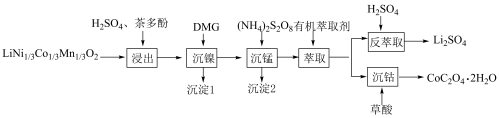
已知:
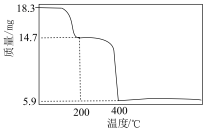
① 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;
②室温下,几种金属离子形成氢氧化物沉淀的 如下表:
如下表:
③DMG的结构为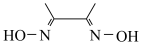 ;
;
④金属离子与有机萃取剂TBP结合能力为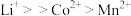 ,与P507的结合能力为
,与P507的结合能力为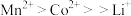 。
。
回答下列问题:
(1) 中锰元素的化合价是
中锰元素的化合价是___________ 。
(2) 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的___________ (填“正极”或“负极”)材料。
(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是___________ 。
(4)沉淀1为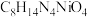 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是___________ (DMG用化学式表示),该过程中应控制溶液的 ,理论上最佳的
,理论上最佳的 不超过
不超过___________ (填序号),原因是___________ 。
A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是___________ 。
(6)有机萃取剂应选择___________ (填“TBP”或“P507”),利用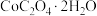 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是___________ (填化学式)。

已知:
①
 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;②室温下,几种金属离子形成氢氧化物沉淀的
 如下表:
如下表:| 金属离子 |  |  |  |
开始沉淀 | 8.1 | 7.2 | 7.2 |
完全沉淀 | 10.1 | 8.7 | 8.7 |
 ;
;④金属离子与有机萃取剂TBP结合能力为
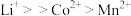 ,与P507的结合能力为
,与P507的结合能力为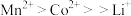 。
。回答下列问题:
(1)
 中锰元素的化合价是
中锰元素的化合价是(2)
 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是
(4)沉淀1为
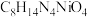 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是 ,理论上最佳的
,理论上最佳的 不超过
不超过A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为
 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是(6)有机萃取剂应选择
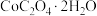 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是
您最近一年使用:0次
名校
2 . 汽车剧烈碰撞时,安全气囊中发生反应:NaN3+KNO3→K2O+Na2O+N2↑(未配平)。对上述反应的描述错误的是
| A.NaN3是还原剂,KNO3是氧化剂 |
| B.该反应中只有1种元素的化合价发生变化 |
| C.配平后物质的化学计量数依次为10、2、1、5、16 |
| D.生成N2的个数与转移电子个数之比为4:5 |
您最近一年使用:0次
2024-03-22更新
|
104次组卷
|
2卷引用:云南省腾冲市第八中学2023-2024学年高一上学期第四次月考化学试卷
名校
3 . 离子反应广泛用于化学研究、化工生产、医疗诊断和环境保护等各个领域。
(1)实验室中可利用Na2SO3粉末与质量分数为70%的硫酸反应制取少量SO2,反应的化学方程式_______ 。
(2)已知酸性高锰酸钾溶液可吸收SO2,则该反应的离子方程式为_______ 。
(3)某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,则其中所含SO2的物质的量为_______ 。现用含NaOH浓度为0.5mol·L-1的废碱液(假设其他成分不参与反应)进行处理,每天至少需要这种废碱液的体积为_______ L。
(4)某同学向BaCl2溶液中通入SO2,未观察到白色沉淀生成,由此可知酸性强H2SO3_______ HCl(填“>”或“<”)。取上述所得溶液进行下列操作,能观察到白色沉淀生成的_______ (填字母)。
A.滴加H2O2溶液 B.滴加稀盐酸 C.滴加NaOH溶液
(1)实验室中可利用Na2SO3粉末与质量分数为70%的硫酸反应制取少量SO2,反应的化学方程式
(2)已知酸性高锰酸钾溶液可吸收SO2,则该反应的离子方程式为
(3)某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,则其中所含SO2的物质的量为
(4)某同学向BaCl2溶液中通入SO2,未观察到白色沉淀生成,由此可知酸性强H2SO3
A.滴加H2O2溶液 B.滴加稀盐酸 C.滴加NaOH溶液
您最近一年使用:0次
解题方法
4 . 氧化铋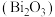 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有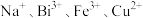 等。
等。
②盐酸羟胺常用作还原剂。
③ 在
在 时开始水解,
时开始水解,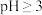 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。
④常温下部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
回答下列问题:
(1) 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为____________ 形。
(2)“滤渣1”的主要成分有 、
、____________ ,工业上以纯碱、石灰石、____________ (填化学式)为原料生产普通玻璃。
(3)写出“酸浸”步骤中 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:____________ 。
(4)“转化”步骤中加入盐酸羟胺 的目的是
的目的是____________ 。“调 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为____________ 。
(5)“滤液2”中主要的金属阳离子有____________ (填离子符号);流程中生成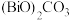 的化学方程式为
的化学方程式为____________ 。
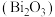 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有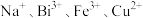 等。
等。②盐酸羟胺常用作还原剂。
③
 在
在 时开始水解,
时开始水解,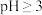 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。④常温下部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.7 |
| 完全沉淀 | 3.7 | 9.6 | 6.7 |
(1)
 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为(2)“滤渣1”的主要成分有
 、
、(3)写出“酸浸”步骤中
 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:(4)“转化”步骤中加入盐酸羟胺
 的目的是
的目的是 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为(5)“滤液2”中主要的金属阳离子有
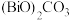 的化学方程式为
的化学方程式为
您最近一年使用:0次
2024-03-21更新
|
382次组卷
|
3卷引用:2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学
2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学黑龙江省部分学校2024届高三第二次模拟考试化学试题(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
5 . 氧化还原反应是一类重要的化学反应,广泛存在于生产、生活中。回答下列问题:
(1)以乙烯(C2H4)脱硫的方法治理燃煤尾气中的SO2,其机理如图所示。过程ⅰ、ⅱ、ⅲ中涉及氧化还原反应的是___________ ,图中涉及的物质属于酸性氧化物的是___________ (填化学式)。

(2)某工业废水含有大些对人体健康有危害的 ,为了降低废水中
,为了降低废水中 的浓度,可以在碱性条件下用铅粉将
的浓度,可以在碱性条件下用铅粉将 还原为N2,其化学方程式为
还原为N2,其化学方程式为 。
。
①Na[Al(OH)4]中Al的化合价为___________ 。
②上述反应中,被氧化的元素是___________ (填元素符号),还原产物的化学式为___________ 。
③反应中每生成1 mol N2,转移___________ 个电子。
(3)“假黄金”实际上是铜合金,可用稀硝酸鉴别。配平该反应 化学方程式
化学方程式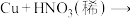
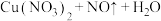 :
:___________ 。
(1)以乙烯(C2H4)脱硫的方法治理燃煤尾气中的SO2,其机理如图所示。过程ⅰ、ⅱ、ⅲ中涉及氧化还原反应的是

(2)某工业废水含有大些对人体健康有危害的
 ,为了降低废水中
,为了降低废水中 的浓度,可以在碱性条件下用铅粉将
的浓度,可以在碱性条件下用铅粉将 还原为N2,其化学方程式为
还原为N2,其化学方程式为 。
。①Na[Al(OH)4]中Al的化合价为
②上述反应中,被氧化的元素是
③反应中每生成1 mol N2,转移
(3)“假黄金”实际上是铜合金,可用稀硝酸鉴别。配平该反应
 化学方程式
化学方程式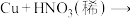
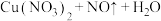 :
:
您最近一年使用:0次
名校
6 . “大象牙膏”是一种神奇的化学反应,它会喷出大量的泡沫,就像是普通牙膏一样,人们给它取了一个大象牙膏的名字,大象牙膏( )的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究
)的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究 的性质,过程如下:
的性质,过程如下:

【预测】聚焦 中的O作为核心元素,预测
中的O作为核心元素,预测 既具有氧化性,也具有还原性。
既具有氧化性,也具有还原性。
(1)预测其具有氧化性的思路是___________ 。
【实验和观察】小组同学分别选用酸性KMnO4溶液、酸性KI溶液与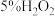 溶液反应以验证预测。已知:MnO
溶液反应以验证预测。已知:MnO 酸性条件下被还原成Mn2+,淀粉遇
酸性条件下被还原成Mn2+,淀粉遇 变蓝色。
变蓝色。
(2)实验①利用了酸性高锰酸钾的___________ (填“氧化性”或“还原性”),该实验中,证明酸性 溶液与
溶液与 溶液反应的现象除了溶液颜色变浅或褪色外还有
溶液反应的现象除了溶液颜色变浅或褪色外还有___________ 。请配平该反应的离子方程式:________
___________MnO +___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。
+___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。
(3)实验②是为了验证 的
的___________ (填“氧化性”或“还原性”),在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式___________ 。
解释和结论:以上实验可得出的结论是:H2O2既具有氧化性,也有还原性。
 )的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究
)的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究 的性质,过程如下:
的性质,过程如下:
【预测】聚焦
 中的O作为核心元素,预测
中的O作为核心元素,预测 既具有氧化性,也具有还原性。
既具有氧化性,也具有还原性。(1)预测其具有氧化性的思路是
【实验和观察】小组同学分别选用酸性KMnO4溶液、酸性KI溶液与
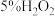 溶液反应以验证预测。已知:MnO
溶液反应以验证预测。已知:MnO 酸性条件下被还原成Mn2+,淀粉遇
酸性条件下被还原成Mn2+,淀粉遇 变蓝色。
变蓝色。(2)实验①利用了酸性高锰酸钾的
 溶液与
溶液与 溶液反应的现象除了溶液颜色变浅或褪色外还有
溶液反应的现象除了溶液颜色变浅或褪色外还有___________MnO
 +___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。
+___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。(3)实验②是为了验证
 的
的解释和结论:以上实验可得出的结论是:H2O2既具有氧化性,也有还原性。
您最近一年使用:0次
名校
解题方法
7 . “84消毒液”是家居常用的防疫用品,某小组同学查看包装说明,得到如下信息:
该小组同学进行了如下实验。回答下列问题:
(1)稀释:将“84消毒液”原液稀释配制成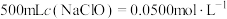 的溶液。
的溶液。
①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、__________ 、__________ 。
②稀释时,需要取用__________ mL“84消毒液”原液。
③下列操作会使溶液中 浓度偏高的是
浓度偏高的是__________ (填标号)。
A.取用久置的“84消毒液”原液进行稀释
B.定容时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图所示装置探究“84消毒液”与洁厕灵的反应:
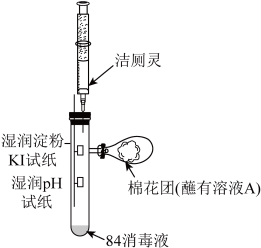
①将注射器中的洁厕灵注入试管中,可观察到试管内产生黄绿色气体,pH试纸__________ 。
②棉花团蘸取的溶液A是__________ ,其作用是__________ 。
③该小组查资料得:“84消毒液”也不能与双氧水混合,两者混合会产生一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式__________ 。
84消毒液 【有效成分】  【规格】  【浓度】 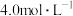 注:①按一定比例稀释后使用 ②不得与酸性产品(如洁厕灵)同时使用 |
(1)稀释:将“84消毒液”原液稀释配制成
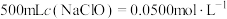 的溶液。
的溶液。①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
②稀释时,需要取用
③下列操作会使溶液中
 浓度偏高的是
浓度偏高的是A.取用久置的“84消毒液”原液进行稀释
B.定容时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图所示装置探究“84消毒液”与洁厕灵的反应:

①将注射器中的洁厕灵注入试管中,可观察到试管内产生黄绿色气体,pH试纸
②棉花团蘸取的溶液A是
③该小组查资料得:“84消毒液”也不能与双氧水混合,两者混合会产生一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式
您最近一年使用:0次
8 . 回答下列问题:
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH_______ (填“增大”“减小”或“不变”)。
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)_______ (填“增大”“减小”或“不变”),原因是_______ 。
(2)含有Cr2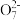 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2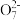 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2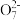
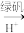 Cr3+、Fe3+
Cr3+、Fe3+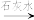 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。
①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为_______ 。
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为_______ 。
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)
(2)含有Cr2
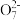 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2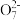 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2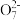
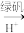 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
名校
9 . 某课外兴趣小组为拓展对SO2还原性和氧化性的认识,进行了下列两组探究实验。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示: 的Fe(NO3)3溶液的pH=1;该实验条件下不考虑
的Fe(NO3)3溶液的pH=1;该实验条件下不考虑 被酸性KMnO4溶液氧化。
被酸性KMnO4溶液氧化。
回答下列问题:
①盛装浓硫酸的仪器名称为_______ 。
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成_______ 键。
③如图进行实验,装置B中产生了白色沉淀,其成分是_______ (填化学式)。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与 反应;
反应;
猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗?_______ (填“是”或“否”)。若不正确,理由是_______ (正确无需回答)。
⑤请你设计实验验证猜想2,并完成表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
⑥尾气处理装置应选择_______ (填序号)。 水溶液显棕色,
水溶液显棕色,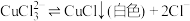
①通过上述两组对比实验,SO2与铜反应的条件是_______ 。
②写出SO2在盐酸中和铜反应的离子方程式:_______ 。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示:
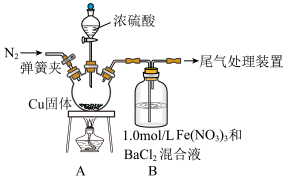
 的Fe(NO3)3溶液的pH=1;该实验条件下不考虑
的Fe(NO3)3溶液的pH=1;该实验条件下不考虑 被酸性KMnO4溶液氧化。
被酸性KMnO4溶液氧化。回答下列问题:
①盛装浓硫酸的仪器名称为
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成
③如图进行实验,装置B中产生了白色沉淀,其成分是
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与
 反应;
反应;猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗?
⑤请你设计实验验证猜想2,并完成表中内容(提示:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)| 实验步骤 | 预期现象和结论 |
a.配溶液,用NaNO3和盐酸配成pH= 浓度为 浓度为 的溶液,替换装置B中的Fe(NO3)3溶液。 的溶液,替换装置B中的Fe(NO3)3溶液。b.打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸并加热。 | 若装置B中有白色沉淀生成,猜想2成立。 若装置B中无白色沉淀生成,猜想2不成立。 |
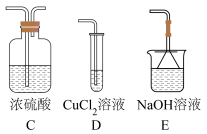
实验I 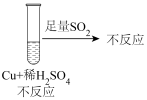
实验Ⅱ 
 水溶液显棕色,
水溶液显棕色,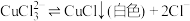
①通过上述两组对比实验,SO2与铜反应的条件是
②写出SO2在盐酸中和铜反应的离子方程式:
您最近一年使用:0次
解题方法
10 . 工业上利用废镍催化剂(主要成分为Ni,还含有一定量的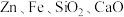 等)制备草酸镍晶体的流程如图:
等)制备草酸镍晶体的流程如图:

(1)请写出一种能提高“酸浸”速率的措施:___________ ﹔滤渣Ⅰ的成分是____________ .
(2)除铁时,控制不同的条件可以得到不同的滤渣.若控制温度为80℃、 ,可得到黄铁矾钠
,可得到黄铁矾钠 沉淀,写出生成黄铁矾钠的离子方程式:
沉淀,写出生成黄铁矾钠的离子方程式:___________ .
(3)加入有机萃取剂的作用是___________ .
(4)已知除铁后所得 溶液中
溶液中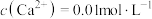 ,加入
,加入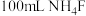 溶液,使
溶液,使 恰好沉淀完全,即溶液中
恰好沉淀完全,即溶液中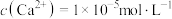 ,则所加溶液的
,则所加溶液的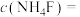
________  [已知
[已知 ].
].
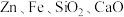 等)制备草酸镍晶体的流程如图:
等)制备草酸镍晶体的流程如图:
(1)请写出一种能提高“酸浸”速率的措施:
(2)除铁时,控制不同的条件可以得到不同的滤渣.若控制温度为80℃、
 ,可得到黄铁矾钠
,可得到黄铁矾钠 沉淀,写出生成黄铁矾钠的离子方程式:
沉淀,写出生成黄铁矾钠的离子方程式:(3)加入有机萃取剂的作用是
(4)已知除铁后所得
 溶液中
溶液中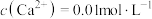 ,加入
,加入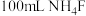 溶液,使
溶液,使 恰好沉淀完全,即溶液中
恰好沉淀完全,即溶液中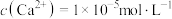 ,则所加溶液的
,则所加溶液的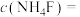
 [已知
[已知 ].
].
您最近一年使用:0次



