解题方法
1 .  是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备
是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备 (夹持装置略)。
(夹持装置略)。 高温时能与
高温时能与 反应,其他相关信息如下表所示:
反应,其他相关信息如下表所示:
实验步骤为检查装置气密性并加入试剂后,先通 ,一段时间后再加热管式炉并改通
,一段时间后再加热管式炉并改通 ,……。
,……。
回答下列问题:
(1)仪器D的名称是_______ 。
(2)管式炉中除生成 外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为
外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为_______ 。
(3)D装置中碱石灰的作用是_______ 。
(4)E装置中多孔球泡的作用是_______ 。
(5)管式炉中还会发生副反应生成少量 ,则分离提纯C中所得
,则分离提纯C中所得 粗品应采取的实验操作名称是
粗品应采取的实验操作名称是_______ ; 沸点高于
沸点高于 的原因是
的原因是_______ 。
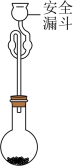
(6)利用如下图装置测定所得 的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待
的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴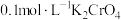 溶液作指示剂,用
溶液作指示剂,用 标准溶液滴定至终点,消耗标准溶液VmL。
标准溶液滴定至终点,消耗标准溶液VmL。
已知:常温下 ,
, ,
, 呈砖红色,
呈砖红色, 。
。_______ 。
②滴定终点的现象是_______ 。
③产品中 的纯度为
的纯度为_______ 。
 是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备
是制备钛及其化合物的重要中间体,某兴趣小组利用下图所示装置在实验室制备 (夹持装置略)。
(夹持装置略)。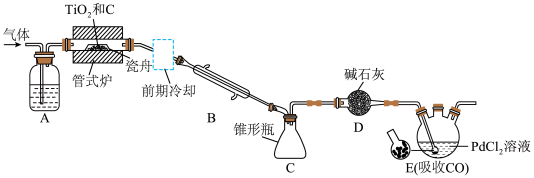
 高温时能与
高温时能与 反应,其他相关信息如下表所示:
反应,其他相关信息如下表所示:| 熔点/℃ | 沸点/℃ | 溶解性 | |
 | -24 | 136.4 | 易水解生成白色沉淀,能溶于有机溶剂 |
 | -23 | 76.8 | 难溶于水 |
 ,一段时间后再加热管式炉并改通
,一段时间后再加热管式炉并改通 ,……。
,……。回答下列问题:
(1)仪器D的名称是
(2)管式炉中除生成
 外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为
外,还生成一种常见气态不成盐氧化物,该反应的化学方程式为(3)D装置中碱石灰的作用是
(4)E装置中多孔球泡的作用是
(5)管式炉中还会发生副反应生成少量
 ,则分离提纯C中所得
,则分离提纯C中所得 粗品应采取的实验操作名称是
粗品应采取的实验操作名称是 沸点高于
沸点高于 的原因是
的原因是(6)利用如下图装置测定所得
 的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待
的纯度:取mg产品加入圆底烧瓶中,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴
充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴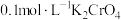 溶液作指示剂,用
溶液作指示剂,用 标准溶液滴定至终点,消耗标准溶液VmL。
标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下
 ,
, ,
, 呈砖红色,
呈砖红色, 。
。
②滴定终点的现象是
③产品中
 的纯度为
的纯度为
您最近一年使用:0次
2024-04-20更新
|
137次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
名校
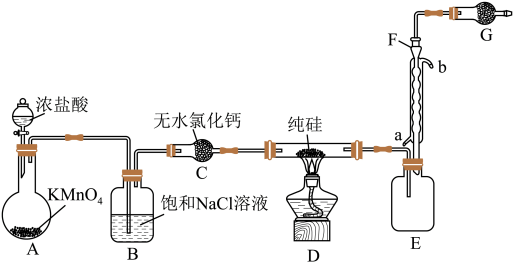
2 . 2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。
③电负性Cl>H>Si, 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
请回答下列问题:
(1)写出A中发生反应的离子方程式:______ 。
(2)装置B的作用是______ 。
(3)仪器F的名称是______ ,冷却水应从______ (填“a”或“b”)口通入。
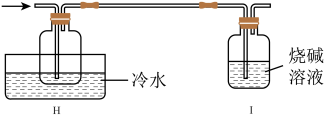
(4)有同学设计如图装置H、I替代上述E、G装置;______ 。
(5)测定产品纯度。取mg 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为______ %(用含m、c和V的代数式表示)。若产品中溶有少量 ,则测定结果
,则测定结果______ (填“偏高”、“偏低”或“无影响”)
(6) 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为______ 。
①
 ,
,
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。③电负性Cl>H>Si,
 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。请回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)装置B的作用是
(3)仪器F的名称是
(4)有同学设计如图装置H、I替代上述E、G装置;
(5)测定产品纯度。取mg
 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为 ,则测定结果
,则测定结果(6)
 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
您最近一年使用:0次
2024-04-19更新
|
208次组卷
|
2卷引用:云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷
解题方法
3 . 乙醛是一种重要的工业原料,广泛应用于医药、农药、涂料、塑料、合成纤维、橡胶、树脂等领域。乙醛由乙烯在催化剂作用下直接氧化制得,乙烯氧化法制乙醛的原理如下图所示(部分相关离子未画出),下列说法正确的是


A. 在反应中是中间产物 在反应中是中间产物 |
B.乙烯催化氧化法制乙醛的化学方程式为 |
| C.转化过程中,Pd元素的化合价没有发生变化 |
| D.该转化过程中,有非极性键的断裂与极性键的形成 |
您最近一年使用:0次
名校
解题方法
4 . 锡酸钠 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为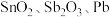 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体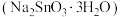 的工艺流程如下:
的工艺流程如下:
②锡酸钠晶体易溶于水,难溶于乙醇。
回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
(2)“高温真空蒸发”控制温度在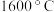 左右,目的是
左右,目的是___________ 。
(3)“高温碱熔”时,单质 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(4)已知“溶浸”后溶液中的阴离子主要为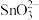 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为___________ 。
(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、___________ (填试剂名称)洗涤、___________ (填“低温”或“高温”)干燥。
(6)利用焦炭在 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为___________  。
。
 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为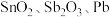 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体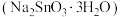 的工艺流程如下:
的工艺流程如下: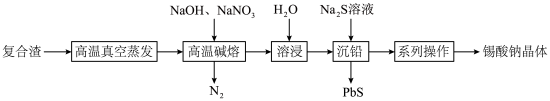
| 物质 |  |  |  |  |
沸点 | 1800 | 2260 | 1550 | 1740 |
回答下列问题:
(1)
 元素在周期表中的位置为
元素在周期表中的位置为(2)“高温真空蒸发”控制温度在
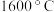 左右,目的是
左右,目的是(3)“高温碱熔”时,单质
 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为(4)已知“溶浸”后溶液中的阴离子主要为
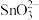 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、
(6)利用焦炭在
 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为 。
。
您最近一年使用:0次
2024-04-07更新
|
238次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
5 . 三氯化铬( )可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用
)可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用 和
和 制备无水
制备无水 并测定产品纯度,进行如图实验探究,回答下列问题:
并测定产品纯度,进行如图实验探究,回答下列问题:
(1)制备无水
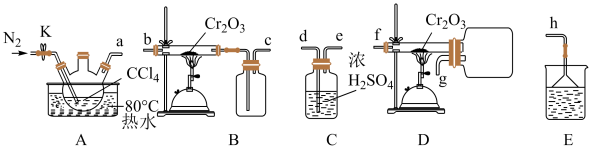
①所选装置的连接顺序为:A→___________ →C→E(填“B”或“D”),不选另一装置的原因是:___________ 。
②实验开始时,点燃酒精喷灯适合在水浴加热之___________ (填“前”或“后”)。
③已知制备 时有
时有 气体生成,制备
气体生成,制备 反应的化学方程式为
反应的化学方程式为___________ ;
 气体易水解则尾气处理时适合选用的试剂为
气体易水解则尾气处理时适合选用的试剂为___________ (填序号)。
A. 溶液 B.稀
溶液 B.稀 溶液 C.水
溶液 C.水
(2)测定产品纯度(杂质不参加反应)
已知:
准确称取31.7g产品,温水溶解后稀释至250 ,量取25.00
,量取25.00 溶液加入锥形瓶中,向其中加入足量
溶液加入锥形瓶中,向其中加入足量 充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量
充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量 溶液;滴加淀粉作指示剂,用2
溶液;滴加淀粉作指示剂,用2
 标准溶液滴定
标准溶液滴定 ,达到滴定终点时消耗标准液的体积为15
,达到滴定终点时消耗标准液的体积为15 。
。
①加入足量 的主要作用为
的主要作用为___________ 。
②写出加硫酸酸化后的橙色物质与 溶液发生反应的离子方程式
溶液发生反应的离子方程式___________ 。
③反应后溶液煮沸的目的为___________ 。
④产品中 的质量分数为
的质量分数为___________ 。
 )可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用
)可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用 和
和 制备无水
制备无水 并测定产品纯度,进行如图实验探究,回答下列问题:
并测定产品纯度,进行如图实验探究,回答下列问题:(1)制备无水


①所选装置的连接顺序为:A→
②实验开始时,点燃酒精喷灯适合在水浴加热之
③已知制备
 时有
时有 气体生成,制备
气体生成,制备 反应的化学方程式为
反应的化学方程式为 气体易水解则尾气处理时适合选用的试剂为
气体易水解则尾气处理时适合选用的试剂为A.
 溶液 B.稀
溶液 B.稀 溶液 C.水
溶液 C.水(2)测定产品纯度(杂质不参加反应)
已知:

准确称取31.7g产品,温水溶解后稀释至250
 ,量取25.00
,量取25.00 溶液加入锥形瓶中,向其中加入足量
溶液加入锥形瓶中,向其中加入足量 充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量
充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量 溶液;滴加淀粉作指示剂,用2
溶液;滴加淀粉作指示剂,用2
 标准溶液滴定
标准溶液滴定 ,达到滴定终点时消耗标准液的体积为15
,达到滴定终点时消耗标准液的体积为15 。
。①加入足量
 的主要作用为
的主要作用为②写出加硫酸酸化后的橙色物质与
 溶液发生反应的离子方程式
溶液发生反应的离子方程式③反应后溶液煮沸的目的为
④产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
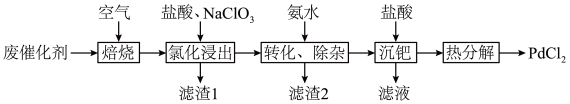
6 . 以Al2O3为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废Pd-Al2O3催化剂(主要含有Pd、Al2O3,还有少量PdO、SiO2、C)为原料制备氯化钯的流程如下:
(1)“焙烧”能有效清除废催化剂表面的积碳,打开Al2O3载体对钯的包裹,提高“氯化浸出”率。依据下图可判断“焙烧”的温度和时间应控制在___________ ,若焙烧时间过长,导致“氯化浸出”率下降可能的原因是___________ 。___________ ,通过该工序可将Pd转化为 ,
, 呈平面四边形,则
呈平面四边形,则 的杂化轨道类型为
的杂化轨道类型为___________ (填字母)。
A.sp2杂化 B.sp3杂化 C.dsp2杂化 D.dsp3杂化
(3)滤渣1为___________ ,滤渣2为___________ 。
(4)就“沉钯”中获得的 进行“热分解”,生成的气体可返回
进行“热分解”,生成的气体可返回___________ 工序继续使用。
(5)工业上也可用 还原
还原 制取海绵Pd,且对环境友好,该反应的化学方程式为
制取海绵Pd,且对环境友好,该反应的化学方程式为___________ 。
(1)“焙烧”能有效清除废催化剂表面的积碳,打开Al2O3载体对钯的包裹,提高“氯化浸出”率。依据下图可判断“焙烧”的温度和时间应控制在

 ,
, 呈平面四边形,则
呈平面四边形,则 的杂化轨道类型为
的杂化轨道类型为A.sp2杂化 B.sp3杂化 C.dsp2杂化 D.dsp3杂化
(3)滤渣1为
(4)就“沉钯”中获得的
 进行“热分解”,生成的气体可返回
进行“热分解”,生成的气体可返回(5)工业上也可用
 还原
还原 制取海绵Pd,且对环境友好,该反应的化学方程式为
制取海绵Pd,且对环境友好,该反应的化学方程式为
您最近一年使用:0次
2024-04-02更新
|
513次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
7 . 过碳酸钠(2 ·
·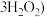 ,被称为固体双氧水,可在水中释放出活性氧而使其具有漂白和杀菌性能,是一种新型氧系漂白剂。过碳酸钠在异丙醇中的溶解度较低,实验室用
,被称为固体双氧水,可在水中释放出活性氧而使其具有漂白和杀菌性能,是一种新型氧系漂白剂。过碳酸钠在异丙醇中的溶解度较低,实验室用 和稳定剂的混合溶液与
和稳定剂的混合溶液与 化合制备,反应原理为:
化合制备,反应原理为: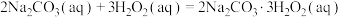
 ,装置如图所示。回答下列问题:
,装置如图所示。回答下列问题:
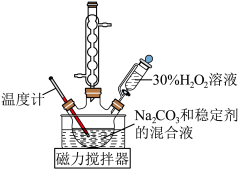
(1)盛装 溶液的仪器名称为
溶液的仪器名称为_______ 。
(2)下列可用作“稳定剂”的是_______(填字母)。
(3)实验时,应打开磁力搅拌器并缓慢加入 溶液的原因是
溶液的原因是____ ;反应结束后,停止搅拌,向反应液中加入异丙醇,静置、过滤、洗涤、干燥,获得过碳酸钠固体。加入异丙醇的目的是______ 。
(4)过碳酸钠是由 和
和 通过
通过_______ (填“化学键”、“氢键”或“分子间作用力”)形成的。过碳酸钠不稳定,在高温条件下,易发生分解,其反应方程式为_______ 。
(5)过碳酸钠活性氧含量的测定:准确称取试样2.0g于250mL锥形瓶中,加入40mL浓度为6%的硫酸溶液,水浴加热至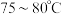 ,然后迅速用0.2000mol·
,然后迅速用0.2000mol· 的
的 溶液滴定,至
溶液滴定,至_______ 即为终点,消耗 溶液30.00mL,该样品中的活性氧含量为
溶液30.00mL,该样品中的活性氧含量为_______ (活性氧含量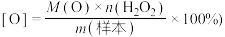 。
。
 ·
·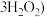 ,被称为固体双氧水,可在水中释放出活性氧而使其具有漂白和杀菌性能,是一种新型氧系漂白剂。过碳酸钠在异丙醇中的溶解度较低,实验室用
,被称为固体双氧水,可在水中释放出活性氧而使其具有漂白和杀菌性能,是一种新型氧系漂白剂。过碳酸钠在异丙醇中的溶解度较低,实验室用 和稳定剂的混合溶液与
和稳定剂的混合溶液与 化合制备,反应原理为:
化合制备,反应原理为: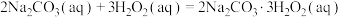
 ,装置如图所示。回答下列问题:
,装置如图所示。回答下列问题:
(1)盛装
 溶液的仪器名称为
溶液的仪器名称为(2)下列可用作“稳定剂”的是_______(填字母)。
A. | B. | C. | D. |
(3)实验时,应打开磁力搅拌器并缓慢加入
 溶液的原因是
溶液的原因是(4)过碳酸钠是由
 和
和 通过
通过(5)过碳酸钠活性氧含量的测定:准确称取试样2.0g于250mL锥形瓶中,加入40mL浓度为6%的硫酸溶液,水浴加热至
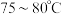 ,然后迅速用0.2000mol·
,然后迅速用0.2000mol· 的
的 溶液滴定,至
溶液滴定,至 溶液30.00mL,该样品中的活性氧含量为
溶液30.00mL,该样品中的活性氧含量为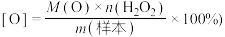 。
。
您最近一年使用:0次
解题方法
8 . 一种利用废旧三元锂离子电池分步回收金属的实验流程如下:
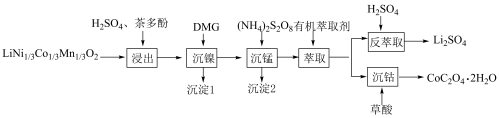
已知:
① 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;
②室温下,几种金属离子形成氢氧化物沉淀的 如下表:
如下表:
③DMG的结构为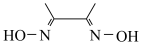 ;
;
④金属离子与有机萃取剂TBP结合能力为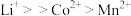 ,与P507的结合能力为
,与P507的结合能力为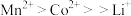 。
。
回答下列问题:
(1) 中锰元素的化合价是
中锰元素的化合价是___________ 。
(2) 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的___________ (填“正极”或“负极”)材料。
(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是___________ 。
(4)沉淀1为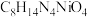 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是___________ (DMG用化学式表示),该过程中应控制溶液的 ,理论上最佳的
,理论上最佳的 不超过
不超过___________ (填序号),原因是___________ 。
A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是___________ 。
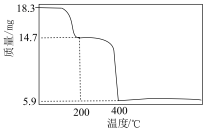
(6)有机萃取剂应选择___________ (填“TBP”或“P507”),利用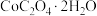 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是___________ (填化学式)。

已知:
①
 中元素
中元素 、
、 、
、 的价态分别为+1、+2、+3;
的价态分别为+1、+2、+3;②室温下,几种金属离子形成氢氧化物沉淀的
 如下表:
如下表:| 金属离子 |  |  |  |
开始沉淀 | 8.1 | 7.2 | 7.2 |
完全沉淀 | 10.1 | 8.7 | 8.7 |
 ;
;④金属离子与有机萃取剂TBP结合能力为
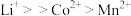 ,与P507的结合能力为
,与P507的结合能力为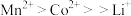 。
。回答下列问题:
(1)
 中锰元素的化合价是
中锰元素的化合价是(2)
 可表示为LNCM,充放电时
可表示为LNCM,充放电时 分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的
分别脱出、嵌入。为提高锂的回收率,回收前应对电池进行放电处理。判断LNCM是电池的(3)“浸出”后的溶液中过渡金属离子的化合价均为+2,茶多酚的作用是
(4)沉淀1为
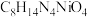 ,“沉镍”过程主要反应的离子方程式是
,“沉镍”过程主要反应的离子方程式是 ,理论上最佳的
,理论上最佳的 不超过
不超过A.7.2 B.8.1 C.8.7 D.10.1
(5)沉淀2为
 ,“沉锰”过程主要反应的离子方程式是
,“沉锰”过程主要反应的离子方程式是(6)有机萃取剂应选择
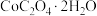 的热重图进行计算,可知400℃时的固体成分是
的热重图进行计算,可知400℃时的固体成分是
您最近一年使用:0次
解题方法
9 . 氧化铋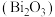 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有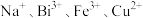 等。
等。
②盐酸羟胺常用作还原剂。
③ 在
在 时开始水解,
时开始水解,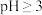 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。
④常温下部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
回答下列问题:
(1) 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为____________ 形。
(2)“滤渣1”的主要成分有 、
、____________ ,工业上以纯碱、石灰石、____________ (填化学式)为原料生产普通玻璃。
(3)写出“酸浸”步骤中 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:____________ 。
(4)“转化”步骤中加入盐酸羟胺 的目的是
的目的是____________ 。“调 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为____________ 。
(5)“滤液2”中主要的金属阳离子有____________ (填离子符号);流程中生成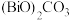 的化学方程式为
的化学方程式为____________ 。
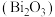 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有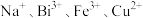 等。
等。②盐酸羟胺常用作还原剂。
③
 在
在 时开始水解,
时开始水解,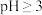 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。④常温下部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.7 |
| 完全沉淀 | 3.7 | 9.6 | 6.7 |
(1)
 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为(2)“滤渣1”的主要成分有
 、
、(3)写出“酸浸”步骤中
 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:(4)“转化”步骤中加入盐酸羟胺
 的目的是
的目的是 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为(5)“滤液2”中主要的金属阳离子有
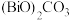 的化学方程式为
的化学方程式为
您最近一年使用:0次
2024-03-21更新
|
389次组卷
|
3卷引用:2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学
2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学黑龙江省部分学校2024届高三第二次模拟考试化学试题(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
10 . 热敏材料VO2可用于航天器的智能热辐射器,可用氧钒(Ⅳ)碱式碳酸铵[化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O]为原料制备。已知VO2+在酸性条件下易被氧化,氧钒(Ⅳ)碱式碳酸铵的制备流程如图:
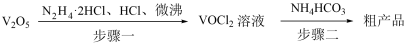
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能______ ;生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为______ 。
(2)步骤二可在如图装置中进行。
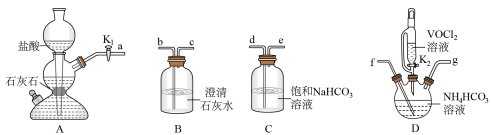
①仪器A的名称是_______ 。
②接口的连接顺序为a→_______ 。
③实验开始时,先关闭K2,打开K1,当_______ 时(写实验现象),再关闭K1,打开K2,充分反应,静置,得到固体。
(3)测定产品纯度
称取ag样品用稀硫酸溶解后,加入25.00mL0.02mol•L-1KMnO4溶液,VO2+化成VO ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。
①取用KMnO4溶液不能使用_______ 式滴定管,滴定至反应终点的实验现象为_______ 。
②下列情况会导致产品纯度偏小的是_______ (填标号)。
A.用标准液润洗滴定管后,液体从上口倒出
B.滴定达终点时,发现滴定管尖嘴内有气泡生成
C.Na2SO3溶液部分变质
D.滴定达终点时,俯视刻度线读数
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能
(2)步骤二可在如图装置中进行。

①仪器A的名称是
②接口的连接顺序为a→
③实验开始时,先关闭K2,打开K1,当
(3)测定产品纯度
称取ag样品用稀硫酸溶解后,加入25.00mL0.02mol•L-1KMnO4溶液,VO2+化成VO
 ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。①取用KMnO4溶液不能使用
②下列情况会导致产品纯度偏小的是
A.用标准液润洗滴定管后,液体从上口倒出
B.滴定达终点时,发现滴定管尖嘴内有气泡生成
C.Na2SO3溶液部分变质
D.滴定达终点时,俯视刻度线读数
您最近一年使用:0次



