解题方法
1 . 钴具有广泛用途,其正三价化合物具有强氧化性。利用低硫钴矿(含Ca、Fe、Al、Mn、Mg、Co等元素的硫化物及SiO2)可以制取多种化工试剂,采用以下工艺流程可利用低硫钴矿制备CoCO3。
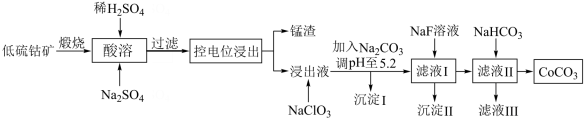
已知下列信息:
①常温下,Ksp(CaF2)=4.9×10-10,Ksp(MgF2)=6.4×10-12;
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)进行“酸溶”时,能提高“酸溶”速率的方法有___________ (任写1种)。
(2)酸溶时Co2O3被还原为Co2+,同时还有___________ 离子被还原。写出Co2O3转化为Co2+反应的离子方程式___________ 。
(3)加入NaClO的作用是___________ 。
(4)加入Na2CO3调pH至5.2,目的是___________ 。沉淀的I主要成分为___________
(5)为了将Mg2+、Ca2+除去[c(Mg2+)、c(Ca2+)≤1×10-5mol/L],加入NaF使“滤液I”中c(F-)最小为___________ mol/L。
(6)“沉钴”步骤的离子方程式是___________ 。

已知下列信息:
①常温下,Ksp(CaF2)=4.9×10-10,Ksp(MgF2)=6.4×10-12;
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 1.9 | 7.0 | 7.6 | 3.0 | 8.1 |
| 完全沉淀 | 3.2 | 9.0 | 9.2 | 4.7 | 10.1 |
(1)进行“酸溶”时,能提高“酸溶”速率的方法有
(2)酸溶时Co2O3被还原为Co2+,同时还有
(3)加入NaClO的作用是
(4)加入Na2CO3调pH至5.2,目的是
(5)为了将Mg2+、Ca2+除去[c(Mg2+)、c(Ca2+)≤1×10-5mol/L],加入NaF使“滤液I”中c(F-)最小为
(6)“沉钴”步骤的离子方程式是
您最近一年使用:0次
2 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
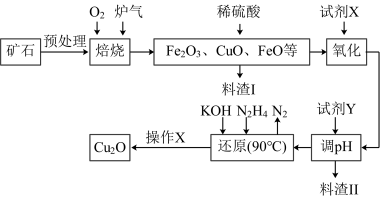
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是__________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________ 。当试剂X是______ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________ 。
(4)写出用N2H4制备Cu2O的化学方程式:________ ,操作X包括_________ 、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________ 。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:
您最近一年使用:0次
2020-03-16更新
|
674次组卷
|
11卷引用:西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题
西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题【市级联考】河南省安阳市2019届高三下学期二模考试理科综合化学试题重庆市云阳江口中学校2020届高三上学期第二次月考理综化学试题2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届人教版高三化学二轮复习非选择题专攻练——工艺流程云南省楚雄州禄丰县第一中学2020届高三下学期3月线上模拟考试理综化学试题山东省2020届高三模拟考试化学(二)山西省运城市稷山县第二中学2020届高三上学期第三次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题四川省内江市威远中学2021-2022学年高三上学期第三次月考化学试题
真题
名校
3 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________ 。该反应需要在加压下进行,原因是________________________ 。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
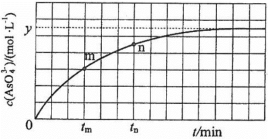
①下列可判断反应达到平衡的是__________ (填标号)。
a.溶液的pH不再变化
b.v(I−)=2v( )
)
c.c( )/c(
)/c( )不再变化
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________ 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________ 。
(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I−)=2v(
 )
)c.c(
 )/c(
)/c( )不再变化
)不再变化d.c(I−)=y mol·L−1
②tm时,v正
③tm时v逆
④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
2017-08-08更新
|
8531次组卷
|
16卷引用:西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题
西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)内蒙古集宁一中2018届高三上学期第三次月考化学试题(已下线)黄金30题系列 高三化学 大题易丢分(已下线)《考前20天终极攻略》-5月29日 化学反应原理综合(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密(已下线)解密20 原理综合题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题2020届湖南省湘潭市高三教学质量监测卷化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练广东省湛江市第二十一中学2021-2022学年高二上学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高三下学期3月月考化学试题云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题



