名校
解题方法
1 .  是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
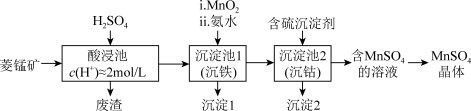
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括 、
、 、
、_______ 。
(2)沉淀池1中,先加 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:_______ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
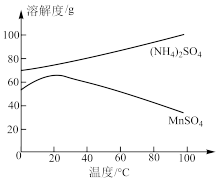
(4)图为 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为_______ 、洗涤、干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。
iii.加入指示剂,用b mol/L 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。
①补全步骤ⅱ中反应的离子方程式:_______ 。
 +
+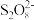 +_______
+_______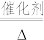
 +_______+_______
+_______+_______
②废渣中锰元素的质量分数为_______ 。
 是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
 、
、 、
、(2)沉淀池1中,先加
 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为
 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成
 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。iii.加入指示剂,用b mol/L
 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。①补全步骤ⅱ中反应的离子方程式:
 +
+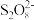 +_______
+_______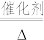
 +_______+_______
+_______+_______②废渣中锰元素的质量分数为
您最近一年使用:0次
2023-04-15更新
|
267次组卷
|
3卷引用:西藏自治区林芝市第二高级中学2023-2024学年高三上学期第三次月考理科综合试题
名校
解题方法
2 .  是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备
是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备 ,并测定产品中铁的含量。
,并测定产品中铁的含量。
I.制备晶体
i.称取 5 g 莫尔盐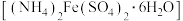 ,用 15 mL 水和几滴
,用 15 mL 水和几滴 溶液充分溶解,再加入25 mL饱和
溶液充分溶解,再加入25 mL饱和 溶液,加热至沸,生成黄色沉淀;
溶液,加热至沸,生成黄色沉淀;
ⅱ.将沉淀洗涤至中性,加入10 mL饱和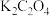 溶液,水浴加热至40℃,边搅拌边缓慢滴加
溶液,水浴加热至40℃,边搅拌边缓慢滴加 溶液,沉淀逐渐变为红褐色;
溶液,沉淀逐渐变为红褐色;
ⅲ.将混合物煮沸30 s,加入8 mL饱和 溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
II.测定产品中铁的含量
ⅳ.称量 制得的样品,加水溶解,并加入稀
制得的样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;
v.向ⅳ的溶液中加入过量Zn粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知: 为二元弱酸,具有较强的还原性
为二元弱酸,具有较强的还原性
(1)莫尔盐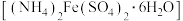 中铁元素的化合价是
中铁元素的化合价是_______ 。
(2)步骤ⅰ中黄色沉淀的化学式为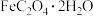 ,生成该沉淀的离子方程式是
,生成该沉淀的离子方程式是_______ 。
(3)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为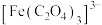 、将下述反应的离子方程式补充完整
、将下述反应的离子方程式补充完整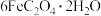 +____+____=
+____+____= ____
____ ,
,_____________ 。
(4)步骤ⅱ中水浴加热的温度不宜过高,原因是_______ 。
(5)步骤iv在铁的含量测定中所起的作用是_______ 。
(6)已知:ⅴ中Zn粉将铁元素全部还原为 ;反应中
;反应中 转化为
转化为 。则该样品中铁元素的质量分数是
。则该样品中铁元素的质量分数是_______ (用含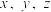 的代数式表示)。
的代数式表示)。
 是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备
是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备 ,并测定产品中铁的含量。
,并测定产品中铁的含量。I.制备晶体
i.称取 5 g 莫尔盐
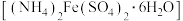 ,用 15 mL 水和几滴
,用 15 mL 水和几滴 溶液充分溶解,再加入25 mL饱和
溶液充分溶解,再加入25 mL饱和 溶液,加热至沸,生成黄色沉淀;
溶液,加热至沸,生成黄色沉淀;ⅱ.将沉淀洗涤至中性,加入10 mL饱和
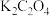 溶液,水浴加热至40℃,边搅拌边缓慢滴加
溶液,水浴加热至40℃,边搅拌边缓慢滴加 溶液,沉淀逐渐变为红褐色;
溶液,沉淀逐渐变为红褐色;ⅲ.将混合物煮沸30 s,加入8 mL饱和
 溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。II.测定产品中铁的含量
ⅳ.称量
 制得的样品,加水溶解,并加入稀
制得的样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;v.向ⅳ的溶液中加入过量Zn粉,反应完全后,弃去不溶物,向溶液中加入稀
 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:
 为二元弱酸,具有较强的还原性
为二元弱酸,具有较强的还原性(1)莫尔盐
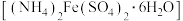 中铁元素的化合价是
中铁元素的化合价是(2)步骤ⅰ中黄色沉淀的化学式为
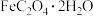 ,生成该沉淀的离子方程式是
,生成该沉淀的离子方程式是(3)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为
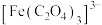 、将下述反应的离子方程式补充完整
、将下述反应的离子方程式补充完整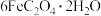 +____+____=
+____+____= ____
____ ,
,(4)步骤ⅱ中水浴加热的温度不宜过高,原因是
(5)步骤iv在铁的含量测定中所起的作用是
(6)已知:ⅴ中Zn粉将铁元素全部还原为
 ;反应中
;反应中 转化为
转化为 。则该样品中铁元素的质量分数是
。则该样品中铁元素的质量分数是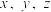 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2020-12-19更新
|
143次组卷
|
4卷引用:西藏拉萨中学2021届高三上学期第三次月考理综化学试题
3 . 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)沉淀A的主要成分是__ 。
(2)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__ ,请写出相应的离子方程式:__ 。
(3)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L-1KMnO4溶液36.00mL。
①请配平此滴定过程中的反应。
___ MnO +
+___ H++___ H2C2O4——___ Mn2++___ CO2+___ H2O
②求该水泥样品中钙的质量分数为___ 。

回答下列问题:
(1)沉淀A的主要成分是
(2)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
(3)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L-1KMnO4溶液36.00mL。
①请配平此滴定过程中的反应。
 +
+②求该水泥样品中钙的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸,然后关闭活塞b。
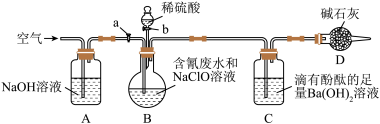
已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-、2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
(1)B中盛装稀硫酸的仪器的名称是_____________ 。
(2)装置D的作用是_________________ ,装置C中的实验现象为______________ 。
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为_________ mg·L−1。
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN−的含量__________ (选填“偏大”、“偏小”、“不变”)。
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为_________________ 。
(5)除去废水中CN−的一种方法是在碱性条件下,用H2O2将CN−氧化生成N2,反应的离子方程式为_____________________________ 。

已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-、2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
(1)B中盛装稀硫酸的仪器的名称是
(2)装置D的作用是
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN−的含量
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为
(5)除去废水中CN−的一种方法是在碱性条件下,用H2O2将CN−氧化生成N2,反应的离子方程式为
您最近一年使用:0次
2020-06-03更新
|
480次组卷
|
5卷引用:西藏林芝市第二高级中学2022-2023学年高三上学期第三次月考化学试题
名校
解题方法
5 . 二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
① 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体
② 与KI反应的离子方程式为:
与KI反应的离子方程式为: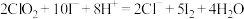 。
。
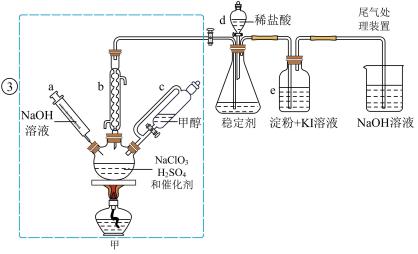
(1)仪器b在装置中的作用是______________ ;比较仪器c和d,实验中c的优点是_____________ 。
(2)制备装置甲中需改进的一项措施是________________ 。
(3)反应中甲醇被氧化为甲酸,写出制备 的化学方程式:
的化学方程式:________________ ;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________ 。
(4)下列有关说法正确的是__________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的
B.装置e主要用于检验是否有 生成
生成
C.在 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: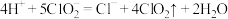
D. 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍
(5)自来水厂用碘量法检测水中 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL 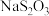 标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为__________  。
。
 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。已知:
①
 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体②
 与KI反应的离子方程式为:
与KI反应的离子方程式为: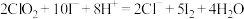 。
。| 物质 |  |  |  |
| 沸点 | 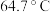 | 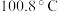 | 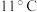 |

(1)仪器b在装置中的作用是
(2)制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备
 的化学方程式:
的化学方程式:(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的

B.装置e主要用于检验是否有
 生成
生成C.在
 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: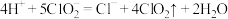
D.
 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍(5)自来水厂用碘量法检测水中
 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL 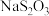 标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为 。
。
您最近一年使用:0次
2020-02-27更新
|
951次组卷
|
8卷引用:西藏拉萨中学2021届高三上学期第四次月考理综化学试题
名校
6 . I.下列物质:①氢氧化钠溶液、②铝片、③液态HCl 、④葡萄糖、⑤熔融的NaCl、⑥SO2 气体、⑦碳酸氢钠、 ⑧氧化铝
(1)属于电解质的是______________________ 。(填编号)
(2)能导电的是____________________________________ 。(填编号)
(3)①和②反应的离子方程式________________________________ 。
II.实验室可通过K2Cr2O7溶液测定补铁剂中FeSO4的含量,反应如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。_______________
(2)该反应的还原产物为__________ 。若反应中消耗1 mol K2Cr2O7,则转移电子数为______ 。
(1)属于电解质的是
(2)能导电的是
(3)①和②反应的离子方程式
II.实验室可通过K2Cr2O7溶液测定补铁剂中FeSO4的含量,反应如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。
(2)该反应的还原产物为
您最近一年使用:0次
2019-12-29更新
|
81次组卷
|
2卷引用:西藏山南市第二高级中学2021届高三上学期第二次月考理综化学试题
7 . 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________ (填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
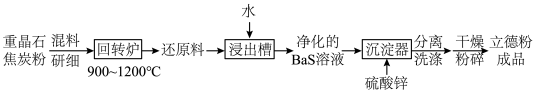
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________ 。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________ 。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________ (填化学式)。
③沉淀器中反应的离子方程式为______________________ 。
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2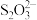 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________ ,样品中S2−的含量为______________ (写出表达式)。
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的
③沉淀器中反应的离子方程式为
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2
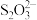 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
您最近一年使用:0次
2019-06-09更新
|
16159次组卷
|
25卷引用:西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题
西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题2019年全国统一考试化学试题(新课标Ⅱ)2020届人教版高三化学二轮复习非选择题专攻练——工艺流程专题3.1 金属及其化合物(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)——2021年高考化学一轮复习讲练测河南省南阳市2021届高三期中质量评估化学试题专题4 第二单元 综合拔高练-高中化学苏教2019版必修第一册(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河南省南阳市2021届高三上期期中考试化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)湖北省安陆市第一高级中学2021-2022学年高一下学期开学考试化学试题福建省龙岩第一中学2021-2022学年高二上学期第二次月考化学试题(实验班)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题18 工艺流程题(已下线)T26-工业流程题
解题方法
8 . 本题为《化学与生活(选修1)》选做题。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
(2)矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于_____________ (填“可回收物”或“可堆肥垃圾”);
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式_____________ 。
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是__________

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
(6)化学与生活关系密切。现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①__________ 是重要的体内能源;
②__________ 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
(8) “辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料。生铁和钢成分上的主要差别是_________;
(9)钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为__________ 。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
| A.科学合理使用农药 | B.任意排放化工厂废水 | C.处理生活污水,达标排放 |
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
| A.吸烟会对室内和公共场所造成污染 |
| B.吸入焦油、尼古丁及颗粒物可导致多种病变 |
| C.N2、CO2、CO尼古丁和都属于室内空气污染物 |
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①
②
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
| A.玻璃 | B.陶瓷 | C.水泥 |
| A.碳的含量不同 |
| B.磷、硫的含量不同 |
| C.镍、铬等金属含量不同 |
您最近一年使用:0次
2019-01-30更新
|
80次组卷
|
2卷引用:2015-2016学年西藏日喀则一中高二6月月考化学试卷
9 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
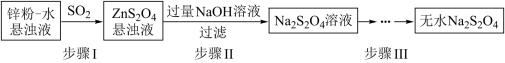
①步骤I中SO2表现了____________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________ ,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________ .
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。____________________________ .
(1)保险粉应如何保存?
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
您最近一年使用:0次
2016-12-09更新
|
478次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三上学期第三次月考理综化学试题



