名校
1 . 常温下,下列各组离子一定能大量共存的是
A.0.1mol/L的AlCl3溶液中:K+、Na+、 、 、 |
B.使甲基橙变红的溶液中:Ba2+、 、 、 、Fe2+ 、Fe2+ |
| C.0.1mol/L的NH3·H2O溶液中:Ba2+、K+、Cl-、I- |
D.由水电离出的 的溶液中:Na+、 的溶液中:Na+、 、 、 、 、 |
您最近一年使用:0次
名校
2 . 下列各组离子在相应的条件下可能大量共存的是
A.常温下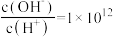 的溶液中: 的溶液中: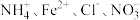 |
B.含有 的溶液中: 的溶液中: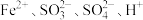 |
C.常温下由水电离产生的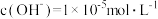 的溶液中: 的溶液中: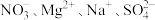 |
D.常温下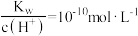 的溶液中: 的溶液中: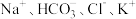 |
您最近一年使用:0次
名校
解题方法
3 . 38.4gCu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示
 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示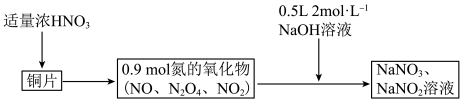
| A.硝酸在反应中既体现氧化性又体现酸性 |
| B.氮的氧化物和NaOH溶液反应时,NO作还原剂 |
C.混合气体中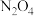 的物质的量是0.2mol 的物质的量是0.2mol |
| D.若浓硝酸体积为200mL,则其物质的量浓度为11mol/L |
您最近一年使用:0次
2024-02-17更新
|
1332次组卷
|
14卷引用:江西省宜春市上高二中2023-2024学年高一下学期3月月考化学试题
江西省宜春市上高二中2023-2024学年高一下学期3月月考化学试题 陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题重庆市第七中学校2023-2024学年高一下学期第一次月考化学试卷广东省佛山市顺德区容山中学2023-2024学年高一下学期3月月考化学试题(已下线)安徽省皖北县中联盟2023-2024学年高一下学期3月月考化学试题内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题山东省临沂第四中学2023-2024学年高一下学期3月月考化学试题江西省抚州市金溪县第一中学2023-2024学年高一下学期第一次月考化学试卷江西省宜春市丰城中学2023-2024学年高一下学期3月月考化学试题陕西省商洛市商州区高级中学2023-2024学年高一下学期3月月考化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题四川省射洪中学校强基班2023-2024学年高一下学期4月第一次月考化学试题黑龙江省哈尔滨市第六中学校2023-2024学年高一下学期4月测试化学试卷山东省淄博第十一中学2023-2024学年高一下学期4月阶段性考试化学试卷
4 . 一种从废钼钴催化剂中回收有价金属的工艺流程如图甲所示:
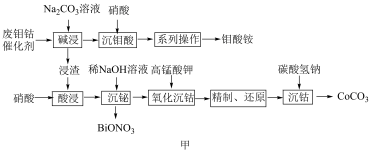
已知:I.废钼钴催化剂的主要成分如表。
II.“酸浸”所得溶液中主要含有H+、Bi3+、Co2+等阳离子。
回答下列问题:
(1)钼酸铵 中Mo元素的化合价为
中Mo元素的化合价为_______ ,其所含非金属元素的电负性由大到小排序为_______ 。
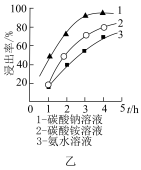
(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为_______ 。
(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为_______ 。
(4)“沉铋”时,反应的离子方程式为_______ 。
(5)“氧化沉钴”时调节溶液 ,反应生成
,反应生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
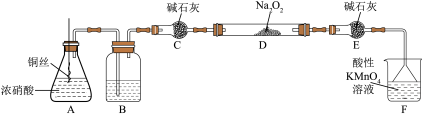
(6)若通过该流程处理1kg废钼钴催化剂,得到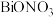 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近_____ (填标号)(Bi元素的回收率 )。
)。
A.70% B.80% C.90%

已知:I.废钼钴催化剂的主要成分如表。
| 主要成分 |  |  |  |
| 质量分数 | 44.61% | 6.67% | 13.98% |
回答下列问题:
(1)钼酸铵
 中Mo元素的化合价为
中Mo元素的化合价为(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为

(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为
(4)“沉铋”时,反应的离子方程式为
(5)“氧化沉钴”时调节溶液
 ,反应生成
,反应生成 和
和 ,其离子方程式为
,其离子方程式为(6)若通过该流程处理1kg废钼钴催化剂,得到
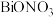 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近 )。
)。A.70% B.80% C.90%
您最近一年使用:0次
名校
解题方法
5 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
)是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
已知: ;酸性条件下,NO、
;酸性条件下,NO、 和
和 均能与
均能与 反应生成
反应生成 和
和 。
。
(1)装置B中发生反应的化学方程式为___________ 。
(2)装置C、E的作用是___________ 。
(3) 反应完全后,为测定产品纯度,该小组取
反应完全后,为测定产品纯度,该小组取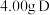 中的产品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用
中的产品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验所得数据如表(假设酸性
溶液进行滴定,实验所得数据如表(假设酸性 溶液不与杂质反应):
溶液不与杂质反应):
① 标准溶液应用
标准溶液应用___________ (填“酸式”或“碱式”)滴定管盛装,注入 标准溶液之前,滴定管需要
标准溶液之前,滴定管需要___________ 、洗涤和润洗。
②第一次实验数据出现异常,造成这种异常的原因可能是___________ (填代号)。
a.锥形瓶洗净后未干燥
b.盛装 的滴定管用蒸馏水洗净后未用标准液润洗
的滴定管用蒸馏水洗净后未用标准液润洗
c.滴定前平视读数,滴定终点时俯视读数
d.盛装 的滴定管滴定前有气泡,滴定后气泡消失
的滴定管滴定前有气泡,滴定后气泡消失
③滴定终点的实验现象为___________ ,该产品中亚硝酸钠的质量分数为___________ 。(计算结果保留4位有效数字)
(4)若 未反应完全,则会使产品纯度的测定结果
未反应完全,则会使产品纯度的测定结果___________ (“偏大”“偏小”或“无影响”)。
 )是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
)是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
已知:
 ;酸性条件下,NO、
;酸性条件下,NO、 和
和 均能与
均能与 反应生成
反应生成 和
和 。
。(1)装置B中发生反应的化学方程式为
(2)装置C、E的作用是
(3)
 反应完全后,为测定产品纯度,该小组取
反应完全后,为测定产品纯度,该小组取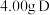 中的产品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用
中的产品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验所得数据如表(假设酸性
溶液进行滴定,实验所得数据如表(假设酸性 溶液不与杂质反应):
溶液不与杂质反应):| 滴定次数 | 1 | 2 | 3 | 4 |
消耗 溶液体积/mL 溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
 标准溶液应用
标准溶液应用 标准溶液之前,滴定管需要
标准溶液之前,滴定管需要②第一次实验数据出现异常,造成这种异常的原因可能是
a.锥形瓶洗净后未干燥
b.盛装
 的滴定管用蒸馏水洗净后未用标准液润洗
的滴定管用蒸馏水洗净后未用标准液润洗c.滴定前平视读数,滴定终点时俯视读数
d.盛装
 的滴定管滴定前有气泡,滴定后气泡消失
的滴定管滴定前有气泡,滴定后气泡消失③滴定终点的实验现象为
(4)若
 未反应完全,则会使产品纯度的测定结果
未反应完全,则会使产品纯度的测定结果
您最近一年使用:0次
名校
6 . 含氮化合物的处理对环境保护意义重大。研究氮及其化合物的性质,可以有效改善人类的生存环境。
(1)N原子的电子式为___________ 。
(2)用 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为______ 。
(3)实验室常用NaOH溶液吸收 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下:
 ;
; (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。
①若 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为______ 。
②若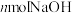 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为______ L(标准状况)。
③将这两个反应中的产物进行分类,分类方法错误的是______ 。
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:
①NO的物质的量为___________ mol, 的体积为
的体积为___________ L(标准状况)。
②待产生的气体全部释放后,向溶液中加入 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________  。
。
(1)N原子的电子式为
(2)用
 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为(3)实验室常用NaOH溶液吸收
 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。①若
 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为②若
 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为③将这两个反应中的产物进行分类,分类方法错误的是
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和
 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:①NO的物质的量为
 的体积为
的体积为②待产生的气体全部释放后,向溶液中加入
 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近一年使用:0次
名校
7 . 为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
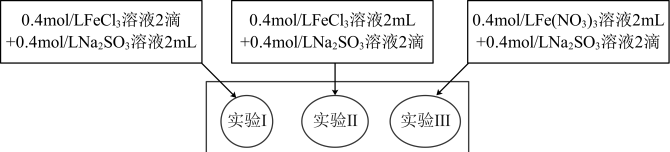
资料:铁氰化钾遇到Fe2+后会生成铁氰化亚铁蓝色沉淀
小组记录的实验现象如下:
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是______ (用离子方程式表示)。
(2)开始混合时,实验I中红褐色比Ⅱ、Ⅲ中略浅的原因是______ 。
(3)为了探究5min后实验Ⅱ、Ⅲ中溶液红褐色变浅的原因,小组同学设计了实验Ⅳ:
分别取少量5min后实验I、Ⅱ、Ⅲ中溶液,加入2滴铁氰化钾溶液,发现实验Ⅱ、Ⅲ中出现蓝色沉淀,实验I中无明显变化.根据实验Ⅳ的现象,结合化学用语解释红褐色变浅的原因是______ 。
(4)针对5min后实验Ⅲ中溶液颜色比实验Ⅱ中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与 的氧化还原反应;②
的氧化还原反应;②______ ;
③ 在酸性环境下代替Fe3+氧化了
在酸性环境下代替Fe3+氧化了 ,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验Ⅴ和实验Ⅵ进行因素探究:
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,你的实验结论是:__________

资料:铁氰化钾遇到Fe2+后会生成铁氰化亚铁蓝色沉淀
小组记录的实验现象如下:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比Ⅱ、Ⅲ中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验Ⅱ | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验Ⅲ | 溶液立即变为红褐色 | 红褐色变浅,比Ⅱ中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是
(2)开始混合时,实验I中红褐色比Ⅱ、Ⅲ中略浅的原因是
(3)为了探究5min后实验Ⅱ、Ⅲ中溶液红褐色变浅的原因,小组同学设计了实验Ⅳ:
分别取少量5min后实验I、Ⅱ、Ⅲ中溶液,加入2滴铁氰化钾溶液,发现实验Ⅱ、Ⅲ中出现蓝色沉淀,实验I中无明显变化.根据实验Ⅳ的现象,结合化学用语解释红褐色变浅的原因是
(4)针对5min后实验Ⅲ中溶液颜色比实验Ⅱ中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与
 的氧化还原反应;②
的氧化还原反应;②③
 在酸性环境下代替Fe3+氧化了
在酸性环境下代替Fe3+氧化了 ,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。通过实验Ⅴ和实验Ⅵ进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验Ⅴ | 在2mLpH=1.0的0.4mol/LFe(NO3)3溶液中溶解约 | 溶液的红褐色介于Ⅱ、Ⅲ之间 |
实验Ⅵ | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加入2滴0.4mol/LNa2SO3溶液.向其中滴入少量BaCl2溶液 |
(5)通过上述实验,你的实验结论是:
您最近一年使用:0次
名校
8 . 下列物质用途或操作正确且与盐类水解有关的一组是
①用热饱和硫酸铵溶液清洗铁器表面的铁锈
②用 水溶液制备
水溶液制备
③用氯化铁溶液和氨水制备氢氧化铁胶体
④实验室通常使用热的纯碱溶液去除油污
⑤在氯化氢氛围中灼烧氯化镁晶体制备无水氯化镁
⑥配制 溶液时将
溶液时将 晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
⑦刻蚀印刷电路板用氯化铁作腐蚀液
⑧用泡沫灭火器灭火
①用热饱和硫酸铵溶液清洗铁器表面的铁锈
②用
 水溶液制备
水溶液制备
③用氯化铁溶液和氨水制备氢氧化铁胶体
④实验室通常使用热的纯碱溶液去除油污
⑤在氯化氢氛围中灼烧氯化镁晶体制备无水氯化镁
⑥配制
 溶液时将
溶液时将 晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度⑦刻蚀印刷电路板用氯化铁作腐蚀液
⑧用泡沫灭火器灭火
| A.①②④⑤⑧ | B.③④⑤⑦⑧ | C.①②④⑤⑥ | D.②③④⑤⑥ |
您最近一年使用:0次
名校
9 . Ⅰ.部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如图所示。
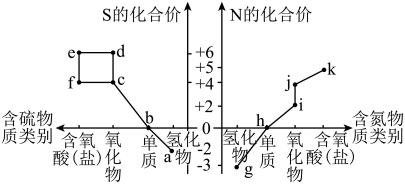
回答下列问题:
(1)j的化学名称是___________ 。
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是___________ (填字母)。
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将pH=1的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是___________ 。
Ⅱ.S4N4(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入S2Cl2的CCl4溶液中,可制得该物质:6S2Cl2+16g=S4N4+S8+12NH4Cl(已知S8是硫单质中最稳定的)。
(4)上述制备反应中,物质g体现的性质有___________ ,其中被氧化的元素是___________ (填元素符号)。
(5)S4N4在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是___________ 。
Ⅲ.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140℃反应制得,氯气过量则会生成SCl2,S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
(6)该固体是___________ (填名称)。
(7)甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案___________ (填“可行”或“不可行”),原因是___________ 。
(8)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为___________ ,由此可知产品中___________ (填“含有”或“不含有”)SCl2杂质。

回答下列问题:
(1)j的化学名称是
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将pH=1的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是
Ⅱ.S4N4(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入S2Cl2的CCl4溶液中,可制得该物质:6S2Cl2+16g=S4N4+S8+12NH4Cl(已知S8是硫单质中最稳定的)。
(4)上述制备反应中,物质g体现的性质有
(5)S4N4在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是
Ⅲ.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140℃反应制得,氯气过量则会生成SCl2,S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
(6)该固体是
(7)甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案
(8)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为
您最近一年使用:0次
名校
10 . 在不同温度下,稀溶液中 与
与 有如图所示关系。下列说法正确的是
有如图所示关系。下列说法正确的是

 与
与 有如图所示关系。下列说法正确的是
有如图所示关系。下列说法正确的是
A. |
B.a点对应的溶液中可能大量存在: 、 、 、 、 、 、 |
C.b点对应的溶液中可能大量存在: 、 、 、 、 、 、 |
D.c点对应的溶液中,由水电离出的 可能为 可能为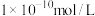 |
您最近一年使用:0次



