某研究小组为测定软锰矿中MnO2的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34gNa2C2O4再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250mL容量瓶中并定容。取出25.00mL待测液置于锥形瓶中,再用0.0100mol/L KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。(已知KMnO4、MnO2在酸性条件下均能将NaC2O4氧化,且还原产物均为Mn2+。)
(1)配制240mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为_______ g(保留4位有效数字),需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为________ (填名称)。
(2)酸化KMnO4溶液可选用的酸是_______ ,KMnO4标准溶液应置于________ (填 “酸式”或“碱式”)滴定管中,原因是_______ 。
(3)KMnO4和Na2C2O4在酸性条件下反应的离子方程式为_______ 。
(4)到达滴定终点的实验现象是________ 。
(5)根据实验数据计算,软锰矿中MnO2的质量分数为_______ %。
(1)配制240mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为
(2)酸化KMnO4溶液可选用的酸是
(3)KMnO4和Na2C2O4在酸性条件下反应的离子方程式为
(4)到达滴定终点的实验现象是
(5)根据实验数据计算,软锰矿中MnO2的质量分数为
更新时间:2020-08-20 11:57:50
|
【知识点】 酸碱中和滴定原理的应用解读
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】三草酸合铁(III)酸钾K3[Fe(C2O4)3]•3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:
I.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL蒸馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O4•2H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O4•2H2O晶体的化学方程式_______ 。检验FeC2O4•2H2O晶体是否洗涤干净的方法是_______ 。
(2)步骤②中检验Fe2+是否完全转化的操作为_______ 。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是_______ 。
II.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化, 被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中 被还原成Mn2+。
被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯_______ ,_______ ,_______ 。
(5)写出步骤三中发生反应的离子方程式_______ 。
(6)实验测得该晶体中铁的质量分数为_______ (结果保留3位有效数字)。
I.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL蒸馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O4•2H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O4•2H2O晶体的化学方程式
(2)步骤②中检验Fe2+是否完全转化的操作为
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是
II.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,
 被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中
 被还原成Mn2+。
被还原成Mn2+。步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯
(5)写出步骤三中发生反应的离子方程式
(6)实验测得该晶体中铁的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】1828年,德国化学家弗里德里希·维勒首次使用(NH4)2SO4与氰酸钾KCNO人工合成了尿素CO(NH2)2,打破了有机化合物的"生命力"学说。
(1) (NH4)2SO4与KCNO合成尿素反应的化学方程式为____________ 。
(2)某小组同学在实验室条件下,拟用CO2和NH3,在催化剂的作用下合成尿素。
①用CO2和NH3合成尿素CO(NH2)2反应的化学方程式为____________ 。
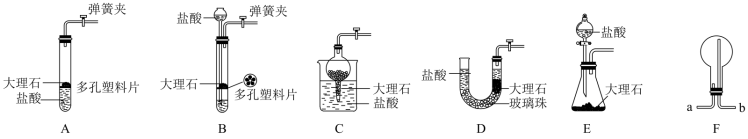
②实验所需的CO2可用多种装置来制备,要想达到“随开随用、随关随停”的目的,下列装置A、B、C、D、E中符和要求的有____________ (填字母)。
③若用F装置收集氨气,则气体应由导管口____________ (填“a”或“b”)进入。
(3)尿素样品中氮含量可以用甲醛法标定,其原理如下:首先用浓硫酸分解试样,使试液中的胺生成硫酸铵并放出二氧化碳;将过量的硫酸中和后得到中性铵盐,再用甲醛(HCHO)与硫酸铵作用生成六次甲基四铵盐离子(CH2)6N4 H+和硫酸;最后用标准氢氧化钠溶液滴定。
①甲醛与硫酸铵反应的离子方程式为____________ ;
②滴定选用的指示剂为____________ 。滴定终点的现象为____________ 。
③若称取样品m g,溶解后配成250mL溶液。取25.00mL样品溶液于250 mL锥形瓶中,加入10mL w%的甲醛溶液,充分反应后,加入1~2滴指示剂,用浓度为a mol/L的NaOH标准溶液滴定至终点(已知滴定时,1 mol六次甲基四铵盐离子(CH2)6N4H+消耗OH﹣的能力与1mol H+相当)。重复2次,消耗NaOH标准溶液的体积平均值为b mL。则该样品中氮的质量分数为____________ 。
(1) (NH4)2SO4与KCNO合成尿素反应的化学方程式为
(2)某小组同学在实验室条件下,拟用CO2和NH3,在催化剂的作用下合成尿素。
①用CO2和NH3合成尿素CO(NH2)2反应的化学方程式为
②实验所需的CO2可用多种装置来制备,要想达到“随开随用、随关随停”的目的,下列装置A、B、C、D、E中符和要求的有
③若用F装置收集氨气,则气体应由导管口

(3)尿素样品中氮含量可以用甲醛法标定,其原理如下:首先用浓硫酸分解试样,使试液中的胺生成硫酸铵并放出二氧化碳;将过量的硫酸中和后得到中性铵盐,再用甲醛(HCHO)与硫酸铵作用生成六次甲基四铵盐离子(CH2)6N4 H+和硫酸;最后用标准氢氧化钠溶液滴定。
①甲醛与硫酸铵反应的离子方程式为
②滴定选用的指示剂为
③若称取样品m g,溶解后配成250mL溶液。取25.00mL样品溶液于250 mL锥形瓶中,加入10mL w%的甲醛溶液,充分反应后,加入1~2滴指示剂,用浓度为a mol/L的NaOH标准溶液滴定至终点(已知滴定时,1 mol六次甲基四铵盐离子(CH2)6N4H+消耗OH﹣的能力与1mol H+相当)。重复2次,消耗NaOH标准溶液的体积平均值为b mL。则该样品中氮的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域。某实验小组制备硫代硫酸钠并探究其性质。
Ⅰ:硫代硫酸钠的制备
实验小组设计如下装置制备硫代硫酸钠
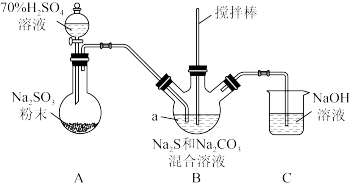
已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2S2O3中S元素的化合价分别为-2和+6
(1)仪器a的名称是___________ 。A中发生的化学反应方程式为___________ 。
(2)为了保证Na2S2O3的产量,实验中通入的SO2不能过量,需控制A中SO2的生成速率,采取的措施是___________ 。
Ⅱ:产品纯度的测定
①溶液配制:准确取该硫代硫酸钠样品2.0000g,配制成250mL溶液。
②滴定:向锥形瓶中加入20.00mL0.01mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应: +5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2
+5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2 =
= +2I-。
+2I-。
(3)滴定终点现象为________ ,消耗样品溶液的用量为25.00mL,则样品纯度为________ %(保留1位小数)
Ⅲ:硫代硫酸钠性质的探究
①取Na2S2O3晶体,溶解,配成0.2mol/L溶液。
②取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2:___________(不考虑空气中氧气氧化)。
设计实验方案:

(4)假设2是___________ 。
(5)第②组实验中胶头滴管加入的试剂是___________ 。
(6)依据现象,S产生的主要原因是___________ 。
Ⅰ:硫代硫酸钠的制备
实验小组设计如下装置制备硫代硫酸钠

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2S2O3中S元素的化合价分别为-2和+6
(1)仪器a的名称是
(2)为了保证Na2S2O3的产量,实验中通入的SO2不能过量,需控制A中SO2的生成速率,采取的措施是
Ⅱ:产品纯度的测定
①溶液配制:准确取该硫代硫酸钠样品2.0000g,配制成250mL溶液。
②滴定:向锥形瓶中加入20.00mL0.01mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:
 +5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2
+5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2 =
= +2I-。
+2I-。(3)滴定终点现象为
Ⅲ:硫代硫酸钠性质的探究
①取Na2S2O3晶体,溶解,配成0.2mol/L溶液。
②取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2:___________(不考虑空气中氧气氧化)。
设计实验方案:

| 胶头滴管 | 现象 | |
| 第①组 | 1mL饱和氯水 | 立即出现浑浊 |
| 第②组 | ___________ | 一段时间后出现浑浊,且浑浊度比①组小 |
(5)第②组实验中胶头滴管加入的试剂是
(6)依据现象,S产生的主要原因是
您最近一年使用:0次



